人教版 高中化学 必修二 第二章 第二节 化学能与电能(燃料电池和化学电源)22ppt
文档属性
| 名称 | 人教版 高中化学 必修二 第二章 第二节 化学能与电能(燃料电池和化学电源)22ppt |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-26 21:43:49 | ||
图片预览





文档简介
(共22张PPT)
第二节 化学能与电能
燃料电池
1.掌握原电池——燃料电池的电极反应方程式的书写。(重点)
2.了解常见的充电电池电解反应方程式的书写。
【思考与交流】
能否根据 2H2 + O2 ====2H2O 这个反应,
设计一个原电池?
2.燃料电池
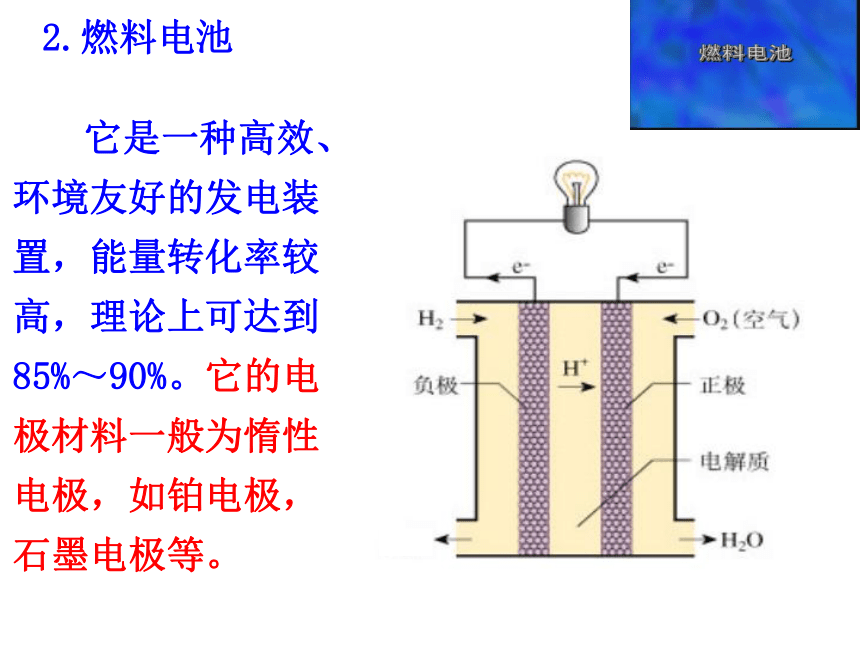
【电极材料】一般为惰性电极,如铂电极,石墨电极等。
【电解质溶液】
稀酸溶液或者
稀碱溶液
2.燃料电池
它是一种高效、环境友好的发电装置,能量转化率较高,理论上可达到85%~90%。它的电极材料一般为惰性电极,如铂电极,石墨电极等。
燃料电池的反应本质:
燃料 燃烧 发生氧化还原反应
2H2 + O2 ====2H2O
负极:
燃料,如 H2 ,CH4,乙醇
正极:
助燃剂,如 O2 ,Cl2
燃料电池优点:高效、环保、能量转化率高。
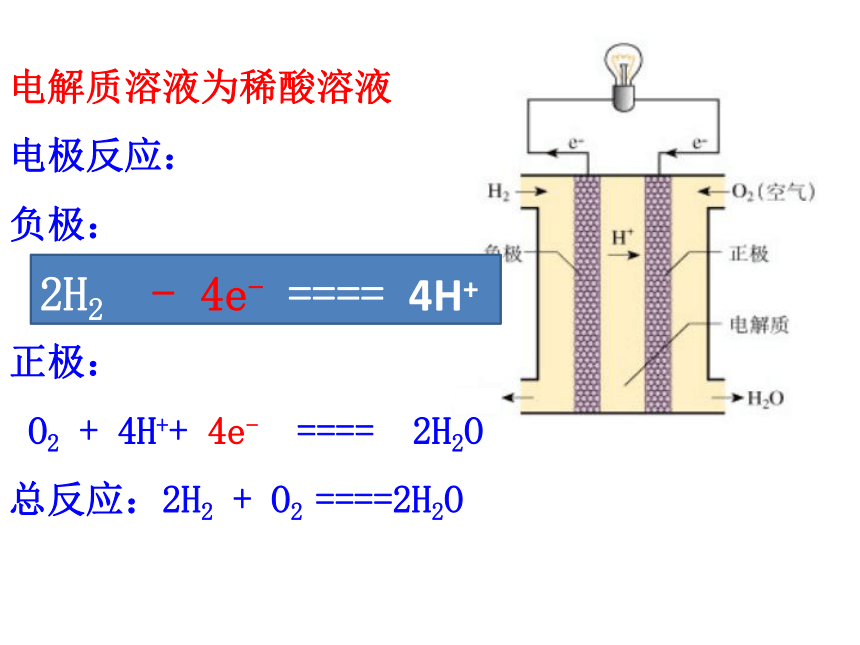
电解质溶液为稀酸溶液
电极反应:
负极:
H2 - 2e- ==== 2H+
正极:
O2 + 4H++ 4e- ==== 2H2O
总反应:2H2 + O2 ====2H2O
2H2 - 4e- ==== 4H+
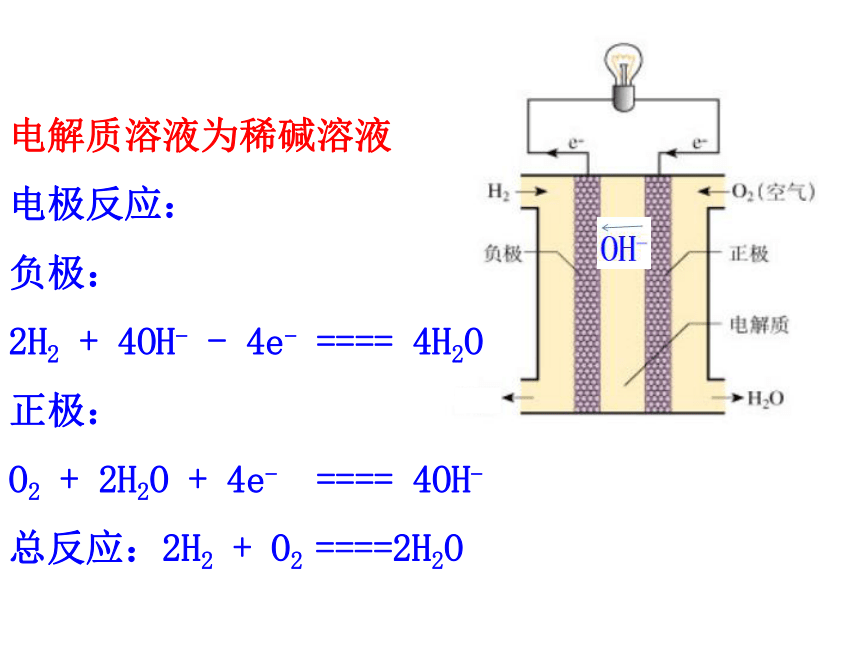
电解质溶液为稀碱溶液
电极反应:
负极:
2H2 + 4OH- - 4e- ==== 4H2O
正极:
O2 + 2H2O + 4e- ==== 4OH-
总反应:2H2 + O2 ====2H2O
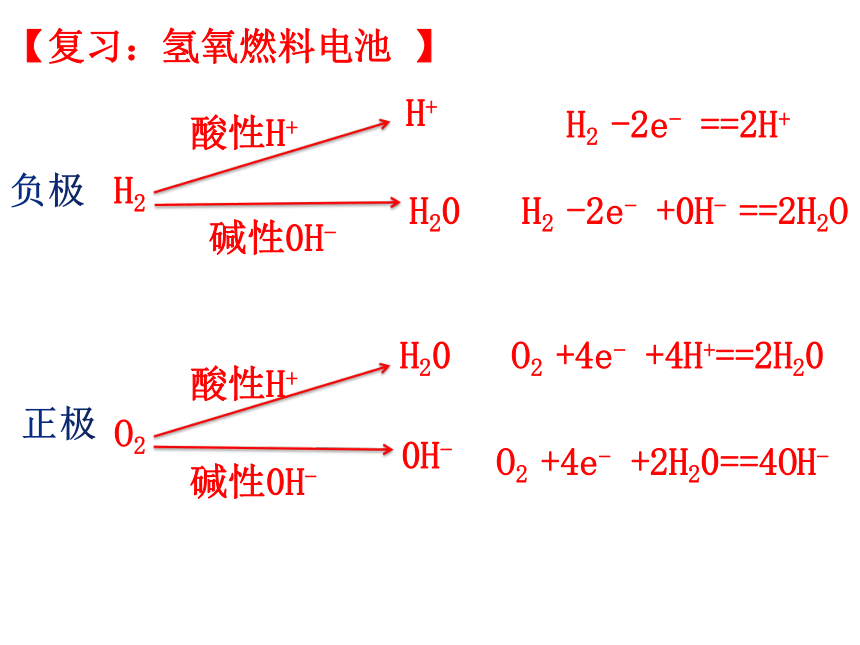
【复习:氢氧燃料电池 】
H2
O2
酸性H+
碱性0H-
H+
H2 -2e- ==2H+
H20
H2 -2e- +0H- ==2H2O
酸性H+
H20
O2 +4e- +4H+==2H20
碱性0H-
0H-
O2 +4e- +2H20==4OH-
【思考与交流】
试着根据 CH4 + O2 ==== CO2 + 2H2O 这个反应,
分别写出酸性和碱性这两个条件下的电极反应方程式?
电解质溶液若为稀酸(H+)溶液
电极反应:
负极:
CH4 - 8e- + 2H2O == 8H+ + CO2
正极:
O2 + 4H+ + 4e- == 2H2O
总反应:
2O2 + 8H+ + 8e- == 4H2O
CH4 + O2 ==== CO2 + 2H2O
CH4 + O2 ==== CO2 + 2H2O
电解质溶液为足量的稀碱(OH-)溶液
负极:
CH4 + 10 OH- - 8e- == 7 H2O + CO32-
正极:
O2 + 2 H2O + 4e- == 4 OH-
总反应:
2O2 + 4 H2O + 8e- == 8 OH-
CH4 + O2 ==== CO2 + 2H2O
CH4 + 2O2 + 2OH- == CO32- + 3H2O
稀碱(OH-)溶液会与CO2 反应吗?
稀碱(OH-)多与CO2 反应生成CO32-
稀碱(OH-)少与CO2 反应生成HCO32-
电解质溶液为足量的稀碱(OH-)溶液
负极:
CH4 + 9 OH- - 8e- == 6 H2O + HCO3-
正极:
O2 + 2 H2O + 4e- == 4 OH-
总反应:
2O2 + 4 H2O + 8e- == 8 OH-
CH4 + O2 ==== CO2 + 2H2O
CH4 + 2O2 + OH- == HCO3- + 2H2O
稀碱(OH-)溶液会与CO2 反应吗?
稀碱(OH-)多与CO2 反应生成CO32-
稀碱(OH-)少与CO2 反应生成HCO32-
【复习:燃料电池 】
H
C
酸性H+
碱性0H-
H+
H20
酸性H+
C02
碱多0H-
C032-
碱少0H-
HC03-
【复习:燃料电池 】
O2
酸性H+
H20
O2 +4e- +4H+==2H20
碱性0H-
0H-
O2 +4e- +2H20==4OH-
【练习】
1,导学案
2,试着根据 CH3CH2OH + O2 CO2 + 2H2O 这个反应,分别写出酸性和碱性这两个条件下的电极反应方程式?
负极:Zn - 2e- == Zn2+
正极:2NH4+ + 2e- == 2NH3↑+H2↑
Zn + 2NH4+ == Zn2++2NH3↑+H2↑
电池总反应式:
特点:a:一次性电池,不可逆。
b:用KOH代替NH4Cl能提高性能,延长寿命。
二、发展中的化学电源
1.干电池
电极:Pb为负极;PbO2为正极。
电解液:30%的H2SO4溶液。
电极反应式:
负极(Pb): Pb + SO4 -2e-=PbSO4
正极(PbO2):PbO2 + 4H+ + SO4 + 2e- =PbSO4 +2H2O
总电池反应:PbO2 + Pb +2H2SO4=2PbSO4+ 2H2O
Pb(铅)
PbO2
2.充电电池(二次电池)
2-
2-
由于铅蓄电池在使用时产生热量,水会因挥发而损失,因此有经验的司机会定期请专业人员向铅蓄电池内加入蒸馏水,以补充在使用过程中损失的水分,延长其使用寿命。
生活小常识
资料显示,一节电池烂在地里,能使1平方米的土壤永久失去利用价值;一粒纽扣电池可使600吨水受到污染,相当于一个人一生的饮水量。电池里含有汞、铅、镉等多种重金属元素,会威胁到人类的健康。
【资料卡片】
第二节 化学能与电能
燃料电池
1.掌握原电池——燃料电池的电极反应方程式的书写。(重点)
2.了解常见的充电电池电解反应方程式的书写。
【思考与交流】
能否根据 2H2 + O2 ====2H2O 这个反应,
设计一个原电池?
2.燃料电池
【电极材料】一般为惰性电极,如铂电极,石墨电极等。
【电解质溶液】
稀酸溶液或者
稀碱溶液
2.燃料电池
它是一种高效、环境友好的发电装置,能量转化率较高,理论上可达到85%~90%。它的电极材料一般为惰性电极,如铂电极,石墨电极等。
燃料电池的反应本质:
燃料 燃烧 发生氧化还原反应
2H2 + O2 ====2H2O
负极:
燃料,如 H2 ,CH4,乙醇
正极:
助燃剂,如 O2 ,Cl2
燃料电池优点:高效、环保、能量转化率高。
电解质溶液为稀酸溶液
电极反应:
负极:
H2 - 2e- ==== 2H+
正极:
O2 + 4H++ 4e- ==== 2H2O
总反应:2H2 + O2 ====2H2O
2H2 - 4e- ==== 4H+
电解质溶液为稀碱溶液
电极反应:
负极:
2H2 + 4OH- - 4e- ==== 4H2O
正极:
O2 + 2H2O + 4e- ==== 4OH-
总反应:2H2 + O2 ====2H2O
【复习:氢氧燃料电池 】
H2
O2
酸性H+
碱性0H-
H+
H2 -2e- ==2H+
H20
H2 -2e- +0H- ==2H2O
酸性H+
H20
O2 +4e- +4H+==2H20
碱性0H-
0H-
O2 +4e- +2H20==4OH-
【思考与交流】
试着根据 CH4 + O2 ==== CO2 + 2H2O 这个反应,
分别写出酸性和碱性这两个条件下的电极反应方程式?
电解质溶液若为稀酸(H+)溶液
电极反应:
负极:
CH4 - 8e- + 2H2O == 8H+ + CO2
正极:
O2 + 4H+ + 4e- == 2H2O
总反应:
2O2 + 8H+ + 8e- == 4H2O
CH4 + O2 ==== CO2 + 2H2O
CH4 + O2 ==== CO2 + 2H2O
电解质溶液为足量的稀碱(OH-)溶液
负极:
CH4 + 10 OH- - 8e- == 7 H2O + CO32-
正极:
O2 + 2 H2O + 4e- == 4 OH-
总反应:
2O2 + 4 H2O + 8e- == 8 OH-
CH4 + O2 ==== CO2 + 2H2O
CH4 + 2O2 + 2OH- == CO32- + 3H2O
稀碱(OH-)溶液会与CO2 反应吗?
稀碱(OH-)多与CO2 反应生成CO32-
稀碱(OH-)少与CO2 反应生成HCO32-
电解质溶液为足量的稀碱(OH-)溶液
负极:
CH4 + 9 OH- - 8e- == 6 H2O + HCO3-
正极:
O2 + 2 H2O + 4e- == 4 OH-
总反应:
2O2 + 4 H2O + 8e- == 8 OH-
CH4 + O2 ==== CO2 + 2H2O
CH4 + 2O2 + OH- == HCO3- + 2H2O
稀碱(OH-)溶液会与CO2 反应吗?
稀碱(OH-)多与CO2 反应生成CO32-
稀碱(OH-)少与CO2 反应生成HCO32-
【复习:燃料电池 】
H
C
酸性H+
碱性0H-
H+
H20
酸性H+
C02
碱多0H-
C032-
碱少0H-
HC03-
【复习:燃料电池 】
O2
酸性H+
H20
O2 +4e- +4H+==2H20
碱性0H-
0H-
O2 +4e- +2H20==4OH-
【练习】
1,导学案
2,试着根据 CH3CH2OH + O2 CO2 + 2H2O 这个反应,分别写出酸性和碱性这两个条件下的电极反应方程式?
负极:Zn - 2e- == Zn2+
正极:2NH4+ + 2e- == 2NH3↑+H2↑
Zn + 2NH4+ == Zn2++2NH3↑+H2↑
电池总反应式:
特点:a:一次性电池,不可逆。
b:用KOH代替NH4Cl能提高性能,延长寿命。
二、发展中的化学电源
1.干电池
电极:Pb为负极;PbO2为正极。
电解液:30%的H2SO4溶液。
电极反应式:
负极(Pb): Pb + SO4 -2e-=PbSO4
正极(PbO2):PbO2 + 4H+ + SO4 + 2e- =PbSO4 +2H2O
总电池反应:PbO2 + Pb +2H2SO4=2PbSO4+ 2H2O
Pb(铅)
PbO2
2.充电电池(二次电池)
2-
2-
由于铅蓄电池在使用时产生热量,水会因挥发而损失,因此有经验的司机会定期请专业人员向铅蓄电池内加入蒸馏水,以补充在使用过程中损失的水分,延长其使用寿命。
生活小常识
资料显示,一节电池烂在地里,能使1平方米的土壤永久失去利用价值;一粒纽扣电池可使600吨水受到污染,相当于一个人一生的饮水量。电池里含有汞、铅、镉等多种重金属元素,会威胁到人类的健康。
【资料卡片】
