人教版化学必修一4.3--硫和氮的氧化物(共56张PPT)
文档属性
| 名称 | 人教版化学必修一4.3--硫和氮的氧化物(共56张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-26 22:14:29 | ||
图片预览








文档简介
(共56张PPT)
第三节
硫和氮的氧化物
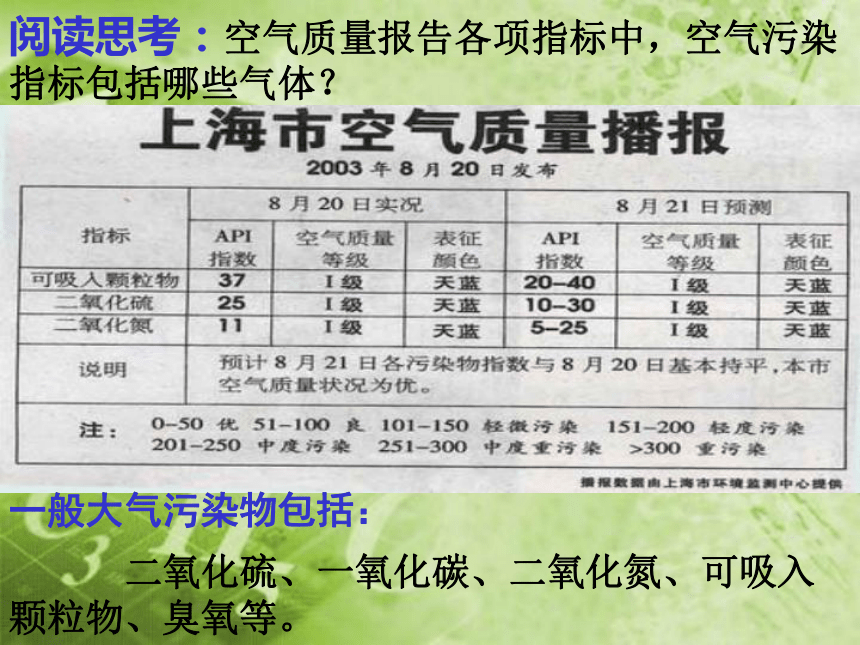
阅读思考:空气质量报告各项指标中,空气污染
指标包括哪些气体?
二氧化硫、一氧化碳、二氧化氮、可吸入颗粒物、臭氧等。
一般大气污染物包括:
其中,二氧化硫和二氧化氮是造成酸雨的主要元凶!
它们的来源是哪里?为什么会形成酸雨?我们又该如何防治?
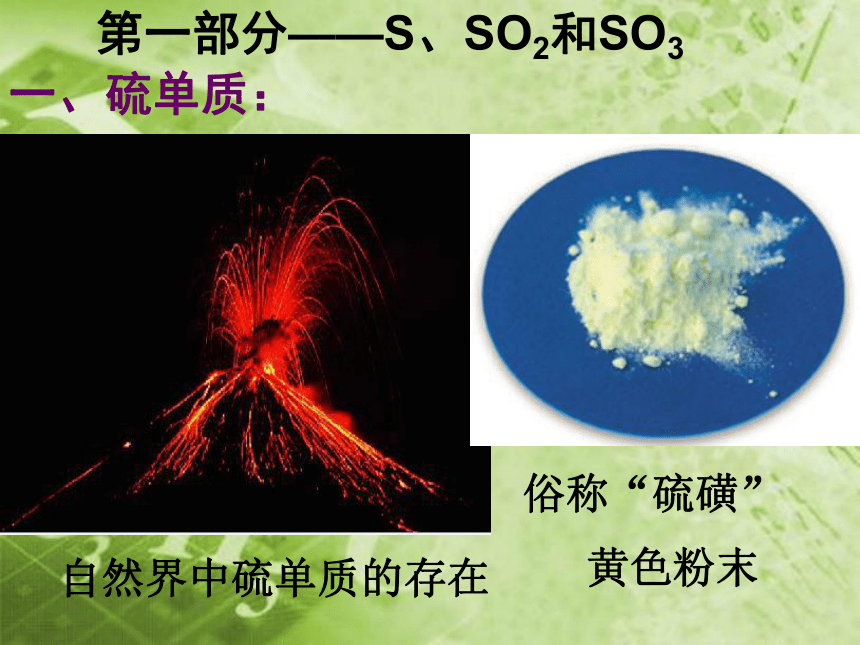
自然界中硫单质的存在
一、硫单质:
第一部分——S、SO2和SO3
硫在自然界的存在(化合态)
石膏
黄铜矿
黄铁矿
皓矾:??ZnSO4.7H2O
钡餐,重晶石:?BaSO4
绿矾:??FeSO4 · 7H2O?
芒硝:??Na2SO4 · 10H2O?
明矾:?KAl(SO4)2 · 12H2O?
生石膏:CaSO4 · 2H2O?
熟石膏:2CaSO4 · H2O
莫尔盐 (NH4)2Fe(SO4)2 · 6H2O
胆矾、蓝矾:CuSO4 · 5H2O?
黄铁矿(愚人金):FeS2
大苏打(海波):Na2S2O3
泻盐:MgSO4 · 7H2O
波尔多液:CuSO4+Ca(OH)2
锌钡白:ZnS+BaSO4
硫单质的化学性质
1、与金属反应
2、与非金属反应
二、二氧化硫
1、SO2的物理性质
无色、有刺激性气味、有毒、易液化、密度比空气大、易溶于水
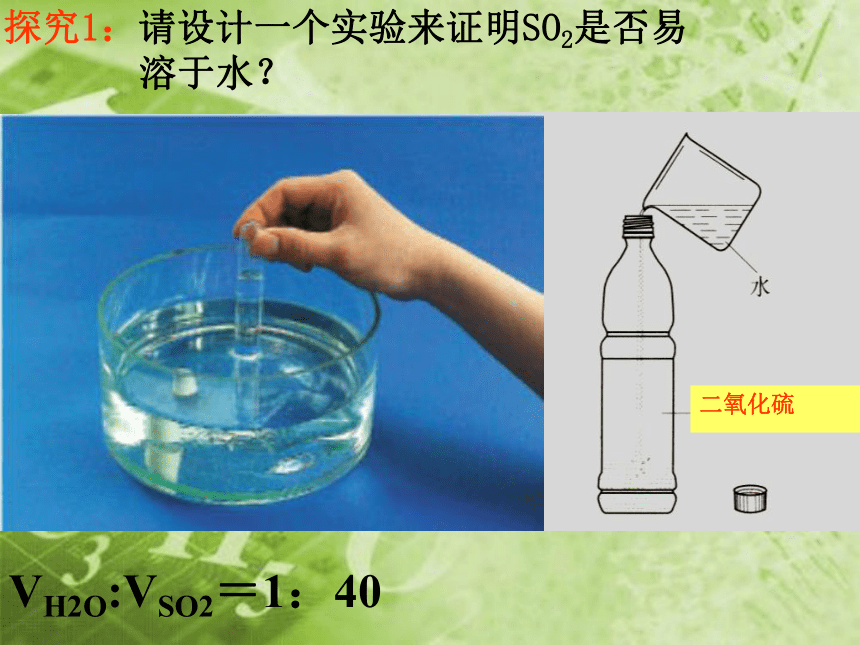
探究1:请设计一个实验来证明SO2是否易
溶于水?
VH2O:VSO2=1:40
2、SO2的化学性质(重点)
可逆反应:在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。
可逆反应
⑴:酸性氧化物的通性(与水、碱、碱性氧化物反应)
SO2 + Ca(OH)2 == CaSO3↓ + H2O
能使澄清石灰水变浑浊的气体有哪些?
注
意
SO2 + CaO == CaSO3
比较项目
SO2
CO2
与碱性氧化物反应
SO2+ CaO== CaSO3
CO2+ CaO== CaCO3
与水反应生成弱酸
SO2+H2O==H2SO3
CO2+H2O==H2CO3
可用强溶液碱吸收
SO2(少)+2NaOH==Na2SO3+H2O
Na2SO3+H2O+ SO2== 2NaHSO3
SO2(过)+NaOH==NaHSO3
CO2+2NaOH==Na 2CO3+H2O
Na2CO3+H2O+CO2== 2NaHCO3
CO2(过)+NaOH==NaHCO3
通入石灰水有白色沉淀,过量时沉淀溶解
SO2(少)+Ca(OH) 2==CaSO3↓+H2O
CaSO3+H2O+ SO2==Ca(HSO3)2
2SO2(过)+ Ca(OH) 2== Ca(HSO3)2
CO2(少)+Ca(OH) 2==CaCO3↓+H2O
CaCO3+H2O+ CO2==Ca(HCO3)2
2CO2(过)+ Ca(OH) 2== Ca(HCO3)2
与NaHCO3溶液反应 2NaHCO3+SO2==Na2SO3+2CO2+H2O
不与NaHCO3溶液反应
与CaCl2、BaCl2不反应
不能用CaCl2、BaCl2溶液鉴别
实验室制取
Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
CaCO2+2HCl=CaCl2+CO2↑+H2O
某些有机色素+SO2
用途:SO2可以用来漂白纸浆、毛、丝、草编制品等。二氧化硫还能够杀灭霉菌和细菌,可以用作食物和干果的防腐剂。
⑵:SO2的漂白性
二氧化硫能和某些有色物质化合生成不稳定的无色物质,该无色物质长时间光照或受热后,会恢复原来的颜色,因此,其漂白作用不持久。
中学化学常见试剂中,能用二氧化硫漂白的物质只有品红溶液,不能漂白酸碱指示剂。
不法商人是怎样将“黄银耳” 变成“雪白雪白”的呢?
漂白为无色后受热又恢复为红色
漂白为无色后受热仍未无色
氯水和SO2漂白性的比较
氯水和SO2漂白性的比较
氯水中HClO将有色物质氧化成无色物质
氧化还原反应
永久性
可漂白大多数有色物质,能使紫色石蕊试液褪色(先变红后褪色)
SO2与有色物质直接结合生成不稳定的无色物质
非氧化还原反应
暂时性
漂白某些有色物质,不能使紫色石蕊试液褪色(只变红不褪色)
氯 水 二 氧 化 硫
原 理
实 质
效 果
范 围
吸附
有色
色素
将有色的色素
氧化为稳定的
无色物质
与色素结合
成不稳定的
无色物质
物理
变化
化学变化
漂白的类型有三种:吸附、氧化、化合
漂白性的物质 活
性
炭 潮湿氯气(即次氯酸) 臭氧 过氧化钠、过氧化氢
二氧化硫
漂白
原理
备注
向氯水,溴水,碘水或酸性KMnO4溶液中加入SO2的水溶液
⑶:SO2的氧化、还原性
现象:氯水,溴水,碘水褪色, 酸性KMnO4溶液褪色
S处于中间价态,又可降价显氧化性,但以还原性为主。
SO2+Cl2+2H2O = H2SO4+2HCl
SO2 +Br2 +2H2O = H2SO4 + 2HBr
SO2+ I2 + 2H2O=H2SO4+2HI
5SO2+2KMnO4+2H2O =K2SO4 +2MnSO4+2H2SO4
5SO2+2MnO4- + 2H2O = SO4 2- + 2Mn2- + 2SO42-
SO2有较强的还原性
SO2的氧化性(弱氧化性)
SO2 + 2H2S = 3S↓+ 2H2O
练习
1、下列可用来鉴别SO2和CO2的方法是
( )
A、通入紫色石蕊试液
B、闻气味
C、通入澄清石灰水
D、通入品红溶液中
BD
2、二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将 ( )
A 、和氯气单独通过时相同
B、和二氧化硫单独通过时相同
C、是二者作用效果之和
D、失去漂白性
D
SO2 + Cl2 + 2H2O = 2HCl + H2 SO4
3、如何除去CO2中含有的SO2?
A、气体通过NaOH溶液
B、气体通过品红溶液品红溶液用来检验,
不用来吸收SO2。
C、气体通过Na2CO3溶液
D、气体通过酸性KMnO4溶液
E、气体通过饱和NaHCO3溶液
√
√
2NaHCO3+SO2==Na2SO3+2CO2↑+H2O
4、如何设计实验证明某混合气体中既有二氧化碳又有二氧化硫?
①处品红溶液褪色,说明什么?
②处酸性高锰酸钾作用?
③处品红溶液作用?
④处澄清石灰水变浑浊,说明什么?。
5.如何除去二氧化碳气体中混有的少量二氧化硫气体?
2、根据实验现象,描述SO2的性质:
(1)SO2使滴有酚酞的NaOH溶液红色褪去,
SO2体现了 ;
(2) SO2使品红褪色,SO2体现 性;
(3) SO2使KMnO4褪色,SO2体现 性。
酸性氧化物的性质
漂白
还原
SO3 + H2O == H2SO4
生产硫酸:
三、SO3的化学性质:
三氧化硫也是一种酸性氧化物,易溶于水生成硫酸;与碱或碱性氧化物反应生成硫酸盐。
SO3 + Ca(OH)2 == CaSO4 + H2O
SO3 + CaO == CaSO4
SO3 + H2O == H2SO4
S + O2 == SO2
在新疆与青海交界处有一山谷,人称魔鬼谷。经常电闪雷鸣,狂风暴雨,把人畜击毙。然而谷内却是牧草茂盛,四季常青。请解释原因。
雷雨发庄稼
N2 + O2 ==== 2NO(无色)
放电或高温
2NO + O2 = 2NO2(红棕色)可以利用此原理检验NO的存在
NO和NO2气体的性状:
NO:无色、不溶于水的有毒气体。(收集方法?)
NO2:红棕色,有刺激性气味的有毒气体。密度比空气大,易溶于水,易液化。 (收集方法?)
3NO2 + H2O = 2HNO3+ NO
(工业上制取硝酸的原理)
排水法
瓶口向上排空气法
3NO2 + H2O = 2HNO3+ NO
(工业上制取硝酸的原理)
将一支充满NO2的试管倒立在盛有水的水槽中
制取少量氧气
将氧气缓慢通入步骤1的试管中
红棕色气体逐渐消失,水位上升,最后水充满整个试管的2/3,无色气体充满试管的1/3(上部)
无色气体变为红棕色气体,但气体体积逐渐缩小,液面不断上升
3NO2+H2O==2HNO3+NO
NO2为红棕色气体,易溶于水,NO为无色气体,难溶于水.
2NO+O2=2NO2
3NO2+H2O==2HNO3+NO
实验步骤 现象 解释
1
2
3
+l、 +2 +3、 +4 +4、 +5、 0 、-3
N2O、NO、N2O3、NO2、N2O4、N2O5 N2 NH3
氮的常见化合价:
5种正价,6种氧化物
酸酐:含氧酸失去水后的氧化物
N2O3 、 N2O5, 分别属于HNO2和 HNO3的酸酐。
(1)NO2、NO混合气体溶于水
3NO2 + H2O = 2HNO3 + NO
例1:10mLNO2和NO的混合气体通入水中,
充分反应后,剩余6mL气体。
问:剩余气体是什么?
原混合气体中NO2有多少?
有关NO、NO2、O2混合气体
通入水中的计算
(2) NO、O2混合气体溶于水
2NO + O2 === 2NO2 ①
3NO2 + H2O === 2HNO3 + NO ②
①×3+ ②×2得:
4NO + 3O2 +2H2O === 4HNO3
例2:将1LNO和1LO2的混合气体通入水中,
充分反应后。
问:剩余的气体是什么?是多少?
(3) NO2、O2混合气体溶于水
3NO2 + H2O = 2HNO3 + NO ①
2NO + O2 = 2NO2 ②
①×2+ ②×1得:
4NO2 + O2 +2H2O === 4HNO3
例3:常温下,将3LNO2和1LO2混合后充于试管中,并将试管倒立在水槽中,充分反应后,剩余气体是什么?其体积约占试管体积的几分之几?
若是5LNO2和1LO2呢?
室温时,将盛有20mLNO2和O2的混合气体的量筒倒立在盛有水的水槽中,充分反应后,量筒内残留气体3mL,则原混合气体中NO2的体积是多少?
1.以下气体能用NaOH固体干燥的是( )
A.NH3 B.SO2 C.CO2 D.HCl
2.下列气体中,不能用排空气法收集的是( )
A. H2 B. CO2 C. NO D. O2
3.下列哪种方法可以鉴别CO2和SO2( )
A.澄清石灰水 B.品红溶液
C.烧碱 D.盐酸
A
C
B
三、二氧化硫和二氧化氮对大气的污染
空气中的二氧化硫主要来自于化石燃料(如煤与石油)
的燃烧、含硫金属的冶炼以及制造硫酸、磷肥等产生
的废气。
1、来源
在机动车内燃机中燃料燃烧产生的高温条件下,空气中的氮气往往也参与反应,这就是汽车尾气中含有NO的原因,也是空气中NO2的主要来源。
2、危害
NO2、SO2都是有毒气体,是主要的大气污染物。能直接危害人体健康,引起呼吸道疾病,严重时会使人死亡。
历史上著名的相关事件有:伦敦烟雾事件;洛杉矶光化学烟雾事件。
SO2、NO2的另一个主要危害是造成酸雨。
酸雨:主要指pH值小于5.6的雨水,
其主要是含有硫酸和硝酸。
正常雨水(含雨、霜、露、雹、霰等)由于存在CO2原因其pH值约为5.6 。在水中当pH值小于5.5时,大部分鱼类难以生存;当降到小于5时,各种鱼类和两栖动物及昆虫、水草及浮游生物面临灭绝。
酸雨会伤害植物的新生芽,使叶绿素含量偏小,光合作用受阻,作物产量下降,严重时会导致大面积的农作物减少或绝收,大片的森林树木枯死,小生物随之灭绝……最终必然会影响到我们人类自身。
二氧化硫和二氧化氮对大气的污染
硫酸雨的形成
石油
煤
燃 烧
CO2
SO3
雨水.霜.雹.露等
SO2
pH值小于5.6
结论:
SO2中的 S为+4价,处于中间价态, 所以可能既有氧化性,也可能有还原性。
来自于空气里烟尘中的金属氧化物
△
酸雨的危害实例录:
1.50年前,故宫太和殿台阶的栏杆上雕刻着各式各样精美浮雕花纹还清晰可见,而现在却大多是模糊不清,部分已成光板……
2.巫山在一场大雨过后,整个山体上暴露
的石块全部被腐蚀近1厘米…...
3.1995年,几场酸雨过后,我国四川奉节县9万亩华山松全部枯死,重庆面山的2.7万亩马尾松死亡过半.
如何控制酸雨?
1、改善燃料种类,积极开发新能源;
2、对煤(其中含硫为0.3%-5%)进行处理,如
选洗加工、综合开发、在煤中加入适量的生
石灰、对排放的烟进行处理以回收SO2.
3、种植能够吸收SO2的有关树木(如臭椿、
垂柳、柳杉)等;
1972年6月5日,具有历史意义的人类环境会议在瑞典首都斯德哥尔摩召开,通过了著名的《人类环境宣言》,并确定每年6月5日为“世界环境日”。从1974年起,每年联合国环境规划署确定一个主题,开展“世界环境日”活动,其中1983的主题是防治酸雨
我国酸雨分布图
练习:
1.下列试剂能否用来鉴别CO2和SO2两瓶气体?为什么?
A.品红溶液 B.澄清的石灰水 C.氯化钙溶液
D.紫色石蕊试液 E.氯化钡和氯水的混合溶液
2.能吸收SO2气体但不能有沉淀产生的溶液是( )
A.Ba(OH)2 B.NaOH C.Na2CO3 D.NaHSO3
3.SO2既具有氧化性又具有还原性,请你判断能否用浓硫
酸来干燥SO2?说明你的理由.(浓硫酸具强氧化性)
B.C
能。因为硫元素在+4和+6价之间无其它的化合价,
因此这两者之间不能发生氧化还原反应.
即含同种元素两种物质间若不存在中间价态时,
它们就不能发生氧化还原反应.
5. 氯气和二氧化硫皆可做漂白剂,若用两者 (1:1) 一起漂白一种 物质时,漂白效果会( )
A. 增强
B. 不变
C. 减弱
D. 难确定
SO2 + Cl2 + 2 H2O = H2SO4 + 2HCl
C
1.下列气体中,有毒、会污染空气,但是可以用
碱液吸收的是( )
A.CO B.CO2
C.SO2 D.N2
C
2. 减少酸雨产生的途径可采用下列措施中的( )
①少用煤作燃料 ②把工厂的烟囱加高
③燃料脱硫 ④在已酸化的土壤中加石灰
⑤开发新能源
A、 ①②③ B、 ②③④⑤
C、 ①③⑤ D、 ①③④⑤
C
4.二氧化硫和氯气都有漂白性,现把二者以等物质的量 混合,让混合气体通入品红溶液,则其漂白性将( )
A、和氯气单独通过时相同
B、和二氧化硫单独通过时相同
C、是二者作用效果之和
D、失去
3.下列可以用来鉴别CO2和SO2的方法是( )
A. 通入紫色石蕊试液 B.闻气味
C. 通入澄清石灰水 D.通入品红溶液中
BD
D
5、现有某混合气体可能含有SO2和CO2,通过以下装置鉴定。依次通过的顺序是 。(装置可重复使用)
①②①③
探究2:SO2溶于水仅仅是溶于水吗?有没有发生化学反应?怎么判断?
实验: 1、用PH试纸测溶液的PH值 2、滴入品红试液,观察溶液颜色的变化再加热,再观察溶液颜色的变化
现象:
1、溶液PH值<7
2、品红试液褪色,加热后溶液又变红
结论:
SO2水溶液呈酸性、有漂白性但不稳定。
第三节
硫和氮的氧化物
阅读思考:空气质量报告各项指标中,空气污染
指标包括哪些气体?
二氧化硫、一氧化碳、二氧化氮、可吸入颗粒物、臭氧等。
一般大气污染物包括:
其中,二氧化硫和二氧化氮是造成酸雨的主要元凶!
它们的来源是哪里?为什么会形成酸雨?我们又该如何防治?
自然界中硫单质的存在
一、硫单质:
第一部分——S、SO2和SO3
硫在自然界的存在(化合态)
石膏
黄铜矿
黄铁矿
皓矾:??ZnSO4.7H2O
钡餐,重晶石:?BaSO4
绿矾:??FeSO4 · 7H2O?
芒硝:??Na2SO4 · 10H2O?
明矾:?KAl(SO4)2 · 12H2O?
生石膏:CaSO4 · 2H2O?
熟石膏:2CaSO4 · H2O
莫尔盐 (NH4)2Fe(SO4)2 · 6H2O
胆矾、蓝矾:CuSO4 · 5H2O?
黄铁矿(愚人金):FeS2
大苏打(海波):Na2S2O3
泻盐:MgSO4 · 7H2O
波尔多液:CuSO4+Ca(OH)2
锌钡白:ZnS+BaSO4
硫单质的化学性质
1、与金属反应
2、与非金属反应
二、二氧化硫
1、SO2的物理性质
无色、有刺激性气味、有毒、易液化、密度比空气大、易溶于水
探究1:请设计一个实验来证明SO2是否易
溶于水?
VH2O:VSO2=1:40
2、SO2的化学性质(重点)
可逆反应:在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。
可逆反应
⑴:酸性氧化物的通性(与水、碱、碱性氧化物反应)
SO2 + Ca(OH)2 == CaSO3↓ + H2O
能使澄清石灰水变浑浊的气体有哪些?
注
意
SO2 + CaO == CaSO3
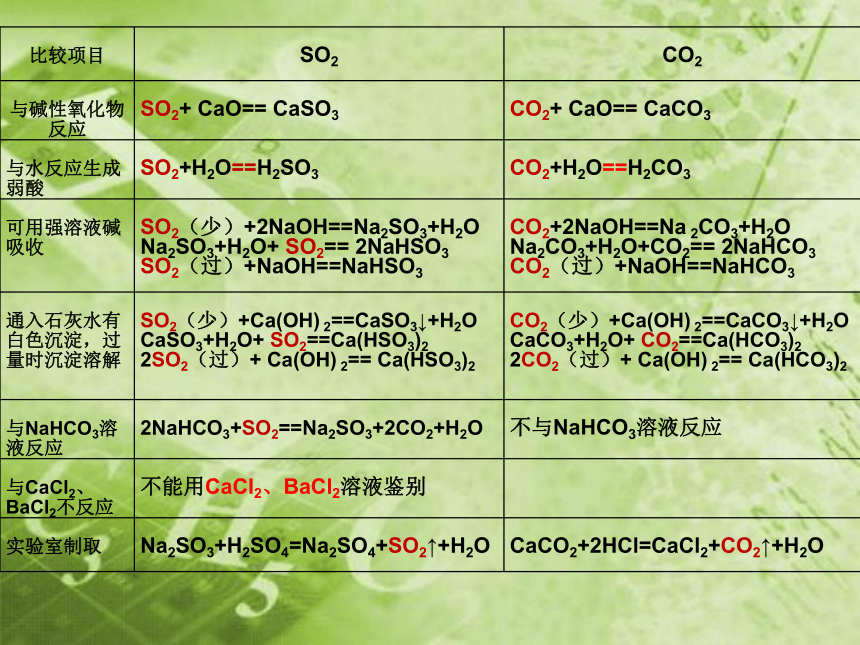
比较项目
SO2
CO2
与碱性氧化物反应
SO2+ CaO== CaSO3
CO2+ CaO== CaCO3
与水反应生成弱酸
SO2+H2O==H2SO3
CO2+H2O==H2CO3
可用强溶液碱吸收
SO2(少)+2NaOH==Na2SO3+H2O
Na2SO3+H2O+ SO2== 2NaHSO3
SO2(过)+NaOH==NaHSO3
CO2+2NaOH==Na 2CO3+H2O
Na2CO3+H2O+CO2== 2NaHCO3
CO2(过)+NaOH==NaHCO3
通入石灰水有白色沉淀,过量时沉淀溶解
SO2(少)+Ca(OH) 2==CaSO3↓+H2O
CaSO3+H2O+ SO2==Ca(HSO3)2
2SO2(过)+ Ca(OH) 2== Ca(HSO3)2
CO2(少)+Ca(OH) 2==CaCO3↓+H2O
CaCO3+H2O+ CO2==Ca(HCO3)2
2CO2(过)+ Ca(OH) 2== Ca(HCO3)2
与NaHCO3溶液反应 2NaHCO3+SO2==Na2SO3+2CO2+H2O
不与NaHCO3溶液反应
与CaCl2、BaCl2不反应
不能用CaCl2、BaCl2溶液鉴别
实验室制取
Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
CaCO2+2HCl=CaCl2+CO2↑+H2O
某些有机色素+SO2
用途:SO2可以用来漂白纸浆、毛、丝、草编制品等。二氧化硫还能够杀灭霉菌和细菌,可以用作食物和干果的防腐剂。
⑵:SO2的漂白性
二氧化硫能和某些有色物质化合生成不稳定的无色物质,该无色物质长时间光照或受热后,会恢复原来的颜色,因此,其漂白作用不持久。
中学化学常见试剂中,能用二氧化硫漂白的物质只有品红溶液,不能漂白酸碱指示剂。
不法商人是怎样将“黄银耳” 变成“雪白雪白”的呢?
漂白为无色后受热又恢复为红色
漂白为无色后受热仍未无色
氯水和SO2漂白性的比较
氯水和SO2漂白性的比较
氯水中HClO将有色物质氧化成无色物质
氧化还原反应
永久性
可漂白大多数有色物质,能使紫色石蕊试液褪色(先变红后褪色)
SO2与有色物质直接结合生成不稳定的无色物质
非氧化还原反应
暂时性
漂白某些有色物质,不能使紫色石蕊试液褪色(只变红不褪色)
氯 水 二 氧 化 硫
原 理
实 质
效 果
范 围
吸附
有色
色素
将有色的色素
氧化为稳定的
无色物质
与色素结合
成不稳定的
无色物质
物理
变化
化学变化
漂白的类型有三种:吸附、氧化、化合
漂白性的物质 活
性
炭 潮湿氯气(即次氯酸) 臭氧 过氧化钠、过氧化氢
二氧化硫
漂白
原理
备注
向氯水,溴水,碘水或酸性KMnO4溶液中加入SO2的水溶液
⑶:SO2的氧化、还原性
现象:氯水,溴水,碘水褪色, 酸性KMnO4溶液褪色
S处于中间价态,又可降价显氧化性,但以还原性为主。
SO2+Cl2+2H2O = H2SO4+2HCl
SO2 +Br2 +2H2O = H2SO4 + 2HBr
SO2+ I2 + 2H2O=H2SO4+2HI
5SO2+2KMnO4+2H2O =K2SO4 +2MnSO4+2H2SO4
5SO2+2MnO4- + 2H2O = SO4 2- + 2Mn2- + 2SO42-
SO2有较强的还原性
SO2的氧化性(弱氧化性)
SO2 + 2H2S = 3S↓+ 2H2O
练习
1、下列可用来鉴别SO2和CO2的方法是
( )
A、通入紫色石蕊试液
B、闻气味
C、通入澄清石灰水
D、通入品红溶液中
BD
2、二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将 ( )
A 、和氯气单独通过时相同
B、和二氧化硫单独通过时相同
C、是二者作用效果之和
D、失去漂白性
D
SO2 + Cl2 + 2H2O = 2HCl + H2 SO4
3、如何除去CO2中含有的SO2?
A、气体通过NaOH溶液
B、气体通过品红溶液品红溶液用来检验,
不用来吸收SO2。
C、气体通过Na2CO3溶液
D、气体通过酸性KMnO4溶液
E、气体通过饱和NaHCO3溶液
√
√
2NaHCO3+SO2==Na2SO3+2CO2↑+H2O
4、如何设计实验证明某混合气体中既有二氧化碳又有二氧化硫?
①处品红溶液褪色,说明什么?
②处酸性高锰酸钾作用?
③处品红溶液作用?
④处澄清石灰水变浑浊,说明什么?。
5.如何除去二氧化碳气体中混有的少量二氧化硫气体?
2、根据实验现象,描述SO2的性质:
(1)SO2使滴有酚酞的NaOH溶液红色褪去,
SO2体现了 ;
(2) SO2使品红褪色,SO2体现 性;
(3) SO2使KMnO4褪色,SO2体现 性。
酸性氧化物的性质
漂白
还原
SO3 + H2O == H2SO4
生产硫酸:
三、SO3的化学性质:
三氧化硫也是一种酸性氧化物,易溶于水生成硫酸;与碱或碱性氧化物反应生成硫酸盐。
SO3 + Ca(OH)2 == CaSO4 + H2O
SO3 + CaO == CaSO4
SO3 + H2O == H2SO4
S + O2 == SO2
在新疆与青海交界处有一山谷,人称魔鬼谷。经常电闪雷鸣,狂风暴雨,把人畜击毙。然而谷内却是牧草茂盛,四季常青。请解释原因。
雷雨发庄稼
N2 + O2 ==== 2NO(无色)
放电或高温
2NO + O2 = 2NO2(红棕色)可以利用此原理检验NO的存在
NO和NO2气体的性状:
NO:无色、不溶于水的有毒气体。(收集方法?)
NO2:红棕色,有刺激性气味的有毒气体。密度比空气大,易溶于水,易液化。 (收集方法?)
3NO2 + H2O = 2HNO3+ NO
(工业上制取硝酸的原理)
排水法
瓶口向上排空气法
3NO2 + H2O = 2HNO3+ NO
(工业上制取硝酸的原理)
将一支充满NO2的试管倒立在盛有水的水槽中
制取少量氧气
将氧气缓慢通入步骤1的试管中
红棕色气体逐渐消失,水位上升,最后水充满整个试管的2/3,无色气体充满试管的1/3(上部)
无色气体变为红棕色气体,但气体体积逐渐缩小,液面不断上升
3NO2+H2O==2HNO3+NO
NO2为红棕色气体,易溶于水,NO为无色气体,难溶于水.
2NO+O2=2NO2
3NO2+H2O==2HNO3+NO
实验步骤 现象 解释
1
2
3
+l、 +2 +3、 +4 +4、 +5、 0 、-3
N2O、NO、N2O3、NO2、N2O4、N2O5 N2 NH3
氮的常见化合价:
5种正价,6种氧化物
酸酐:含氧酸失去水后的氧化物
N2O3 、 N2O5, 分别属于HNO2和 HNO3的酸酐。
(1)NO2、NO混合气体溶于水
3NO2 + H2O = 2HNO3 + NO
例1:10mLNO2和NO的混合气体通入水中,
充分反应后,剩余6mL气体。
问:剩余气体是什么?
原混合气体中NO2有多少?
有关NO、NO2、O2混合气体
通入水中的计算
(2) NO、O2混合气体溶于水
2NO + O2 === 2NO2 ①
3NO2 + H2O === 2HNO3 + NO ②
①×3+ ②×2得:
4NO + 3O2 +2H2O === 4HNO3
例2:将1LNO和1LO2的混合气体通入水中,
充分反应后。
问:剩余的气体是什么?是多少?
(3) NO2、O2混合气体溶于水
3NO2 + H2O = 2HNO3 + NO ①
2NO + O2 = 2NO2 ②
①×2+ ②×1得:
4NO2 + O2 +2H2O === 4HNO3
例3:常温下,将3LNO2和1LO2混合后充于试管中,并将试管倒立在水槽中,充分反应后,剩余气体是什么?其体积约占试管体积的几分之几?
若是5LNO2和1LO2呢?
室温时,将盛有20mLNO2和O2的混合气体的量筒倒立在盛有水的水槽中,充分反应后,量筒内残留气体3mL,则原混合气体中NO2的体积是多少?
1.以下气体能用NaOH固体干燥的是( )
A.NH3 B.SO2 C.CO2 D.HCl
2.下列气体中,不能用排空气法收集的是( )
A. H2 B. CO2 C. NO D. O2
3.下列哪种方法可以鉴别CO2和SO2( )
A.澄清石灰水 B.品红溶液
C.烧碱 D.盐酸
A
C
B
三、二氧化硫和二氧化氮对大气的污染
空气中的二氧化硫主要来自于化石燃料(如煤与石油)
的燃烧、含硫金属的冶炼以及制造硫酸、磷肥等产生
的废气。
1、来源
在机动车内燃机中燃料燃烧产生的高温条件下,空气中的氮气往往也参与反应,这就是汽车尾气中含有NO的原因,也是空气中NO2的主要来源。
2、危害
NO2、SO2都是有毒气体,是主要的大气污染物。能直接危害人体健康,引起呼吸道疾病,严重时会使人死亡。
历史上著名的相关事件有:伦敦烟雾事件;洛杉矶光化学烟雾事件。
SO2、NO2的另一个主要危害是造成酸雨。
酸雨:主要指pH值小于5.6的雨水,
其主要是含有硫酸和硝酸。
正常雨水(含雨、霜、露、雹、霰等)由于存在CO2原因其pH值约为5.6 。在水中当pH值小于5.5时,大部分鱼类难以生存;当降到小于5时,各种鱼类和两栖动物及昆虫、水草及浮游生物面临灭绝。
酸雨会伤害植物的新生芽,使叶绿素含量偏小,光合作用受阻,作物产量下降,严重时会导致大面积的农作物减少或绝收,大片的森林树木枯死,小生物随之灭绝……最终必然会影响到我们人类自身。
二氧化硫和二氧化氮对大气的污染
硫酸雨的形成
石油
煤
燃 烧
CO2
SO3
雨水.霜.雹.露等
SO2
pH值小于5.6
结论:
SO2中的 S为+4价,处于中间价态, 所以可能既有氧化性,也可能有还原性。
来自于空气里烟尘中的金属氧化物
△
酸雨的危害实例录:
1.50年前,故宫太和殿台阶的栏杆上雕刻着各式各样精美浮雕花纹还清晰可见,而现在却大多是模糊不清,部分已成光板……
2.巫山在一场大雨过后,整个山体上暴露
的石块全部被腐蚀近1厘米…...
3.1995年,几场酸雨过后,我国四川奉节县9万亩华山松全部枯死,重庆面山的2.7万亩马尾松死亡过半.
如何控制酸雨?
1、改善燃料种类,积极开发新能源;
2、对煤(其中含硫为0.3%-5%)进行处理,如
选洗加工、综合开发、在煤中加入适量的生
石灰、对排放的烟进行处理以回收SO2.
3、种植能够吸收SO2的有关树木(如臭椿、
垂柳、柳杉)等;
1972年6月5日,具有历史意义的人类环境会议在瑞典首都斯德哥尔摩召开,通过了著名的《人类环境宣言》,并确定每年6月5日为“世界环境日”。从1974年起,每年联合国环境规划署确定一个主题,开展“世界环境日”活动,其中1983的主题是防治酸雨
我国酸雨分布图
练习:
1.下列试剂能否用来鉴别CO2和SO2两瓶气体?为什么?
A.品红溶液 B.澄清的石灰水 C.氯化钙溶液
D.紫色石蕊试液 E.氯化钡和氯水的混合溶液
2.能吸收SO2气体但不能有沉淀产生的溶液是( )
A.Ba(OH)2 B.NaOH C.Na2CO3 D.NaHSO3
3.SO2既具有氧化性又具有还原性,请你判断能否用浓硫
酸来干燥SO2?说明你的理由.(浓硫酸具强氧化性)
B.C
能。因为硫元素在+4和+6价之间无其它的化合价,
因此这两者之间不能发生氧化还原反应.
即含同种元素两种物质间若不存在中间价态时,
它们就不能发生氧化还原反应.
5. 氯气和二氧化硫皆可做漂白剂,若用两者 (1:1) 一起漂白一种 物质时,漂白效果会( )
A. 增强
B. 不变
C. 减弱
D. 难确定
SO2 + Cl2 + 2 H2O = H2SO4 + 2HCl
C
1.下列气体中,有毒、会污染空气,但是可以用
碱液吸收的是( )
A.CO B.CO2
C.SO2 D.N2
C
2. 减少酸雨产生的途径可采用下列措施中的( )
①少用煤作燃料 ②把工厂的烟囱加高
③燃料脱硫 ④在已酸化的土壤中加石灰
⑤开发新能源
A、 ①②③ B、 ②③④⑤
C、 ①③⑤ D、 ①③④⑤
C
4.二氧化硫和氯气都有漂白性,现把二者以等物质的量 混合,让混合气体通入品红溶液,则其漂白性将( )
A、和氯气单独通过时相同
B、和二氧化硫单独通过时相同
C、是二者作用效果之和
D、失去
3.下列可以用来鉴别CO2和SO2的方法是( )
A. 通入紫色石蕊试液 B.闻气味
C. 通入澄清石灰水 D.通入品红溶液中
BD
D
5、现有某混合气体可能含有SO2和CO2,通过以下装置鉴定。依次通过的顺序是 。(装置可重复使用)
①②①③
探究2:SO2溶于水仅仅是溶于水吗?有没有发生化学反应?怎么判断?
实验: 1、用PH试纸测溶液的PH值 2、滴入品红试液,观察溶液颜色的变化再加热,再观察溶液颜色的变化
现象:
1、溶液PH值<7
2、品红试液褪色,加热后溶液又变红
结论:
SO2水溶液呈酸性、有漂白性但不稳定。
