人教版化学必修二第二章第三节-化学反应的速率和限度(共18张PPT)
文档属性
| 名称 | 人教版化学必修二第二章第三节-化学反应的速率和限度(共18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 768.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-27 20:39:19 | ||
图片预览






文档简介
(共18张PPT)
第二章 化学反应与能量
第三节 化学反应的
速率和限度
第二课时 影响化学反应速率的因素
[练习]在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/L 盐酸反应时,速率最快的是( )
A 镁 B 铝 C 钠 D 铁
二、影响化学反应速率的因素
§化学反应速率是由反应物的性质决定的;
内因是主要因素
外因因素:
实验2-5
产生气泡速率增大,
带火星火柴 复燃
升高温度,
反应速率增大
有气泡冒出
产生气泡速率减小
降低温度,
反应速率减小
现象 结论
热水中
常温
冷水中
规律:当其它条件不变时,升高温度,化学反应速率增大。降低温度,化学反应速率减小。
实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。
注意:温度对反应速率的影响不受反应物状态的限制。
(1)温度对化学反应速率的影响
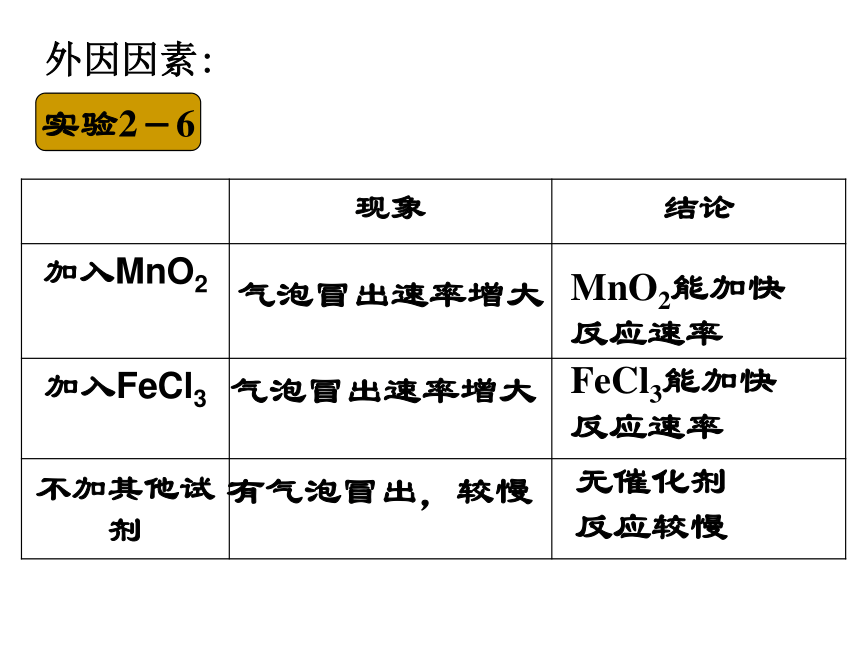
实验2-6
气泡冒出速率增大
气泡冒出速率增大
有气泡冒出,较慢
MnO2能加快
反应速率
FeCl3能加快
反应速率
无催化剂
反应较慢
外因因素:
现象 结论
加入MnO2
加入FeCl3
不加其他试剂
规律:催化剂能改变化学反应的速率。
有的催化剂能加快化学反应的速率,叫正催化剂;有的催化剂能减慢化学反应速率,叫负催化剂。在实践中,如没有特殊说明,凡说催化剂都是指正催化剂。
催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。
(2)催化剂对化学反应速率的影响
规律:当其它条件不变时,增大反应物的浓度,化学反应速率增大。减小反应物的浓度,化学反应速率减慢。
(3)浓度对化学反应速率的影响
规律:当其它条件不变时,增大固体反应物的表面积,化学反应速率增大。减小固体反应物的表面积,化学反应速率减慢。
(4)固体反应物的表面积对化学反应速率的 影响
(5)其他条件对化学反应速率的影响
[探究] 为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制如图曲线。请分析讨论以下问题。
(1)在0~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的是__________时间段,收集到气体最多的是_________时间段。
(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
(3)在t4后,为什么收集到的气体的体积不再增加?
⑵开始时C(H+)大,该反应的反应速率大; t1—t2由于反应放热温度升高,所以速率迅速增大;最后是因为C(H+)减小了,反应速率减慢.
第三节 化学反应的速率
和限度
第三课时 化学反应的限度
我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
什么叫做可逆反应?
在同一条件下,既向正反应方向进行,同时又向逆反应方向进行的反应。
典型的可逆反应有:
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
某温度和压强下的密闭容器中,2SO2+O2 2SO3
反应开始时有什么特征?
(从反应物浓度和正逆反应速率角度考虑,下同)
瞬间过后有什么特征?
一定时间段内有什么特征?
画出速率-时间(横坐标为时间,纵坐标为速率)图像。
此条件下进行到什么时候达到了这个反应的限度?
此时的反应是否停止了?
此时为何3种物质的浓度保持不变?
时间
(min)
物质的量
浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
1、定义
在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
前提(适用范围):可逆反应
内在本质:v(正)= v(逆) ≠0
外在标志:反应混合物中各组分
的浓度保持不变
二、化学平衡状态
2、化学平衡状态的特征
(3)动:动态平衡(v(正)= v(逆) ≠0)
(2)等:v(正)= v(逆)
(4)定:反应混合物中各组分的浓度保持 定,各组分的含量保持不变。
(5)变:条件改变,原平衡被破坏,在新
的条件下建立新的平衡。
(1)逆
练习
1、可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等
D
2、对于可逆反应M+N Q达到平衡状态时,
下列说法正确的是( )
A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. M、N、Q的浓度都保持不变
D. 反应已经停止
C
3、下列说法可以证明反应N2+3H2 2NH3
已达平衡状态的是 ( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
A、C
练习
4、在一定温度下,可逆反应A(g)+3B(g) 2C(g)
达到平衡的标志是( )
A. A的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2
C
3、化学平衡状态的判定
对于可逆反应m A(g) n B(g) + p C(g) 在一定条件下达到平衡状态有以下几个标志
(1)同种物质表示,A的生成速率和分解速率相等。
(2)不同种物质表示,单位时间生成n mol B和p mol C的同时,生成m mol A。
(3)A、B、C的物质的量、浓度、百分含量不再改变
第二章 化学反应与能量
第三节 化学反应的
速率和限度
第二课时 影响化学反应速率的因素
[练习]在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/L 盐酸反应时,速率最快的是( )
A 镁 B 铝 C 钠 D 铁
二、影响化学反应速率的因素
§化学反应速率是由反应物的性质决定的;
内因是主要因素
外因因素:
实验2-5
产生气泡速率增大,
带火星火柴 复燃
升高温度,
反应速率增大
有气泡冒出
产生气泡速率减小
降低温度,
反应速率减小
现象 结论
热水中
常温
冷水中
规律:当其它条件不变时,升高温度,化学反应速率增大。降低温度,化学反应速率减小。
实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。
注意:温度对反应速率的影响不受反应物状态的限制。
(1)温度对化学反应速率的影响
实验2-6
气泡冒出速率增大
气泡冒出速率增大
有气泡冒出,较慢
MnO2能加快
反应速率
FeCl3能加快
反应速率
无催化剂
反应较慢
外因因素:
现象 结论
加入MnO2
加入FeCl3
不加其他试剂
规律:催化剂能改变化学反应的速率。
有的催化剂能加快化学反应的速率,叫正催化剂;有的催化剂能减慢化学反应速率,叫负催化剂。在实践中,如没有特殊说明,凡说催化剂都是指正催化剂。
催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。
(2)催化剂对化学反应速率的影响
规律:当其它条件不变时,增大反应物的浓度,化学反应速率增大。减小反应物的浓度,化学反应速率减慢。
(3)浓度对化学反应速率的影响
规律:当其它条件不变时,增大固体反应物的表面积,化学反应速率增大。减小固体反应物的表面积,化学反应速率减慢。
(4)固体反应物的表面积对化学反应速率的 影响
(5)其他条件对化学反应速率的影响
[探究] 为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制如图曲线。请分析讨论以下问题。
(1)在0~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的是__________时间段,收集到气体最多的是_________时间段。
(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
(3)在t4后,为什么收集到的气体的体积不再增加?
⑵开始时C(H+)大,该反应的反应速率大; t1—t2由于反应放热温度升高,所以速率迅速增大;最后是因为C(H+)减小了,反应速率减慢.
第三节 化学反应的速率
和限度
第三课时 化学反应的限度
我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
什么叫做可逆反应?
在同一条件下,既向正反应方向进行,同时又向逆反应方向进行的反应。
典型的可逆反应有:
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
某温度和压强下的密闭容器中,2SO2+O2 2SO3
反应开始时有什么特征?
(从反应物浓度和正逆反应速率角度考虑,下同)
瞬间过后有什么特征?
一定时间段内有什么特征?
画出速率-时间(横坐标为时间,纵坐标为速率)图像。
此条件下进行到什么时候达到了这个反应的限度?
此时的反应是否停止了?
此时为何3种物质的浓度保持不变?
时间
(min)
物质的量
浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
1、定义
在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
前提(适用范围):可逆反应
内在本质:v(正)= v(逆) ≠0
外在标志:反应混合物中各组分
的浓度保持不变
二、化学平衡状态
2、化学平衡状态的特征
(3)动:动态平衡(v(正)= v(逆) ≠0)
(2)等:v(正)= v(逆)
(4)定:反应混合物中各组分的浓度保持 定,各组分的含量保持不变。
(5)变:条件改变,原平衡被破坏,在新
的条件下建立新的平衡。
(1)逆
练习
1、可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等
D
2、对于可逆反应M+N Q达到平衡状态时,
下列说法正确的是( )
A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. M、N、Q的浓度都保持不变
D. 反应已经停止
C
3、下列说法可以证明反应N2+3H2 2NH3
已达平衡状态的是 ( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
A、C
练习
4、在一定温度下,可逆反应A(g)+3B(g) 2C(g)
达到平衡的标志是( )
A. A的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2
C
3、化学平衡状态的判定
对于可逆反应m A(g) n B(g) + p C(g) 在一定条件下达到平衡状态有以下几个标志
(1)同种物质表示,A的生成速率和分解速率相等。
(2)不同种物质表示,单位时间生成n mol B和p mol C的同时,生成m mol A。
(3)A、B、C的物质的量、浓度、百分含量不再改变
