人教版高一化学必修二2.2《化学能与电能》(共18张PPT)
文档属性
| 名称 | 人教版高一化学必修二2.2《化学能与电能》(共18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-27 20:40:11 | ||
图片预览





文档简介
(共18张PPT)
2 化学能与电能(1)
1.熟悉如何将化学能转化为电能。
2.通过实验理解原电池的原理,掌握原电池的构成条件,会判断原电池的正极、负极,会书写电极反应式。
【学习目标】
教学重点 :原电池的概念、原理及构成条件。
教学难点 :理解原电池的原理。
1.在氧化还原反应中氧化剂_____电子,发生____反应,
还原剂_____电子,发生_____ 反应,氧化还原反应的本
质是________,同时伴随_____的变化。
能量
得到
还原
失去
氧化
电子转移
2、常见的电解质包括______________,非电解质包括
。
酸、碱、盐
大多数有机物(如蔗糖、酒精等)
3、初中物理学过,电流从___极流到___极,电子的流向与电流的流向相反,电子从___极流到___极,
。
负
负
正
正
火力发电的原理分析。
一、化学能转化为电能
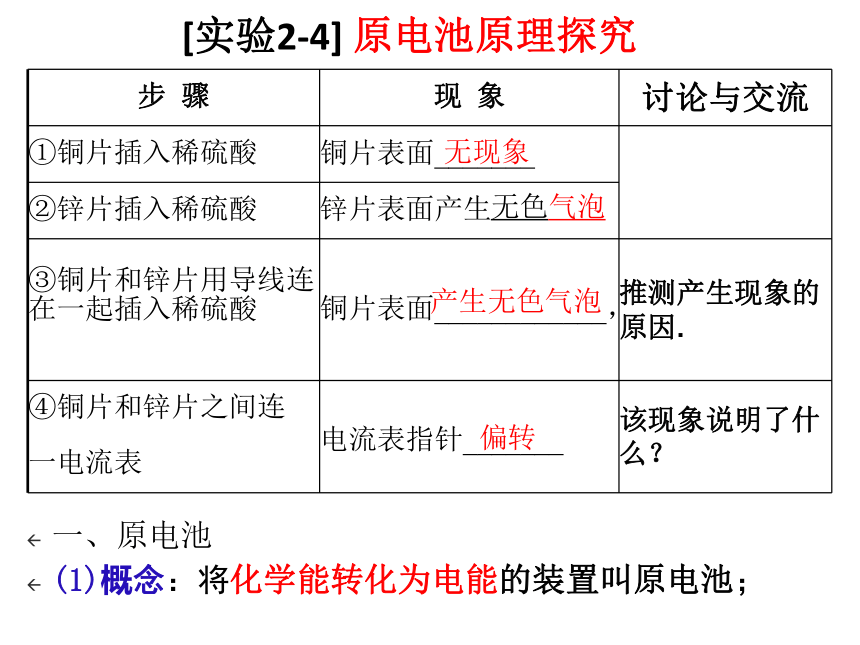
无现象
产生无色气泡
偏转
无色气泡
[实验2-4] 原电池原理探究
一、原电池
(1)概念:将化学能转化为电能的装置叫原电池;
步 骤 现 象 讨论与交流
①铜片插入稀硫酸 铜片表面_______
②锌片插入稀硫酸 锌片表面产生
③铜片和锌片用导线连在一起插入稀硫酸
铜片表面____________, 推测产生现象的原因.
④铜片和锌片之间连
一电流表 电流表指针_______ 该现象说明了什么?
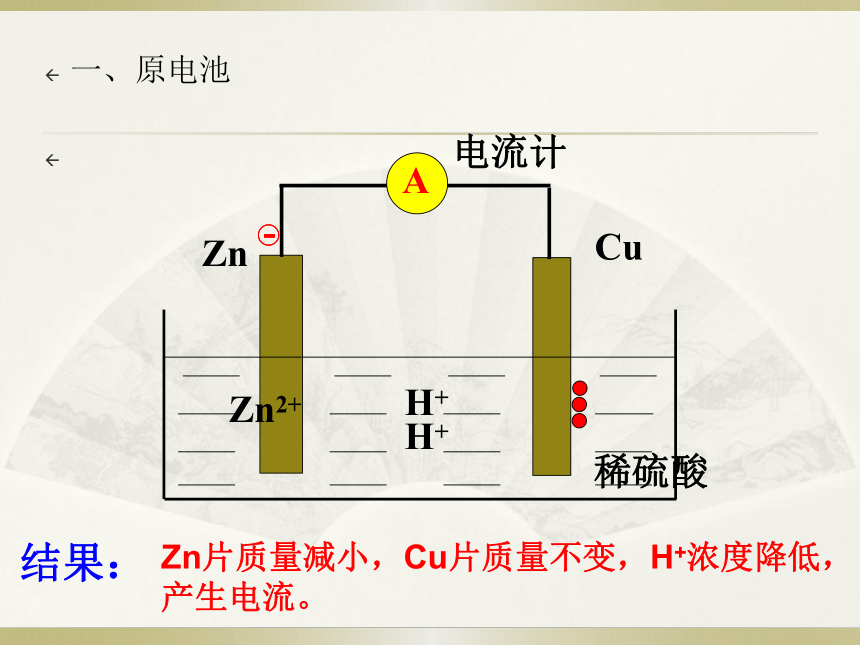
Cu
Zn
稀硫酸
Zn2+
H+
H+
电流计
结果:
Zn片质量减小,Cu片质量不变,H+浓度降低,产生电流。
一、原电池
[练习1]请判断下列原电池的正负极情况和电流方向,写出电极反应式和电池总反应式。
负极(Fe): Fe – 2e- = Fe2+
正极(Cu): 2H+ + 2e- = H2↑
电池总反应式: Fe + 2H+ = Fe2+ +H2↑
(3)构成条件
试归纳构成原电池需要哪些条件?
①具有活泼性不同的两个电极(金属与金属或金属与能导电的非金属)。
②电解质溶液
③用导线相连或直接接触
(形成闭合回路 )
④原电池反应必须是
自发的氧化还原反应。
Zn
Zn
Cu
A
B
C
D
E
F
√
[练习2] 下列哪些装置能构成原电池?
√
G
√
H
3、关于下图 所示装置的叙述,正确的是( )
A.铜是负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
D
4、如图所示,电流计指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )。
A.B极为原电池的正极
B.A、B、C可能分别为Zn、Cu、稀盐酸
C.C中阳离子向A极移动
D.A极发生氧化反应
C
如:在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换出的铜和锌能构成原电池的正负极,从而加快Zn与稀硫酸反应的速率。
(1)改变化学反应速率
二、原电池原理的应用:
1、把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为 ( )
A.a > b > c > d
B.a > c > d > b
C.c > a > b > d
D.b > d > c > a
B
(2)判断金属活动性的强弱
①请结合组成原电池的条件,将氧化还原反应:
Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。
1、电解溶液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
正极: 。
负极: 。
CuSO4溶液
Fe
C
Cu2++2e- =Cu
Fe-2e - =Fe2+
(3)设计原电池
?将反应:2FeCl3+Fe=3FeCl2设计成原电池
归纳:判断原电池正、负极的方法
1、根据两极材料的活泼性判断:
负极:较活泼的金属
正极:活泼性较弱的金属或非金属
2、根据电子流向或电流方向判断:
电子:由负极流向正极,
电流:由正极流向负极。
4、根据两极发生的变化来判断:
负极:(失电子)发生氧化反应,
正极:(得电子)发生还原反应。
3、根据离子定向移动的方向判断:
阳离子:向正极移动;
阴离子:向阴极移动。
5、根据两极产生的现象来判断:
负极:金属溶解
正极:增重或有气泡。
C
2 化学能与电能(1)
1.熟悉如何将化学能转化为电能。
2.通过实验理解原电池的原理,掌握原电池的构成条件,会判断原电池的正极、负极,会书写电极反应式。
【学习目标】
教学重点 :原电池的概念、原理及构成条件。
教学难点 :理解原电池的原理。
1.在氧化还原反应中氧化剂_____电子,发生____反应,
还原剂_____电子,发生_____ 反应,氧化还原反应的本
质是________,同时伴随_____的变化。
能量
得到
还原
失去
氧化
电子转移
2、常见的电解质包括______________,非电解质包括
。
酸、碱、盐
大多数有机物(如蔗糖、酒精等)
3、初中物理学过,电流从___极流到___极,电子的流向与电流的流向相反,电子从___极流到___极,
。
负
负
正
正
火力发电的原理分析。
一、化学能转化为电能
无现象
产生无色气泡
偏转
无色气泡
[实验2-4] 原电池原理探究
一、原电池
(1)概念:将化学能转化为电能的装置叫原电池;
步 骤 现 象 讨论与交流
①铜片插入稀硫酸 铜片表面_______
②锌片插入稀硫酸 锌片表面产生
③铜片和锌片用导线连在一起插入稀硫酸
铜片表面____________, 推测产生现象的原因.
④铜片和锌片之间连
一电流表 电流表指针_______ 该现象说明了什么?
Cu
Zn
稀硫酸
Zn2+
H+
H+
电流计
结果:
Zn片质量减小,Cu片质量不变,H+浓度降低,产生电流。
一、原电池
[练习1]请判断下列原电池的正负极情况和电流方向,写出电极反应式和电池总反应式。
负极(Fe): Fe – 2e- = Fe2+
正极(Cu): 2H+ + 2e- = H2↑
电池总反应式: Fe + 2H+ = Fe2+ +H2↑
(3)构成条件
试归纳构成原电池需要哪些条件?
①具有活泼性不同的两个电极(金属与金属或金属与能导电的非金属)。
②电解质溶液
③用导线相连或直接接触
(形成闭合回路 )
④原电池反应必须是
自发的氧化还原反应。
Zn
Zn
Cu
A
B
C
D
E
F
√
[练习2] 下列哪些装置能构成原电池?
√
G
√
H
3、关于下图 所示装置的叙述,正确的是( )
A.铜是负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
D
4、如图所示,电流计指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )。
A.B极为原电池的正极
B.A、B、C可能分别为Zn、Cu、稀盐酸
C.C中阳离子向A极移动
D.A极发生氧化反应
C
如:在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换出的铜和锌能构成原电池的正负极,从而加快Zn与稀硫酸反应的速率。
(1)改变化学反应速率
二、原电池原理的应用:
1、把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为 ( )
A.a > b > c > d
B.a > c > d > b
C.c > a > b > d
D.b > d > c > a
B
(2)判断金属活动性的强弱
①请结合组成原电池的条件,将氧化还原反应:
Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。
1、电解溶液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
正极: 。
负极: 。
CuSO4溶液
Fe
C
Cu2++2e- =Cu
Fe-2e - =Fe2+
(3)设计原电池
?将反应:2FeCl3+Fe=3FeCl2设计成原电池
归纳:判断原电池正、负极的方法
1、根据两极材料的活泼性判断:
负极:较活泼的金属
正极:活泼性较弱的金属或非金属
2、根据电子流向或电流方向判断:
电子:由负极流向正极,
电流:由正极流向负极。
4、根据两极发生的变化来判断:
负极:(失电子)发生氧化反应,
正极:(得电子)发生还原反应。
3、根据离子定向移动的方向判断:
阳离子:向正极移动;
阴离子:向阴极移动。
5、根据两极产生的现象来判断:
负极:金属溶解
正极:增重或有气泡。
C
