人教版高中化学必修二第三章第二节第一课时 乙烯26ppt
文档属性
| 名称 | 人教版高中化学必修二第三章第二节第一课时 乙烯26ppt |  | |
| 格式 | zip | ||
| 文件大小 | 366.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-30 08:14:26 | ||
图片预览



文档简介
(共26张PPT)
人教版高中化学必修二第三章
第二节第一课时
汕头一中高一化学备课组
汕头一中2022届高一下
乙烯的结构、性质和用途
学习目标:
1、对比乙烷和乙烯的结构,掌握乙烯的结构特点和表示方法。
2、了解乙烯的物理性质、用途和来源。
3、运用“结构决定性质”的观点,认识乙烯的官能团为碳碳双键,并重点掌握乙烯的化学性质。
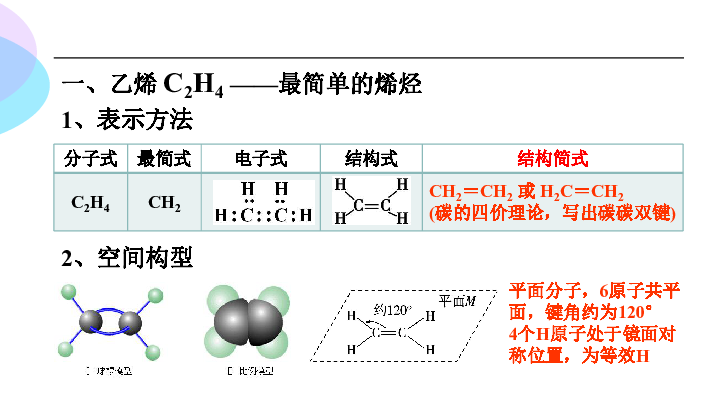
一、乙烯 C2H4 ——最简单的烯烃
1、表示方法
2、空间构型
分子式 最简式 电子式 结构式 结构简式
C2H4 CH2 CH2=CH2 或 H2C=CH2
(碳的四价理论,写出碳碳双键)
平面分子,6原子共平面,键角约为120°
4个H原子处于镜面对称位置,为等效H
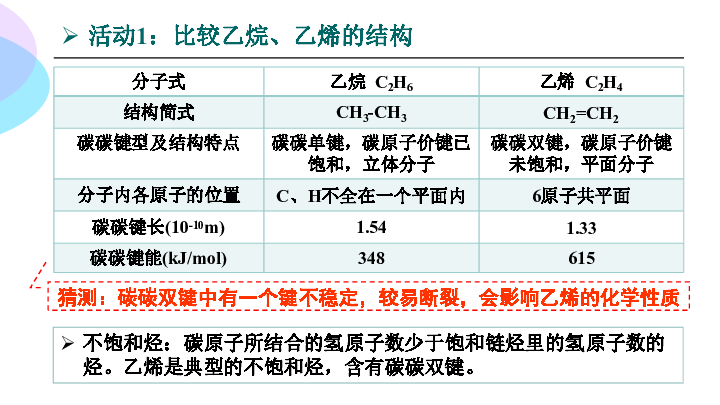
分子式 乙烷 C2H6 乙烯 C2H4
结构简式 CH3-CH3 CH2=CH2
碳碳键型及结构特点
碳碳单键,碳原子价键已饱和,立体分子 碳碳双键,碳原子价键未饱和,平面分子
分子内各原子的位置 C、H不全在一个平面内 6原子共平面
碳碳键长(10-10m) 1.54 1.33
碳碳键能(kJ/mol) 348 615
活动1:比较乙烷、乙烯的结构
猜测:碳碳双键中有一个键不稳定,较易断裂,会影响乙烯的化学性质
不饱和烃:碳原子所结合的氢原子数少于饱和链烃里的氢原子数的烃。乙烯是典型的不饱和烃,含有碳碳双键。
3、物理性质:无色气体,稍有气味,比空气略轻,难溶于水,易溶于有机溶剂,用排水集气法收集
4、化学性质
(1) 氧化反应
① 可燃性(被O2氧化): C2H4 + 3O2 → 2CO2 + 2H2O
乙烯完全燃烧生成的 n(CO2): n(H2O) = 1:1。
乙烯为可燃性气体,点燃前应验纯!
② 使酸性KMnO4溶液褪色(被酸性KMnO4溶液氧化)
利用该反应可以鉴别甲烷和乙烯。
点燃
烃完全燃烧通式:CxHy + (x+y/4) O2 → xCO2 + y/2H2O
点燃
活动2:探究乙烯的化学性质
探究实验1 现象 解释(方程式或文字)
点燃乙烯气体 火焰明亮,伴有黑烟,放出大量热 C2H4 + 3O2 → 2CO2 + 2H2O
点燃
左图为甲烷燃烧和乙烯燃烧现象对比。思考:为什么甲烷燃烧没有黑烟,而乙烯燃烧有黑烟?
答:乙烯含碳量(85.7%)比甲烷(75%)大,燃烧时易产生碳的小颗粒(燃烧不完全),所以有黑烟。
活动2:探究乙烯的化学性质
探究实验2 现象 解释(方程式或文字)
将乙烯气体通入酸性KMnO4溶液 溶液紫红色褪去 KMnO4 → Mn2+ (溶液褪色)
C2H4 → CO2
思考:若甲烷气体中混有乙烯,能否通过酸性KMnO4溶液洗气的方法除去乙烯?
答:不能,乙烯会变为CO2,引入新杂质。
继续思考:有什么方法可以除去甲烷中混有的乙烯?
+7 被还原
-2 被氧化 +4
活动2:探究乙烯的化学性质
探究实验3 现象 解释(方程式或文字)
将乙烯气体通入Br2的CCl4溶液 溶液红棕色褪去
已知生成的1,2-二溴乙烷为液体,易溶于有机溶剂,不溶于水。若甲烷中混有乙烯,可将混合气体通过Br2的CCl4溶液,除去乙烯。
思考:已知1,2-二溴乙烷密度比水大。若将乙烯气体通入溴水,现象有何不同?
答:液体分层,两层均无色 (上层为水层,下层为1,2-二溴乙烷) 。
1,2-二溴乙烷溶于CCl4
Br2浓度大时为红棕色,浓度较小则为橙红色
(2) 加成反应
① 乙烯与Br2反应不需条件。反应时,碳碳双键中的一个键断裂,2个Br原子分别加在2个价键不饱和的C原子上:
H H H H
H-C=C-H + Br-Br → H-C—C-H (1,2-二溴乙烷 ,无色液体)
Br Br
注意:有机反应中,只有燃烧方程式的反应物可以直接写分子式,其它方程式的有机物都应写为结构简式。
有机物分子中双键或三键两端的碳原子与其他原子或原子团直接结合,生成新的化合物的反应。
② 在一定条件下,乙烯还能与H2、HCl、Cl2、H2O等物质发生加成反应。请写出有关的反应方程式。
CH2=CH2 + H-H → CH3-CH3 (乙烷)
CH2=CH2 + H-Cl → CH3-CH2Cl (氯乙烷)
CH2=CH2 + Cl-Cl → CH2Cl-CH2Cl (1,2-二氯乙烷)
CH2=CH2 + H-OH → CH3-CH2OH (乙醇)
一定条件
n(双键): n(Br2、H2、HCl、X2、H2O等物质) = 1:1
一定条件
一定条件
一定条件
(3) 加聚反应
(课本97-98页)
乙烯之间的相互加成可以得到聚乙烯,反应方程式为:
注意:聚乙烯中没有双键!
由含不饱和键的单体(小分子)通过加成反应自身聚合为相对分子质量大的高分子的反应。
n CH2= CH2
[ CH2—CH2 ]n (聚乙烯)
催化剂
单体 链节(重复结构单元) 聚合度(高分子中所含链节的数目)
CH2=CH2 n
CH2—CH2
活动3:比较乙烷、乙烯的化学性质
由“结构决定性质”的观点可知:乙烯具有与乙烷不同的化学性质,是因为乙烯具有碳碳双键。
这种决定有机物的化学特性的原子或原子团叫做官能团。(概念在课本P74)
乙烷没有官能团。乙烯的官能团为碳碳双键。
物质 乙烷 CH3-CH3 乙烯 CH2=CH2
氧化反应 点燃 都能燃烧
通入酸性KMnO4溶液 不反应,溶液不褪色 有碳碳双键,易被氧化,KMnO4溶液紫红色褪去
取代反应 常温下可与Cl2发生光卤代 常温下不能发生光卤代
加成反应或加聚反应 无法发生 有碳碳双键,均能发生
5、用途
(1) 乙烯是重要的基本化工原料,主要用于制造塑料、合成纤维、有机溶剂等。
(2) 乙烯是一种植物生长调节剂,可以催熟水果。若要延长果实或花朵的成熟期,则需用浸泡过KMnO4溶液的硅土来吸收水果或花朵产生的乙烯,以达到保鲜的要求。
6、来源:石油的裂化裂解。(课本97页有方程式)
乙烯的产量可衡量一个国家的石油化工发展水平。
习题巩固
1、不能用于鉴别甲烷和乙烯的方法是( )
A、点燃 B、通入酸性高锰酸钾溶液
C、通入溴的CCl4溶液 D、通入四氯化碳溶液
2、CH4中混有C2H4,欲除去C2H4得到纯净干燥的CH4,最好依次通过哪一组试剂( )
A、澄清石灰水、浓硫酸 B 、溴水、浓硫酸
C、酸性KMnO4溶液、浓硫酸 D、浓硫酸、酸性KMnO4溶液
3、不可能使溴水褪色的是( )
A、乙烯 B、KOH溶液 C、SO2 D、稀硫酸
D
B
D
4、氯乙烷是一种重要的化工产品。以下两个反应均可得到氯乙烷:
① CH3CH3+Cl2 → CH3CH2Cl+HCl
② CH2=CH2+HCl → CH3CH2Cl
(1) ①属于______(填序号,下同)反应;②属于______反应。
A.加成 B.取代 C.氧化
(2) 你认为采用方案________合理,其理由是____________________。
解析:反应①为取代反应,易发生二氯取代、三氯取代等副反应,而反应②为加成反应,只有1种产物。
答案:(1)B A (2)② 方案①除生成CH3CH2Cl外,还有副反应,有其他杂质生成
习题巩固
一定条件
光
人教版高中化学必修二第三章
第二节第二课时
汕头一中高一化学备课组
汕头一中2022届高一下
学习目标:
1、通过石蜡油的分解实验,认识长链烷烃受热分解为烷烃和烯烃,并了解烯烃的定义和性质。
2、能运用加成反应的规律进行简单计算。
3、能进行简单的结构分析,能反推加成反应的反应物。
4、能根据实验结果进行分析、设计实验方案并进行验证。
石蜡油的分解、习题讲解
实验操作:将浸透了石蜡油(17个碳以上的液态烷烃混合物)的石棉放置在硬质试管的底部,试管中加入碎瓷片(作催化剂),给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面发生反应,生成一定量的气体。将气体依次通过酸性KMnO4溶液、Br2的CCl4溶液,观察现象,最后在D处用排水集气法收集一试管气体,验纯后,在D处直接点燃气体,观察燃烧情况。
辅助阅读材料:课本P97 方程式——十六烷的受热分解。
实验探究——石蜡油的分解
实验现象:B处溶液紫红色褪去,
C处溶液红棕色褪去,
D处点燃时火焰明亮并伴有黑烟
实验结论:石蜡油受热分解,气态产物中含有与烷烃性质不同的烃,且这些烃具有与乙烯相同的性质。
研究表明,产生的气态产物实际上是烯烃和烷烃的混合物。
生成物具有与烷烃相同的性质
生成物具有与乙烯相同的性质
1、烯烃:仅含有碳碳双键一种官能团的不饱和烃称为烯烃。
单烯烃:只有一个碳碳双键的链烯烃称为单烯烃,通式CnH2n (n≥2)
2、化学性质:活泼,能发生氧化反应、加成反应、加聚反应。
实验探究——石蜡油的分解
习题类型一:简单计算
1、写出一定条件下丙烯CH3CH=CH2与H2加成的反应方程式。
2、将标况下 L 丙烯气体通入含0.2 mol Br2的CCl4溶液中,可使溶液的橙红色完全褪去。
解: CH3CH=CH2 ~ Br2
22.4 L(标况下) 1 mol
4.48 L 0.2 mol
CH3CH= CH2 + H2 → CH3CH2CH3
一定条件
4.48
练习册P47 课后作业5、将CH4和C2H4的混合气体15 g通入盛有足量溴水的容器中,溴水的质量增加了7 g,则混合气体中CH4和C2H4的体积比为( )
A.1:2 B.2:1 C.3:2 D.2:3
解析:甲烷不能与溴水反应,乙烯可与Br2发生加成反应,因此,溴水质量增加是因为吸收了乙烯,故乙烯物质的量为 =
0.25 mol,则甲烷物质的量为 =0.5 mol。相同条件下(同温
同压),气体体积之比等于物质的量之比,CH4与C2H4体积比 2:1。
答案:B
习题类型一:简单计算
练习册P47 课堂演练5、使1 mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应,则两个过程中共消耗氯气的物质的量最多是( )
A.3 mol B.4 mol C.5 mol D.6 mol
解析:加成反应中,双键数与消耗Cl2的分子数之比为1:1。1 mol乙烯只能与1 mol Cl2发生加成反应。若发生完全取代,则分子内氢原子个数与消耗Cl2的分子数之比为1:1。1 mol 加成产物
CH2Cl-CH2Cl (1,2-二氯乙烷)中含4 mol氢原子,被氯原子完全取
代需消耗4 mol Cl2。共消耗5 mol Cl2,故选C。
答案:C
习题类型一:简单计算
练习册P46 自我检测2、所有原子均在同一平面上的是( )
A.C2H4 B.CHCl3 C.CH3CH=CH2 D.C2H6
解析:分子的结构判断,目前学过两方面知识:
1.甲烷型:四面体。凡是碳原子与4个原子形成4个共价键时,其空间结构都是四面体,5个原子中最多有3个原子共平面。
2.乙烯型: 平面结构。与碳碳双键直接相连的4个原子与2个碳原子共平面。
本题中,BCD三项中均出现碳原子与4个原子形成4个共价键,故这些分子都是立体结构,不可能所有原子都在同一平面上。
答案:A
习题类型二:结构分析
练习册P47 课后作业4、烷烃 是单烯烃R
和H2发生加成反应后的产物,则R可能的结构有( )
A.4种 B.5种 C.6种 D.7种
解析:原烯烃分子结构中碳碳双键可能存在的位置有①、②、③、
④、⑤5个位置( ),R可能结构有5种。
答案:B
习题类型三:反推反应物
练习册P47 课后作业7、为探究乙烯与溴的加成反应,甲、乙两同学先用
乙醇和浓硫酸为原料制取乙烯(CH3CH2OH CH2=CH2↑+H2O),甲同学将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。乙同学发现实验中产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,提出必须先除去杂质,再与溴水反应。请你参与探究:
(1) 甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是______(填序号)。
A.使溴水褪色的反应未必是加成反应 B.使溴水褪色的反应是加成反应
C.使溴水褪色的物质未必是乙烯 D.使溴水褪色的物质是乙烯
(2) 乙同学推测此乙烯中必定含有一种杂质气体,该气体是______。
习题类型四:定性实验
不能
AC
SO2
有还原性
(3) 在验证过程中必须除去全部杂质气体。为此,乙同学设计了如图所示的实验装置:
① Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中可盛放的试剂分
别是什么?提供选择:A. 品红溶液;
B. 溴水;C. 酸性KMnO4溶液;D. NaOH溶液。
② 能说明乙烯与Br2发生加成反应的现象是______________________________________
_______________________________________。
解析:
习题类型四:定性实验
装置 Ⅰ Ⅱ Ⅲ Ⅳ
作用 只验SO2 除SO2不除C2H4 验证SO2已除尽 验C2H4
试剂
A
D
A
B或C
Ⅰ中品红溶液褪色,Ⅲ中品红溶液不褪色,Ⅳ中溴水或酸性KMnO4溶液褪色
人教版高中化学必修二第三章
第二节第一课时
汕头一中高一化学备课组
汕头一中2022届高一下
乙烯的结构、性质和用途
学习目标:
1、对比乙烷和乙烯的结构,掌握乙烯的结构特点和表示方法。
2、了解乙烯的物理性质、用途和来源。
3、运用“结构决定性质”的观点,认识乙烯的官能团为碳碳双键,并重点掌握乙烯的化学性质。
一、乙烯 C2H4 ——最简单的烯烃
1、表示方法
2、空间构型
分子式 最简式 电子式 结构式 结构简式
C2H4 CH2 CH2=CH2 或 H2C=CH2
(碳的四价理论,写出碳碳双键)
平面分子,6原子共平面,键角约为120°
4个H原子处于镜面对称位置,为等效H
分子式 乙烷 C2H6 乙烯 C2H4
结构简式 CH3-CH3 CH2=CH2
碳碳键型及结构特点
碳碳单键,碳原子价键已饱和,立体分子 碳碳双键,碳原子价键未饱和,平面分子
分子内各原子的位置 C、H不全在一个平面内 6原子共平面
碳碳键长(10-10m) 1.54 1.33
碳碳键能(kJ/mol) 348 615
活动1:比较乙烷、乙烯的结构
猜测:碳碳双键中有一个键不稳定,较易断裂,会影响乙烯的化学性质
不饱和烃:碳原子所结合的氢原子数少于饱和链烃里的氢原子数的烃。乙烯是典型的不饱和烃,含有碳碳双键。
3、物理性质:无色气体,稍有气味,比空气略轻,难溶于水,易溶于有机溶剂,用排水集气法收集
4、化学性质
(1) 氧化反应
① 可燃性(被O2氧化): C2H4 + 3O2 → 2CO2 + 2H2O
乙烯完全燃烧生成的 n(CO2): n(H2O) = 1:1。
乙烯为可燃性气体,点燃前应验纯!
② 使酸性KMnO4溶液褪色(被酸性KMnO4溶液氧化)
利用该反应可以鉴别甲烷和乙烯。
点燃
烃完全燃烧通式:CxHy + (x+y/4) O2 → xCO2 + y/2H2O
点燃
活动2:探究乙烯的化学性质
探究实验1 现象 解释(方程式或文字)
点燃乙烯气体 火焰明亮,伴有黑烟,放出大量热 C2H4 + 3O2 → 2CO2 + 2H2O
点燃
左图为甲烷燃烧和乙烯燃烧现象对比。思考:为什么甲烷燃烧没有黑烟,而乙烯燃烧有黑烟?
答:乙烯含碳量(85.7%)比甲烷(75%)大,燃烧时易产生碳的小颗粒(燃烧不完全),所以有黑烟。
活动2:探究乙烯的化学性质
探究实验2 现象 解释(方程式或文字)
将乙烯气体通入酸性KMnO4溶液 溶液紫红色褪去 KMnO4 → Mn2+ (溶液褪色)
C2H4 → CO2
思考:若甲烷气体中混有乙烯,能否通过酸性KMnO4溶液洗气的方法除去乙烯?
答:不能,乙烯会变为CO2,引入新杂质。
继续思考:有什么方法可以除去甲烷中混有的乙烯?
+7 被还原
-2 被氧化 +4
活动2:探究乙烯的化学性质
探究实验3 现象 解释(方程式或文字)
将乙烯气体通入Br2的CCl4溶液 溶液红棕色褪去
已知生成的1,2-二溴乙烷为液体,易溶于有机溶剂,不溶于水。若甲烷中混有乙烯,可将混合气体通过Br2的CCl4溶液,除去乙烯。
思考:已知1,2-二溴乙烷密度比水大。若将乙烯气体通入溴水,现象有何不同?
答:液体分层,两层均无色 (上层为水层,下层为1,2-二溴乙烷) 。
1,2-二溴乙烷溶于CCl4
Br2浓度大时为红棕色,浓度较小则为橙红色
(2) 加成反应
① 乙烯与Br2反应不需条件。反应时,碳碳双键中的一个键断裂,2个Br原子分别加在2个价键不饱和的C原子上:
H H H H
H-C=C-H + Br-Br → H-C—C-H (1,2-二溴乙烷 ,无色液体)
Br Br
注意:有机反应中,只有燃烧方程式的反应物可以直接写分子式,其它方程式的有机物都应写为结构简式。
有机物分子中双键或三键两端的碳原子与其他原子或原子团直接结合,生成新的化合物的反应。
② 在一定条件下,乙烯还能与H2、HCl、Cl2、H2O等物质发生加成反应。请写出有关的反应方程式。
CH2=CH2 + H-H → CH3-CH3 (乙烷)
CH2=CH2 + H-Cl → CH3-CH2Cl (氯乙烷)
CH2=CH2 + Cl-Cl → CH2Cl-CH2Cl (1,2-二氯乙烷)
CH2=CH2 + H-OH → CH3-CH2OH (乙醇)
一定条件
n(双键): n(Br2、H2、HCl、X2、H2O等物质) = 1:1
一定条件
一定条件
一定条件
(3) 加聚反应
(课本97-98页)
乙烯之间的相互加成可以得到聚乙烯,反应方程式为:
注意:聚乙烯中没有双键!
由含不饱和键的单体(小分子)通过加成反应自身聚合为相对分子质量大的高分子的反应。
n CH2= CH2
[ CH2—CH2 ]n (聚乙烯)
催化剂
单体 链节(重复结构单元) 聚合度(高分子中所含链节的数目)
CH2=CH2 n
CH2—CH2
活动3:比较乙烷、乙烯的化学性质
由“结构决定性质”的观点可知:乙烯具有与乙烷不同的化学性质,是因为乙烯具有碳碳双键。
这种决定有机物的化学特性的原子或原子团叫做官能团。(概念在课本P74)
乙烷没有官能团。乙烯的官能团为碳碳双键。
物质 乙烷 CH3-CH3 乙烯 CH2=CH2
氧化反应 点燃 都能燃烧
通入酸性KMnO4溶液 不反应,溶液不褪色 有碳碳双键,易被氧化,KMnO4溶液紫红色褪去
取代反应 常温下可与Cl2发生光卤代 常温下不能发生光卤代
加成反应或加聚反应 无法发生 有碳碳双键,均能发生
5、用途
(1) 乙烯是重要的基本化工原料,主要用于制造塑料、合成纤维、有机溶剂等。
(2) 乙烯是一种植物生长调节剂,可以催熟水果。若要延长果实或花朵的成熟期,则需用浸泡过KMnO4溶液的硅土来吸收水果或花朵产生的乙烯,以达到保鲜的要求。
6、来源:石油的裂化裂解。(课本97页有方程式)
乙烯的产量可衡量一个国家的石油化工发展水平。
习题巩固
1、不能用于鉴别甲烷和乙烯的方法是( )
A、点燃 B、通入酸性高锰酸钾溶液
C、通入溴的CCl4溶液 D、通入四氯化碳溶液
2、CH4中混有C2H4,欲除去C2H4得到纯净干燥的CH4,最好依次通过哪一组试剂( )
A、澄清石灰水、浓硫酸 B 、溴水、浓硫酸
C、酸性KMnO4溶液、浓硫酸 D、浓硫酸、酸性KMnO4溶液
3、不可能使溴水褪色的是( )
A、乙烯 B、KOH溶液 C、SO2 D、稀硫酸
D
B
D
4、氯乙烷是一种重要的化工产品。以下两个反应均可得到氯乙烷:
① CH3CH3+Cl2 → CH3CH2Cl+HCl
② CH2=CH2+HCl → CH3CH2Cl
(1) ①属于______(填序号,下同)反应;②属于______反应。
A.加成 B.取代 C.氧化
(2) 你认为采用方案________合理,其理由是____________________。
解析:反应①为取代反应,易发生二氯取代、三氯取代等副反应,而反应②为加成反应,只有1种产物。
答案:(1)B A (2)② 方案①除生成CH3CH2Cl外,还有副反应,有其他杂质生成
习题巩固
一定条件
光
人教版高中化学必修二第三章
第二节第二课时
汕头一中高一化学备课组
汕头一中2022届高一下
学习目标:
1、通过石蜡油的分解实验,认识长链烷烃受热分解为烷烃和烯烃,并了解烯烃的定义和性质。
2、能运用加成反应的规律进行简单计算。
3、能进行简单的结构分析,能反推加成反应的反应物。
4、能根据实验结果进行分析、设计实验方案并进行验证。
石蜡油的分解、习题讲解
实验操作:将浸透了石蜡油(17个碳以上的液态烷烃混合物)的石棉放置在硬质试管的底部,试管中加入碎瓷片(作催化剂),给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面发生反应,生成一定量的气体。将气体依次通过酸性KMnO4溶液、Br2的CCl4溶液,观察现象,最后在D处用排水集气法收集一试管气体,验纯后,在D处直接点燃气体,观察燃烧情况。
辅助阅读材料:课本P97 方程式——十六烷的受热分解。
实验探究——石蜡油的分解
实验现象:B处溶液紫红色褪去,
C处溶液红棕色褪去,
D处点燃时火焰明亮并伴有黑烟
实验结论:石蜡油受热分解,气态产物中含有与烷烃性质不同的烃,且这些烃具有与乙烯相同的性质。
研究表明,产生的气态产物实际上是烯烃和烷烃的混合物。
生成物具有与烷烃相同的性质
生成物具有与乙烯相同的性质
1、烯烃:仅含有碳碳双键一种官能团的不饱和烃称为烯烃。
单烯烃:只有一个碳碳双键的链烯烃称为单烯烃,通式CnH2n (n≥2)
2、化学性质:活泼,能发生氧化反应、加成反应、加聚反应。
实验探究——石蜡油的分解
习题类型一:简单计算
1、写出一定条件下丙烯CH3CH=CH2与H2加成的反应方程式。
2、将标况下 L 丙烯气体通入含0.2 mol Br2的CCl4溶液中,可使溶液的橙红色完全褪去。
解: CH3CH=CH2 ~ Br2
22.4 L(标况下) 1 mol
4.48 L 0.2 mol
CH3CH= CH2 + H2 → CH3CH2CH3
一定条件
4.48
练习册P47 课后作业5、将CH4和C2H4的混合气体15 g通入盛有足量溴水的容器中,溴水的质量增加了7 g,则混合气体中CH4和C2H4的体积比为( )
A.1:2 B.2:1 C.3:2 D.2:3
解析:甲烷不能与溴水反应,乙烯可与Br2发生加成反应,因此,溴水质量增加是因为吸收了乙烯,故乙烯物质的量为 =
0.25 mol,则甲烷物质的量为 =0.5 mol。相同条件下(同温
同压),气体体积之比等于物质的量之比,CH4与C2H4体积比 2:1。
答案:B
习题类型一:简单计算
练习册P47 课堂演练5、使1 mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应,则两个过程中共消耗氯气的物质的量最多是( )
A.3 mol B.4 mol C.5 mol D.6 mol
解析:加成反应中,双键数与消耗Cl2的分子数之比为1:1。1 mol乙烯只能与1 mol Cl2发生加成反应。若发生完全取代,则分子内氢原子个数与消耗Cl2的分子数之比为1:1。1 mol 加成产物
CH2Cl-CH2Cl (1,2-二氯乙烷)中含4 mol氢原子,被氯原子完全取
代需消耗4 mol Cl2。共消耗5 mol Cl2,故选C。
答案:C
习题类型一:简单计算
练习册P46 自我检测2、所有原子均在同一平面上的是( )
A.C2H4 B.CHCl3 C.CH3CH=CH2 D.C2H6
解析:分子的结构判断,目前学过两方面知识:
1.甲烷型:四面体。凡是碳原子与4个原子形成4个共价键时,其空间结构都是四面体,5个原子中最多有3个原子共平面。
2.乙烯型: 平面结构。与碳碳双键直接相连的4个原子与2个碳原子共平面。
本题中,BCD三项中均出现碳原子与4个原子形成4个共价键,故这些分子都是立体结构,不可能所有原子都在同一平面上。
答案:A
习题类型二:结构分析
练习册P47 课后作业4、烷烃 是单烯烃R
和H2发生加成反应后的产物,则R可能的结构有( )
A.4种 B.5种 C.6种 D.7种
解析:原烯烃分子结构中碳碳双键可能存在的位置有①、②、③、
④、⑤5个位置( ),R可能结构有5种。
答案:B
习题类型三:反推反应物
练习册P47 课后作业7、为探究乙烯与溴的加成反应,甲、乙两同学先用
乙醇和浓硫酸为原料制取乙烯(CH3CH2OH CH2=CH2↑+H2O),甲同学将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。乙同学发现实验中产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,提出必须先除去杂质,再与溴水反应。请你参与探究:
(1) 甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是______(填序号)。
A.使溴水褪色的反应未必是加成反应 B.使溴水褪色的反应是加成反应
C.使溴水褪色的物质未必是乙烯 D.使溴水褪色的物质是乙烯
(2) 乙同学推测此乙烯中必定含有一种杂质气体,该气体是______。
习题类型四:定性实验
不能
AC
SO2
有还原性
(3) 在验证过程中必须除去全部杂质气体。为此,乙同学设计了如图所示的实验装置:
① Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中可盛放的试剂分
别是什么?提供选择:A. 品红溶液;
B. 溴水;C. 酸性KMnO4溶液;D. NaOH溶液。
② 能说明乙烯与Br2发生加成反应的现象是______________________________________
_______________________________________。
解析:
习题类型四:定性实验
装置 Ⅰ Ⅱ Ⅲ Ⅳ
作用 只验SO2 除SO2不除C2H4 验证SO2已除尽 验C2H4
试剂
A
D
A
B或C
Ⅰ中品红溶液褪色,Ⅲ中品红溶液不褪色,Ⅳ中溴水或酸性KMnO4溶液褪色
