鲁科版必修1第一章第二节研究物质性质的基本方法第一课时(共22页)
文档属性
| 名称 | 鲁科版必修1第一章第二节研究物质性质的基本方法第一课时(共22页) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-30 00:00:00 | ||
图片预览








文档简介
(共20张PPT)
1. 你知道金属活动性顺序吗?
2. 金属有哪些通性?请根据金属通性及其在金属活动性顺序表中的位置预测钠的性质
【实验探究一】
观察金属钠及金属钠与水反应的现象
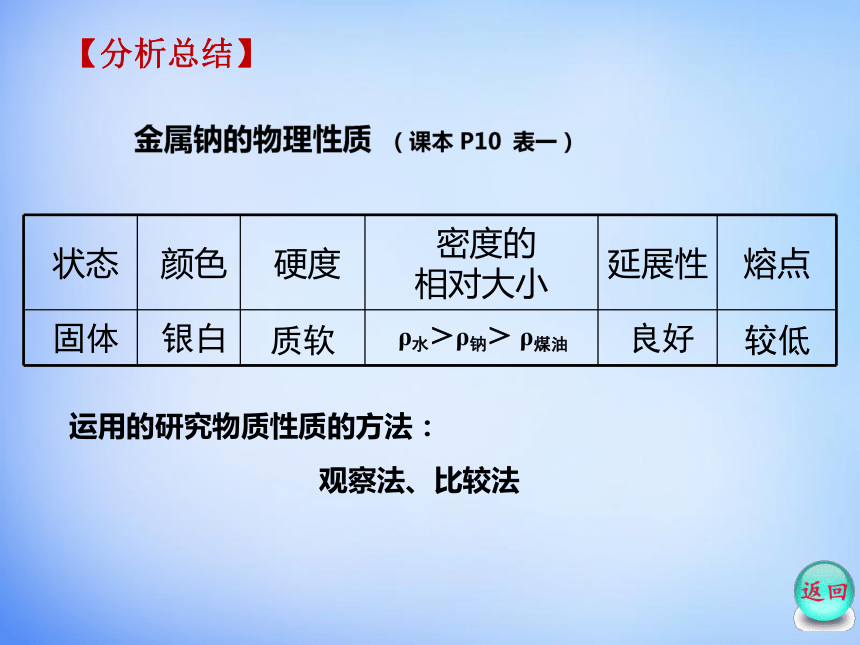
固体
银白
质软
ρ水>ρ钠> ρ煤油
良好
较低
【分析总结】
运用的研究物质性质的方法:
观察法、比较法
状态 颜色 硬度 密度的
相对大小 延展性 熔点
浮
熔化
游动
响声
红
小
气体
产生气体
碱性
低
实验现象及现象分析
NaOH
H2
实验步骤 实验现象 现象分析
钠___在水面上 钠的密度比水___
钠_____成闪亮的小球 钠的熔点___,反应放出热量
小球在水面上四处_____,最后完全消失 反应产生的_____推动小球运动
与水反应发出嘶嘶____ 钠与水反应_________
反应后溶液变为___色 反应生成_____物质
实验结论 常温下,钠与水剧烈反应,生成_______和____。
猜想:钠与酸反应跟与水反应哪个更剧烈?
反应方程式:2Na+2HCl===2NaCl+H2↑
1、钠与盐酸溶液反应过程中,钠先与水反应还是先与HCl反应?
2、若HCl不足 ,又会怎样?
【分析比较】
金属钠与酸反应
反应实质:2Na+ 2H+ === 2Na++ H2↑
钠和盐酸的反应:
铁和盐酸的反应:
铝和盐酸的反应:
2Na + 2HCl === 2NaCl + H2↑
Fe + 2HCl === FeCl2 + H2↑
2Al + 6HCl === 2AlCl3 + 3H2↑
结论:金属与酸反应生成氢气的量是其化合价的1/2
【探规寻律】
金属钠与盐反应
猜想一:钠投入到CuSO4溶液中会出现什么现象?
钠投入到CuSO4溶液中发生的反应为:
2Na+2H2O=== 2NaOH+H2↑ ①
2NaOH+CuSO4=== Cu(OH)2↓+Na2SO4 ②
反应① + 反应②:
2Na+2H2O+ CuSO4 === Cu(OH)2↓+H2↑+ Na2SO4
【实验探究二】
【一题多变】
若将一小粒金属钠投入到饱和FeCl3溶液中,会发生什么现象?解释原因。
猜想二:钠投入到NaCl溶液中会发生什么反应?
反应方程式:2Na+2H2O === 2NaOH+H2↑
【结论】
钠投入到盐溶液中,先与水反应,生成NaOH,如果NaOH能与该盐反应,则继续发生复分解反应。
钠不能从盐溶液中置换出金属,那么什么情况下钠能置换出盐中的金属?
【追根究底】
白
黄
淡黄
Na2O2
淡黄
Na2O
Na2O2
暗
2Na2O
钠与氧气的反应
【实验探究三】
实验步骤 用小刀切下一小块金属钠,在空气中放置片刻,与O2反应 放在石棉网上加热,与O2反应
实验现象 光亮的切面变___ 钠熔化成银白色小球,剧烈燃烧,发出___色火焰,生成_____色固体
实验结论 常温下钠极易与氧气反应:4Na+O2===_______(__色固体) 钠易燃烧:2Na+O2 ______(_____色固体)
拓展 钠与O2反应的产物取决于反应条件,常温下生成______,加热(或点燃)条件下生成_______
高压钠灯
优点:
荧光射程远;
透雾能力强;
不降低热度水平;
能减少能源消耗
焰色反应:制作烟火
【金属钠的用途】
金属冶炼:利用钠的强还原性
制造合金
金属钠的物理性质;
金属钠的化学性质:与水反应、与酸反应、与盐反应、与氧反应;
研究物质性质的基本方法:观察法、实验法、分类法、比较法等。
Na与FeCl3溶液反应实验现象及方程式
课本P18本节课内容
课本P10 Na与Fe性质的比较
1. 你知道金属活动性顺序吗?
2. 金属有哪些通性?请根据金属通性及其在金属活动性顺序表中的位置预测钠的性质
【实验探究一】
观察金属钠及金属钠与水反应的现象
固体
银白
质软
ρ水>ρ钠> ρ煤油
良好
较低
【分析总结】
运用的研究物质性质的方法:
观察法、比较法
状态 颜色 硬度 密度的
相对大小 延展性 熔点
浮
熔化
游动
响声
红
小
气体
产生气体
碱性
低
实验现象及现象分析
NaOH
H2
实验步骤 实验现象 现象分析
钠___在水面上 钠的密度比水___
钠_____成闪亮的小球 钠的熔点___,反应放出热量
小球在水面上四处_____,最后完全消失 反应产生的_____推动小球运动
与水反应发出嘶嘶____ 钠与水反应_________
反应后溶液变为___色 反应生成_____物质
实验结论 常温下,钠与水剧烈反应,生成_______和____。
猜想:钠与酸反应跟与水反应哪个更剧烈?
反应方程式:2Na+2HCl===2NaCl+H2↑
1、钠与盐酸溶液反应过程中,钠先与水反应还是先与HCl反应?
2、若HCl不足 ,又会怎样?
【分析比较】
金属钠与酸反应
反应实质:2Na+ 2H+ === 2Na++ H2↑
钠和盐酸的反应:
铁和盐酸的反应:
铝和盐酸的反应:
2Na + 2HCl === 2NaCl + H2↑
Fe + 2HCl === FeCl2 + H2↑
2Al + 6HCl === 2AlCl3 + 3H2↑
结论:金属与酸反应生成氢气的量是其化合价的1/2
【探规寻律】
金属钠与盐反应
猜想一:钠投入到CuSO4溶液中会出现什么现象?
钠投入到CuSO4溶液中发生的反应为:
2Na+2H2O=== 2NaOH+H2↑ ①
2NaOH+CuSO4=== Cu(OH)2↓+Na2SO4 ②
反应① + 反应②:
2Na+2H2O+ CuSO4 === Cu(OH)2↓+H2↑+ Na2SO4
【实验探究二】
【一题多变】
若将一小粒金属钠投入到饱和FeCl3溶液中,会发生什么现象?解释原因。
猜想二:钠投入到NaCl溶液中会发生什么反应?
反应方程式:2Na+2H2O === 2NaOH+H2↑
【结论】
钠投入到盐溶液中,先与水反应,生成NaOH,如果NaOH能与该盐反应,则继续发生复分解反应。
钠不能从盐溶液中置换出金属,那么什么情况下钠能置换出盐中的金属?
【追根究底】
白
黄
淡黄
Na2O2
淡黄
Na2O
Na2O2
暗
2Na2O
钠与氧气的反应
【实验探究三】
实验步骤 用小刀切下一小块金属钠,在空气中放置片刻,与O2反应 放在石棉网上加热,与O2反应
实验现象 光亮的切面变___ 钠熔化成银白色小球,剧烈燃烧,发出___色火焰,生成_____色固体
实验结论 常温下钠极易与氧气反应:4Na+O2===_______(__色固体) 钠易燃烧:2Na+O2 ______(_____色固体)
拓展 钠与O2反应的产物取决于反应条件,常温下生成______,加热(或点燃)条件下生成_______
高压钠灯
优点:
荧光射程远;
透雾能力强;
不降低热度水平;
能减少能源消耗
焰色反应:制作烟火
【金属钠的用途】
金属冶炼:利用钠的强还原性
制造合金
金属钠的物理性质;
金属钠的化学性质:与水反应、与酸反应、与盐反应、与氧反应;
研究物质性质的基本方法:观察法、实验法、分类法、比较法等。
Na与FeCl3溶液反应实验现象及方程式
课本P18本节课内容
课本P10 Na与Fe性质的比较
