人教版高中化学 必修2 第四章第一节 海水资源的综合利用20ppt
文档属性
| 名称 | 人教版高中化学 必修2 第四章第一节 海水资源的综合利用20ppt |  | |
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-30 22:38:35 | ||
图片预览




文档简介
(共20张PPT)
海水资源的综合开发利用
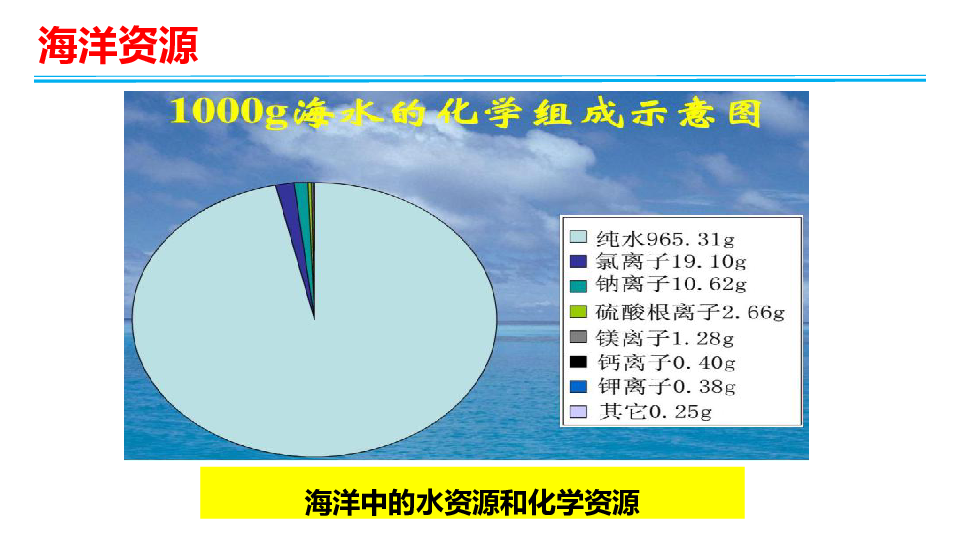
海洋资源
我们能从海洋中获得哪些资源呢?
海洋中的生物资源
海洋中的矿产资源
海洋能源资源
海洋中的水资源和化学资源
海洋资源
水资源——海水淡化
海水制盐
海带提碘
海水提溴
海水提镁
海洋资源
海水的淡化方法:
①蒸 馏 法(最先使用,技术成熟,但成本高)
②电渗析法(成本低,但未能大量生产)
③离子交换法(目前正迅速发展,但需要不断更新离子交换树脂)
原理:加热到水的沸点,液态水变成水蒸气,与海水中的盐分离,水蒸气冷凝得淡水。
1 水资源——海水淡化
太阳能蒸发原理示意图
④太阳能蒸发法
1 水资源——海水淡化
这是一种传统的制盐方法:将海水引入盐田,在太阳照射下蒸发水,留下粗盐。
2 海水制盐
海带中的碘元素主要以I—的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。
用H2O2做氧化剂,反应的离子方程式是:2I— +H2O2+2H+==I2+2H2O
从海带中提取碘的实验:
①反应原理
3 海带提碘
海带
海带灰
溶解过滤
灼烧
残渣
含I—的溶液
稀H2SO4
H2O2
含I2的溶液
含I2的有机溶液
萃取
②提取流程
3 海带提碘
(1)称取3 g干海带,用刷子把干海带表面的附着物刷净(不要用水洗,有I-)。 将海带剪碎,用酒精润湿(便于灼烧)后,放在坩埚中。
(2)用酒精灯灼烧盛有海带的坩埚,至海带完全成灰,停止加热,冷却。
(3)将海带灰转移到小烧杯中,再向烧杯中加入10 mL蒸馏水,搅拌,煮沸
2 min-3 min,使可溶物溶解,过滤。
(4)向滤液中滴入几滴稀硫酸,再加入约1 mL H2O2溶液,观察现象。
(5)取少量上述滤液,加几滴淀粉溶液,观察现象。
③实验方法
3 海带提碘
④实验现象:
⑤化学方程式:
加入H2O2后,溶液由无色变为黄色,再加入淀粉溶液后,溶液又变为深蓝色。
2KI+ H2O2+H2SO4===I2 +K2SO4+2H2O
3 海带提碘
1.海带为什么不能用水冲洗?剪碎后,为什么要用酒精润湿?
2.若要从含I2的水溶液中提取I2,应用什么方法?
海带如果用水浸泡,碘化物会部分溶解而损耗,且海带不易燃烧。酒精润湿可使海带易于灼烧完全,并缩短灼烧时间。
用有机溶剂萃取水溶液中的I2,分液后再用蒸馏法将I2与有机溶剂分离开。
思考交流
3 海带提碘
紫红
3.实验室萃取Br2、I2在什么仪器中进行?常用的萃取剂是什么?它们在萃取剂中一般呈现什么颜色?
橙红
有机溶剂,如CCl4 、苯
分液漏斗
3 海带提碘
Br2 + SO2 + 2H2O === 2HBr + H2SO4
2NaBr + Cl2 === Br2 +2NaCl
2HBr + Cl2 === Br2 + 2HCl
HBr
溴水
通入Cl2
通入空气和水蒸气
通入Cl2
加SO2
浓缩海水
产品溴
富集Br —
溴的沸点低,易挥发
4 海水提溴
Mg
无水MgCl2
MgCl2溶液
Mg(OH)2沉淀
溶液
试剂①
试剂②
熔融 电解
海水
(含Mg2+)
操作①
石灰乳
Mg2++Ca(OH)2==Mg(OH)2+Ca2+
就地取材-贝壳(CaCO3)
CaCO3==CaO+CO2↑ CaO+H2O==Ca(OH)2
△
过滤
盐酸
Mg(OH)2+2HCl ==MgCl+2H2O
MgCl2(熔融)===Mg+Cl2↑
电解
5 海水提镁
海水综合利用联合工业体系一例
海水综合利用
1.从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( )
D
知识巩固
2.由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )
A.②④⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①
D
知识巩固
3.许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水
D
知识巩固
4.在空气吹出法的工艺中,有选用纯碱溶液作溴蒸气吸收剂的,也有选用SO2作溴蒸气吸收剂的,下列有关说法正确的是( )
A.两种吸收过程中,Br2只作氧化剂
B.两种吸收过程都发生了氧化还原反应
C.用纯碱溶液作吸收剂时,纯碱作还原剂
D.用纯碱溶液作吸收剂只发生了复分解反应
B
知识巩固
海水资源的综合开发利用
海洋资源
我们能从海洋中获得哪些资源呢?
海洋中的生物资源
海洋中的矿产资源
海洋能源资源
海洋中的水资源和化学资源
海洋资源
水资源——海水淡化
海水制盐
海带提碘
海水提溴
海水提镁
海洋资源
海水的淡化方法:
①蒸 馏 法(最先使用,技术成熟,但成本高)
②电渗析法(成本低,但未能大量生产)
③离子交换法(目前正迅速发展,但需要不断更新离子交换树脂)
原理:加热到水的沸点,液态水变成水蒸气,与海水中的盐分离,水蒸气冷凝得淡水。
1 水资源——海水淡化
太阳能蒸发原理示意图
④太阳能蒸发法
1 水资源——海水淡化
这是一种传统的制盐方法:将海水引入盐田,在太阳照射下蒸发水,留下粗盐。
2 海水制盐
海带中的碘元素主要以I—的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。
用H2O2做氧化剂,反应的离子方程式是:2I— +H2O2+2H+==I2+2H2O
从海带中提取碘的实验:
①反应原理
3 海带提碘
海带
海带灰
溶解过滤
灼烧
残渣
含I—的溶液
稀H2SO4
H2O2
含I2的溶液
含I2的有机溶液
萃取
②提取流程
3 海带提碘
(1)称取3 g干海带,用刷子把干海带表面的附着物刷净(不要用水洗,有I-)。 将海带剪碎,用酒精润湿(便于灼烧)后,放在坩埚中。
(2)用酒精灯灼烧盛有海带的坩埚,至海带完全成灰,停止加热,冷却。
(3)将海带灰转移到小烧杯中,再向烧杯中加入10 mL蒸馏水,搅拌,煮沸
2 min-3 min,使可溶物溶解,过滤。
(4)向滤液中滴入几滴稀硫酸,再加入约1 mL H2O2溶液,观察现象。
(5)取少量上述滤液,加几滴淀粉溶液,观察现象。
③实验方法
3 海带提碘
④实验现象:
⑤化学方程式:
加入H2O2后,溶液由无色变为黄色,再加入淀粉溶液后,溶液又变为深蓝色。
2KI+ H2O2+H2SO4===I2 +K2SO4+2H2O
3 海带提碘
1.海带为什么不能用水冲洗?剪碎后,为什么要用酒精润湿?
2.若要从含I2的水溶液中提取I2,应用什么方法?
海带如果用水浸泡,碘化物会部分溶解而损耗,且海带不易燃烧。酒精润湿可使海带易于灼烧完全,并缩短灼烧时间。
用有机溶剂萃取水溶液中的I2,分液后再用蒸馏法将I2与有机溶剂分离开。
思考交流
3 海带提碘
紫红
3.实验室萃取Br2、I2在什么仪器中进行?常用的萃取剂是什么?它们在萃取剂中一般呈现什么颜色?
橙红
有机溶剂,如CCl4 、苯
分液漏斗
3 海带提碘
Br2 + SO2 + 2H2O === 2HBr + H2SO4
2NaBr + Cl2 === Br2 +2NaCl
2HBr + Cl2 === Br2 + 2HCl
HBr
溴水
通入Cl2
通入空气和水蒸气
通入Cl2
加SO2
浓缩海水
产品溴
富集Br —
溴的沸点低,易挥发
4 海水提溴
Mg
无水MgCl2
MgCl2溶液
Mg(OH)2沉淀
溶液
试剂①
试剂②
熔融 电解
海水
(含Mg2+)
操作①
石灰乳
Mg2++Ca(OH)2==Mg(OH)2+Ca2+
就地取材-贝壳(CaCO3)
CaCO3==CaO+CO2↑ CaO+H2O==Ca(OH)2
△
过滤
盐酸
Mg(OH)2+2HCl ==MgCl+2H2O
MgCl2(熔融)===Mg+Cl2↑
电解
5 海水提镁
海水综合利用联合工业体系一例
海水综合利用
1.从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( )
D
知识巩固
2.由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )
A.②④⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①
D
知识巩固
3.许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水
D
知识巩固
4.在空气吹出法的工艺中,有选用纯碱溶液作溴蒸气吸收剂的,也有选用SO2作溴蒸气吸收剂的,下列有关说法正确的是( )
A.两种吸收过程中,Br2只作氧化剂
B.两种吸收过程都发生了氧化还原反应
C.用纯碱溶液作吸收剂时,纯碱作还原剂
D.用纯碱溶液作吸收剂只发生了复分解反应
B
知识巩固
