2.2化学能转化为电能(第5课时 )同步课件23页
文档属性
| 名称 | 2.2化学能转化为电能(第5课时 )同步课件23页 |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-06 10:56:29 | ||
图片预览





文档简介
(共24张PPT)
第三单元 化学能与电能的转化
第3课时 电能化学能转化为化学能
第一节课
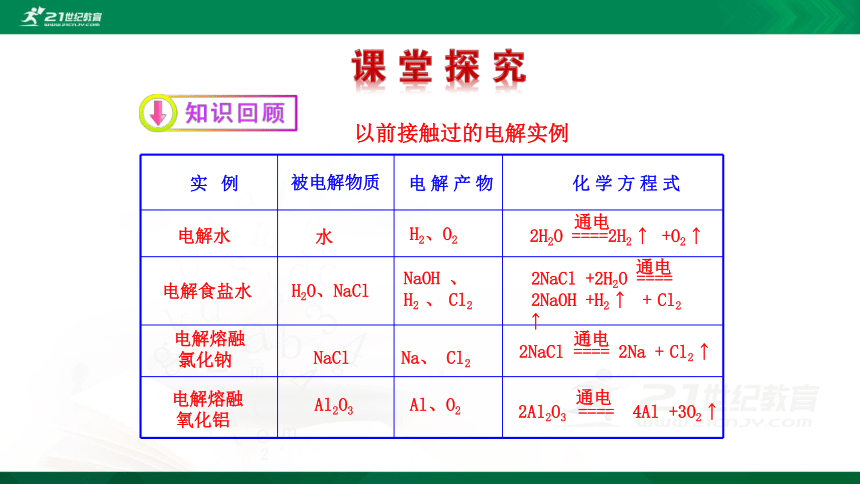
以前接触过的电解实例
实 例 被电解物质 电 解 产 物 化 学 方 程 式
电解水
水
H2、O2
2H2O ====2H2 ? +O2 ?
电解食盐水
H2O、NaCl
NaOH 、
H2 、 Cl2
2NaCl +2H2O ====
2NaOH +H2 ? + Cl2 ?
电解熔融
氯化钠
NaCl
Na、 Cl2
2NaCl ==== 2Na + Cl2 ?
电解熔融
氧化铝
Al2O3
Al、O2
2Al2O3 ==== 4Al +3O2 ?
通电
通电
通电
通电
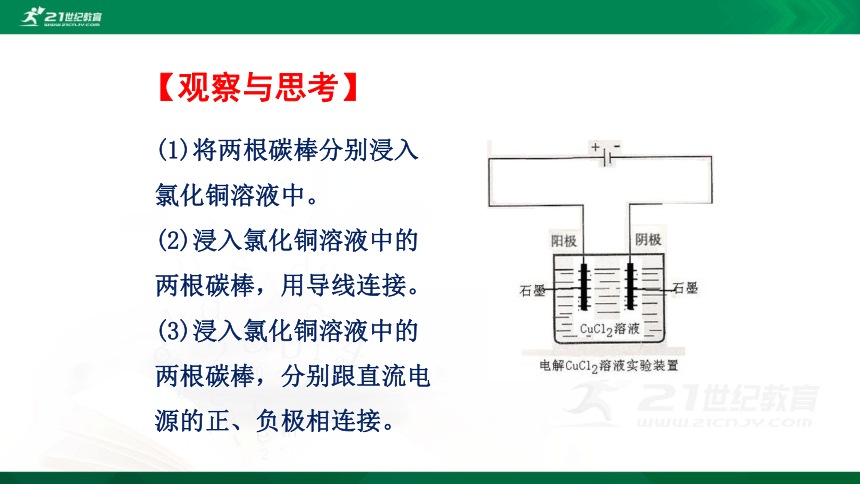
(1)将两根碳棒分别浸入氯化铜溶液中。
(2)浸入氯化铜溶液中的两根碳棒,用导线连接。
(3)浸入氯化铜溶液中的两根碳棒,分别跟直流电源的正、负极相连接。
【观察与思考】
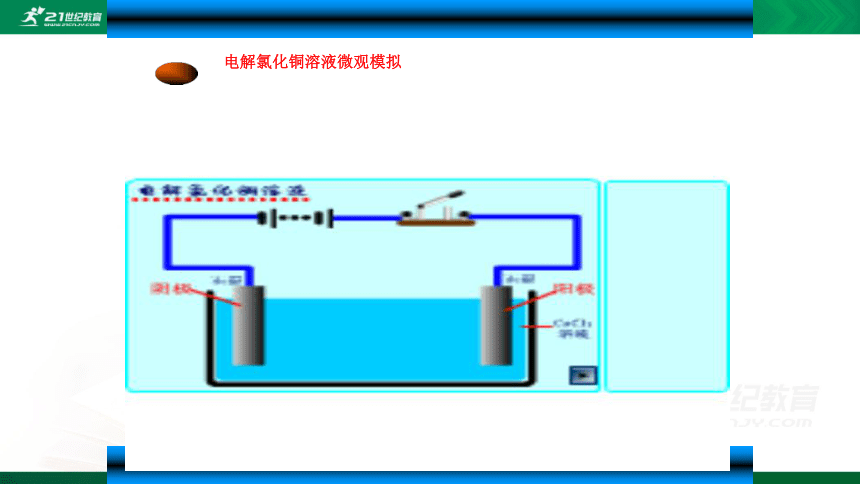
电解氯化铜溶液微观模拟
在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象。
(1)接电源负极的现象为_________________ ,
电极反应为________。
(2)接电源正极的现象为________________ ,
电极反应为________。
(3)电解反应的化学方程式________。
(4)在上述电解反应中,被氧化的物质是____,
被还原的物质是____。
(5)在电解反应中发生的能量转化形式是____________。
有一层紫红色的固体析出
Cu2+ + 2e- = Cu
有气泡产生, 湿润KI-淀粉试纸变蓝
2Cl- - 2e- = Cl2 ?
CuCl2
CuCl2
电能转化为化学能
CuCl2 == Cu + Cl2 ?
通电
一、电解原理及电解池
3.电极名称和电极反应
与电源负极相连的电极叫阴极,阴极上发生还原反应。
与电源正极相连的电极叫阳极,阳极上发生氧化反应。
构成电解池有什么条件?
构成条件: (1)与外加电源相连的两个电极
(2)有电解质溶液 (3)形成闭合回路
1.电解:使电流通过电解质溶液而在阴、阳两极引起
氧化还原反应的过程.
2.电解池:借助于电流引起氧化还原反应的装置,
即把 电能转化为化学能的装置叫电解池或电解槽
阴极:与电源负极相连,
电子流入,发生还原反应
阳极:与电源正极相连,
电子流出,发生氧化反应
4. 电极的判断
e-
e-
C
C
阴极
阳极
电解质溶液
5. 电子、离子的流向
电子从阳极通过电源流向阴极
阳离子在电解质溶液中移向阴极
阴离子在电解质溶液中移向阳极
稀硫酸 稀硫酸 稀硫酸 稀硫酸
A B C D
例题1:
下列装置中属于原电池的是 ( )
属于电解池的是 ( )
B
C D
怎样区分原电池、电解池?
原电池、电解池的区分关键看是否有外接电源;
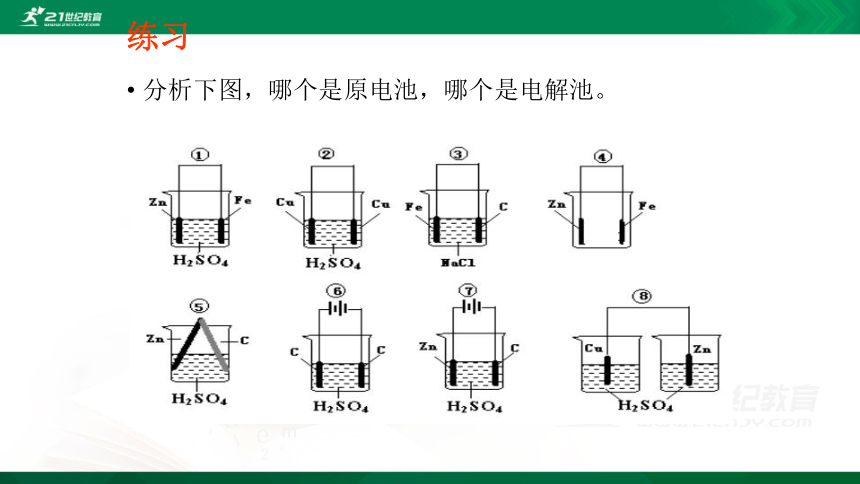
练习
分析下图,哪个是原电池,哪个是电解池。
多池组合判断:
①无外电源:一池为原电池,其余为电解池;
②有外电源:全部为电解池或电镀池、精炼池。
6.电极产物的判断及电极反应的书写(重点)
阳极:先看电极后看溶液
(1) 活泼金属电极:金属电极失电子(除金和铂)
(2) 惰性电极:溶液中阴离子失去电子,
失电子能力为:
S2- >I - >Br - >Cl - >OH - >含氧酸根>F-
阴极: 溶液中阳离子得电子,得电子能力为:
Ag+ > Fe3+ > Cu2+ > H+ (酸)> Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+ (水) > Al3+ > Mg2+ >……
阴极: ___电子,发生____反应,离子 _____越强,反应越容易。
常见阳离子放电顺序:
Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+
阳极:___电子,发生____反应,离子 _____越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F
得
还原
氧化性
失
氧化
还原性
离子放电规律
记
笔
记
分析电解反应的一般思路
溶液中存在的离子
两极上的电极反应
离子的移动方向及放电顺序
判断电解池的阴、阳极
电解Na2SO4溶液的分析
阴极
阳极
氧气
氢
气
阳极: 4OH-- 4e- = 2H2O+O2
实例
电极反应
浓度
PH值
复原
Na2SO4
?
?
?
?
?
阴极: 4H ++ 4e- = 2H2
变大
不
变
加
H2O
2H2O === 2H2 ↑+O2 ↑
通电
如电解H2SO4、HNO3、NaOH、Na2SO4等溶液时其电极反应式为:
阳极 : 4OH--4e-=2H2O +O2↑
阴极: 4H+ +4e-=2H2 ↑
总反应:2H2O== O2↑ +2H2↑
电解
电解后溶液中溶质的质量分数增大,若要恢复原来的浓度,只需加入一定量的水即可。
用惰性电极电解电解质溶液规律
(1)电解水型:
电解CuCl2溶液的分析
阴极
阳极
氯
气
铜
实例
电极反应
浓度
PH值
复原
CuCl2
?
?
?
?
?
CuCl2 Cu+Cl2 ↑
电解
阳极:2Cl--2 e- =Cl2
阴极:Cu2++ 2e-=2Cu
减小
增
大
加
CuCl2
如电解盐酸、CuCl2溶液等
电解后溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量的溶质(通入一定量的HCl气体)
阳极: 2Cl -- 2e-=Cl2↑
阴极: 2H+ +2e-= H2 ↑
总反应:2HCl== Cl2↑ + H2↑
电解
电解盐酸
(2)电解本身:
电解CuSO4溶液的分析
阴极
阳极
氧
气
铜
实例
电极反应
浓度
PH值
复原
CuSO4
?
?
?
?
?
2CuSO4+ 2H2O 2Cu +O2 ↑+ 2H2SO4
电解
阴极:Cu2++ 2e-=Cu
减小
加
CuO
阳极: 4OH-- 4e- = 2H2O+O2
减
小
如电解CuSO4溶液、AgNO3溶液等。
阳极 : 4OH--4e-=2H2O +O2↑
阴极: 2Cu2+ +4e-=2Cu
总反应: 2CuSO4 +2H2O = 2Cu+O2↑ +2H2SO4
电解
电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量金属氧化物。
电解CuSO4溶液
(3)放氧生酸型:
电解NaCl溶液的分析
阴极
阳极
氢
气
氯气
实例
电极反应
浓度
PH值
复原
NaCl
?
?
?
?
?
阳极: 2Cl-- 2e- = Cl 2
阴极: 2H ++ 2e- = H2
2NaCl+2H2O 2NaOH+H2 ↑ + Cl2 ↑
电解
减小
增
大
加
HCl
如电解NaCl、KCl、MgCl2溶液等。
电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需通入一定量的HCl气体。
阳极 (C): 2Cl -- 2e-=Cl2↑
阴极 (C): 2H+ +2e-= H2 ↑
总反应:2NaCl+2H2O==2NaOH+ Cl2↑ + H2↑
电解
(4)放氢生碱型:
1.电解CuC12溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
C
C
2、某小组为研究电化学原理,设计如图装置,
下列叙述错误的是( )
A、a和b不连接时,铁片上会有金属铜析出
B、a和b用导线连接时,铜片上发生的反应为Cu2++2e— == Cu
C、a和b分別连接足够电压的直流电源正、负极时,Cu2+向铜电极移动
D、无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐浙变成浅绿色
2.电解CuC12溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
C
第三单元 化学能与电能的转化
第3课时 电能化学能转化为化学能
第一节课
以前接触过的电解实例
实 例 被电解物质 电 解 产 物 化 学 方 程 式
电解水
水
H2、O2
2H2O ====2H2 ? +O2 ?
电解食盐水
H2O、NaCl
NaOH 、
H2 、 Cl2
2NaCl +2H2O ====
2NaOH +H2 ? + Cl2 ?
电解熔融
氯化钠
NaCl
Na、 Cl2
2NaCl ==== 2Na + Cl2 ?
电解熔融
氧化铝
Al2O3
Al、O2
2Al2O3 ==== 4Al +3O2 ?
通电
通电
通电
通电
(1)将两根碳棒分别浸入氯化铜溶液中。
(2)浸入氯化铜溶液中的两根碳棒,用导线连接。
(3)浸入氯化铜溶液中的两根碳棒,分别跟直流电源的正、负极相连接。
【观察与思考】
电解氯化铜溶液微观模拟
在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象。
(1)接电源负极的现象为_________________ ,
电极反应为________。
(2)接电源正极的现象为________________ ,
电极反应为________。
(3)电解反应的化学方程式________。
(4)在上述电解反应中,被氧化的物质是____,
被还原的物质是____。
(5)在电解反应中发生的能量转化形式是____________。
有一层紫红色的固体析出
Cu2+ + 2e- = Cu
有气泡产生, 湿润KI-淀粉试纸变蓝
2Cl- - 2e- = Cl2 ?
CuCl2
CuCl2
电能转化为化学能
CuCl2 == Cu + Cl2 ?
通电
一、电解原理及电解池
3.电极名称和电极反应
与电源负极相连的电极叫阴极,阴极上发生还原反应。
与电源正极相连的电极叫阳极,阳极上发生氧化反应。
构成电解池有什么条件?
构成条件: (1)与外加电源相连的两个电极
(2)有电解质溶液 (3)形成闭合回路
1.电解:使电流通过电解质溶液而在阴、阳两极引起
氧化还原反应的过程.
2.电解池:借助于电流引起氧化还原反应的装置,
即把 电能转化为化学能的装置叫电解池或电解槽
阴极:与电源负极相连,
电子流入,发生还原反应
阳极:与电源正极相连,
电子流出,发生氧化反应
4. 电极的判断
e-
e-
C
C
阴极
阳极
电解质溶液
5. 电子、离子的流向
电子从阳极通过电源流向阴极
阳离子在电解质溶液中移向阴极
阴离子在电解质溶液中移向阳极
稀硫酸 稀硫酸 稀硫酸 稀硫酸
A B C D
例题1:
下列装置中属于原电池的是 ( )
属于电解池的是 ( )
B
C D
怎样区分原电池、电解池?
原电池、电解池的区分关键看是否有外接电源;
练习
分析下图,哪个是原电池,哪个是电解池。
多池组合判断:
①无外电源:一池为原电池,其余为电解池;
②有外电源:全部为电解池或电镀池、精炼池。
6.电极产物的判断及电极反应的书写(重点)
阳极:先看电极后看溶液
(1) 活泼金属电极:金属电极失电子(除金和铂)
(2) 惰性电极:溶液中阴离子失去电子,
失电子能力为:
S2- >I - >Br - >Cl - >OH - >含氧酸根>F-
阴极: 溶液中阳离子得电子,得电子能力为:
Ag+ > Fe3+ > Cu2+ > H+ (酸)> Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+ (水) > Al3+ > Mg2+ >……
阴极: ___电子,发生____反应,离子 _____越强,反应越容易。
常见阳离子放电顺序:
Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+
阳极:___电子,发生____反应,离子 _____越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F
得
还原
氧化性
失
氧化
还原性
离子放电规律
记
笔
记
分析电解反应的一般思路
溶液中存在的离子
两极上的电极反应
离子的移动方向及放电顺序
判断电解池的阴、阳极
电解Na2SO4溶液的分析
阴极
阳极
氧气
氢
气
阳极: 4OH-- 4e- = 2H2O+O2
实例
电极反应
浓度
PH值
复原
Na2SO4
?
?
?
?
?
阴极: 4H ++ 4e- = 2H2
变大
不
变
加
H2O
2H2O === 2H2 ↑+O2 ↑
通电
如电解H2SO4、HNO3、NaOH、Na2SO4等溶液时其电极反应式为:
阳极 : 4OH--4e-=2H2O +O2↑
阴极: 4H+ +4e-=2H2 ↑
总反应:2H2O== O2↑ +2H2↑
电解
电解后溶液中溶质的质量分数增大,若要恢复原来的浓度,只需加入一定量的水即可。
用惰性电极电解电解质溶液规律
(1)电解水型:
电解CuCl2溶液的分析
阴极
阳极
氯
气
铜
实例
电极反应
浓度
PH值
复原
CuCl2
?
?
?
?
?
CuCl2 Cu+Cl2 ↑
电解
阳极:2Cl--2 e- =Cl2
阴极:Cu2++ 2e-=2Cu
减小
增
大
加
CuCl2
如电解盐酸、CuCl2溶液等
电解后溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量的溶质(通入一定量的HCl气体)
阳极: 2Cl -- 2e-=Cl2↑
阴极: 2H+ +2e-= H2 ↑
总反应:2HCl== Cl2↑ + H2↑
电解
电解盐酸
(2)电解本身:
电解CuSO4溶液的分析
阴极
阳极
氧
气
铜
实例
电极反应
浓度
PH值
复原
CuSO4
?
?
?
?
?
2CuSO4+ 2H2O 2Cu +O2 ↑+ 2H2SO4
电解
阴极:Cu2++ 2e-=Cu
减小
加
CuO
阳极: 4OH-- 4e- = 2H2O+O2
减
小
如电解CuSO4溶液、AgNO3溶液等。
阳极 : 4OH--4e-=2H2O +O2↑
阴极: 2Cu2+ +4e-=2Cu
总反应: 2CuSO4 +2H2O = 2Cu+O2↑ +2H2SO4
电解
电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量金属氧化物。
电解CuSO4溶液
(3)放氧生酸型:
电解NaCl溶液的分析
阴极
阳极
氢
气
氯气
实例
电极反应
浓度
PH值
复原
NaCl
?
?
?
?
?
阳极: 2Cl-- 2e- = Cl 2
阴极: 2H ++ 2e- = H2
2NaCl+2H2O 2NaOH+H2 ↑ + Cl2 ↑
电解
减小
增
大
加
HCl
如电解NaCl、KCl、MgCl2溶液等。
电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需通入一定量的HCl气体。
阳极 (C): 2Cl -- 2e-=Cl2↑
阴极 (C): 2H+ +2e-= H2 ↑
总反应:2NaCl+2H2O==2NaOH+ Cl2↑ + H2↑
电解
(4)放氢生碱型:
1.电解CuC12溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
C
C
2、某小组为研究电化学原理,设计如图装置,
下列叙述错误的是( )
A、a和b不连接时,铁片上会有金属铜析出
B、a和b用导线连接时,铜片上发生的反应为Cu2++2e— == Cu
C、a和b分別连接足够电压的直流电源正、负极时,Cu2+向铜电极移动
D、无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐浙变成浅绿色
2.电解CuC12溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
C
