人教版化学高二选修四 1.1化学反应与能量的变化(1)(共37张PPT)
文档属性
| 名称 | 人教版化学高二选修四 1.1化学反应与能量的变化(1)(共37张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-01 22:25:28 | ||
图片预览








文档简介
(共37张PPT)
高二年级 化学
第一章 第一节
化学反应与能量的变化(1)
火箭推进剂
芯级火箭——液氢液氧
助推器——液氧煤油
高:57 m
重:约879 t
腰围:15.7 m
直径:5 m、3.35 m
近地轨道运载能力:25 t
比冲:单位推进剂的量所产生的冲量。
比冲直接影响飞行器的射程和有效载荷。
比冲决定于发动机的结构设计、工作参数和使用的推进剂。
化学反应在发生物质变化的同时伴随着能量的变化。
化学反应
放热反应
吸热反应
燃烧反应
中和反应
金属与酸或水的反应
多数化合反应
……
多数分解反应
金属氧化物的还原反应
……
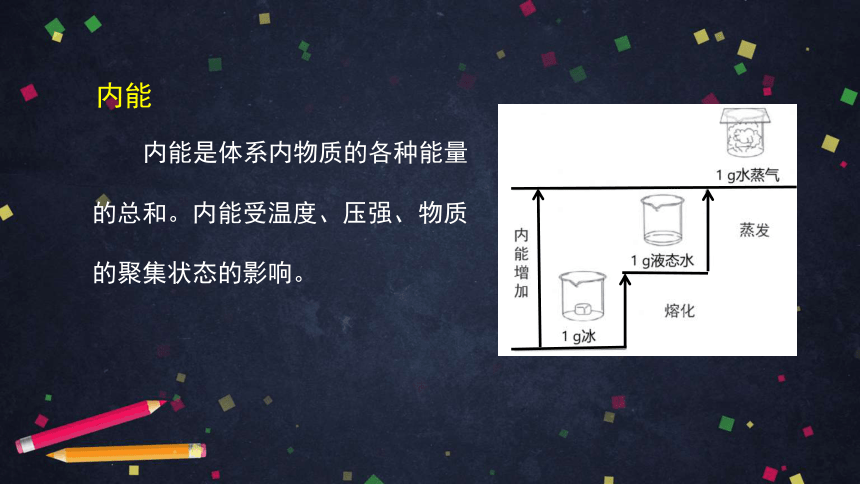
内能
内能是体系内物质的各种能量的总和。内能受温度、压强、物质的聚集状态的影响。
体系与环境
被研究的物质系统称为体系,体系以外的其他部分称为环境。
焓变
焓( H )是与内能有关的物理量,生成物与反应物的焓值差称作焓变( ΔH )。
ΔH = H生成物 - H反应物
ΔH 的单位:kJ/mol(或kJ ? mol-1)
ΔH 表示反应热(恒压条件)
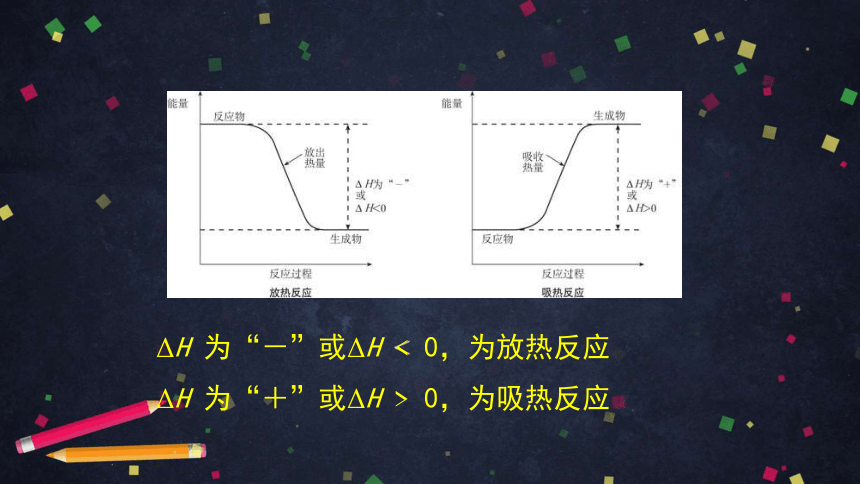
ΔH 为“-”或ΔH < 0,为放热反应
ΔH 为“+”或ΔH > 0,为吸热反应
想一想:反应H2(g) + Cl2(g) 2HCl(g)的ΔH 0(填“>”或“<”),说明你的判断依据:
点燃
<
燃烧都是放热反应
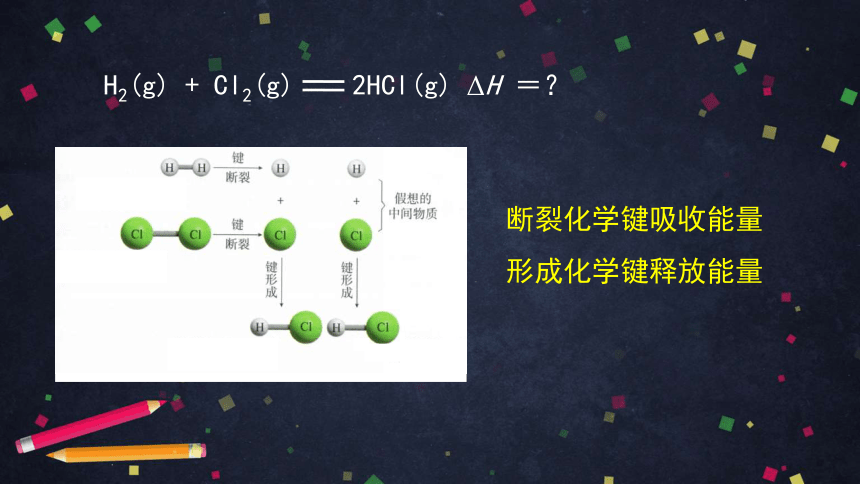
断裂化学键吸收能量
形成化学键释放能量
H2(g) + Cl2(g) 2HCl(g) ΔH =?
吸收:436 kJ+243 kJ=679 kJ
释放:431 kJ/mol×2 mol=862 kJ
ΔH =-183 kJ/mol
436 kJ/mol
能量
243 kJ/mol
能量
431 kJ/mol
能量
431 kJ/mol
能量
H2(g) + Cl2(g) 2HCl(g) ΔH =?
键能:拆开1 mol气态分子为气态原子所需要的能量
模型,非反应的真实过程!
ΔH =∑E反应物键能-∑E生成物键能
H2(g) + Cl2(g) 2HCl(g) ΔH =?
Cl2 Cl + Cl (链的引发) ①
Cl + H2 HCl + H ②
H + Cl2 HCl + Cl ③
……
Cl + Cl Cl2 (链的终止) ④
(链的传递)
H2(g) + Cl2(g) 2HCl(g) ΔH =?
实验测得:ΔH =-184.6 kJ/mol
理论分析:ΔH =-183 kJ/mol
H2(g) + Cl2(g) 2HCl(g) ΔH =?
真实过程 假想过程
反应过程
能量
H2(g)+Cl2(g)
2HCl(g)
反应热
1 mol H2(g)中的H-H键断裂需吸收436 kJ的能量,1 mol O2(g)中的化学键断裂需吸收498 kJ的能量,形成H2O(g)中1 mol H-O键要释放463.4 kJ的能量。计算H2(g)和O2(g)生成1 molH2O(g)的反应热。
H2(g) O2(g) H2O(g)
物质变化 消耗 1 mol 消耗 mol 生成 1 mol
化学键变化 断裂 1 mol 断裂 mol 形成 2 mol
能量变化 吸收
+436 kJ 吸收
+498 kJ/mol× mol 释放
-463.4 kJ/mol× 2 mol
1
2
1
2
1
2
ΔH =∑E反应物键能-∑E生成物键能=-241.8 kJ/mol
H2(g) + Cl2(g) 2HCl(g) ΔH =-183 kJ/mol
H2(g) + O2(g) H2O(g) ΔH =-241.8 kJ/mol
1
2
热化学方程式
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
物质变化
能量变化
状态
条件
化学计量数
符号
数值
单位
物质变化
能量变化
状态
条件
化学计量数
符号
数值
单位
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
必须标注,固体(s)、液体(l)、气体(g)、溶液(aq)
H2(g) + O2(g) H2O(g) ΔH =-241.8 kJ/mol
1
2
I2(g) + H2(g) 2HI(g) ΔH =-9.48 kJ/mol
I2(s) + H2(g) 2HI(g) ΔH =+26.48 kJ/mol
指明反应时的温度和压强,25 ℃、101 kPa可以不注明
物质变化
能量变化
状态
符号
数值
单位
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
条件
化学计量数
不表示分子数,仅表示物质的量,可以是整数,也可以是分数
物质变化
能量变化
状态
符号
数值
单位
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
条件
化学计量数
“+”为吸热反应,“-”为放热反应
物质变化
能量变化
状态
符号
数值
单位
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
条件
化学计量数
数值与化学计量数相对应
H2(g) + O2(g) H2O(g) ΔH =-241.8 kJ/mol
1
2
2H2(g) + O2(g) 2H2O(g) ΔH =-483.6 kJ/mol
物质变化
能量变化
状态
符号
数值
单位
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
条件
化学计量数
mol-1表示每摩尔反应
2H2(g) + O2(g) 2H2O(g) ΔH =-483.6 kJ/mol
物质变化
能量变化
状态
符号
数值
单位
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
条件
化学计量数
H2(g) + O2(g) H2O(g) ΔH =-241.8 kJ/mol
1
2
化学反应与
能量的变化
宏观
微观
符号
体系与环境间热交换
化学键的断裂与形成
热化学方程式
知识清单
放热反应 吸热反应
∑E反应物 > ∑E生成物 ∑E反应物 < ∑E生成物
体系向环境释放热量 体系从环境吸收热量
∑E反应物键能 < ∑E生成物键能 ∑E反应物键能 > ∑E生成物键能
ΔH 为“-”或ΔH < 0 ΔH 为“+”或ΔH > 0
知识清单
想象模型
方法提升
ΔH =∑E反应物键能-∑E生成物键能
符号模型
方法提升
质量
守恒
能量
守恒
表示
热化学
方程式
物质
变化
能量
变化
遵循
遵循
基础
火箭推进剂在燃烧室燃烧,将化学能转换为燃烧产物的热能,这是火箭发动机的第一个能量转换过程。燃烧产物从燃烧室经过喷管高速喷出,将热能转换为射流的动能,在喷管中完成了火箭发动机的第二个能量转换过程。高速气流从喷管中喷出,对飞行器做功,转换为飞行器的飞行动能。
H2(g) + Cl2(g) 2HCl(g) ΔH =-183 kJ/mol
H2(g) + O2(g) H2O(g) ΔH =-241.8 kJ/mol
1
2
单位质量推进剂产生热量: ≈ 2.5 kJ/g
183 kJ
2 g+71 g
单位质量推进剂产生热量: ≈ 13.4 kJ/g
241.8 kJ
2 g+16 g
放热反应都可以作为火箭推进剂反应吗?
第四代推进剂——液氢液氧
反应过程
能量
H2(g)+ O2(g)
H2O(l)
ΔH1 =-285.8 kJ/mol
H2O(g)
H2(l)+ O2(l)
ΔH2
H2(g)和O2(g)反应生成1 mol H2O(l),放出热量285.8 kJ。
1
2
1
2
第三代推进剂——液氧煤油
煤油的重要成分是十二烷(C12H26),1 mol C12H26(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出8 087 kJ热量。写出反应的热化学方程式。
C12H26(l) + O2(g) 12CO2(g) + 13H2O(l)ΔH =-8 087 kJ/mol
37
2
第二代推进剂——肼(H2N-NH2)+氧化剂
请根据示意图写出肼燃烧生成气态N2和气态水的热化学方程式。
N2H4(g) + O2(g) N2(g) + 2H2O(g) ΔH =-534 kJ/mol
已知:断裂1 mol O2(g)中的化学键需要吸收500 kJ的能量,断裂
1 mol N≡N键和1 mol N-N键分别需要吸收942 kJ和154 kJ的能量,判断断裂1 mol N-H键所需的能量 。
391 kJ
500 kJ+154 kJ+4x kJ=2 218 kJ
火药
偏二甲肼
四氧化二氮
液氧煤油
液氢液氧
我国火箭推进剂的发展史
人工降雨用的小火箭。
技术成熟,
价格低廉,
但有剧毒。
无毒,性能高,燃料密度高,火箭直径比较小,技术成熟,价格低廉。
无毒,性能奇高。氢氧发动机技术门槛高。
高二年级 化学
第一章 第一节
化学反应与能量的变化(1)
火箭推进剂
芯级火箭——液氢液氧
助推器——液氧煤油
高:57 m
重:约879 t
腰围:15.7 m
直径:5 m、3.35 m
近地轨道运载能力:25 t
比冲:单位推进剂的量所产生的冲量。
比冲直接影响飞行器的射程和有效载荷。
比冲决定于发动机的结构设计、工作参数和使用的推进剂。
化学反应在发生物质变化的同时伴随着能量的变化。
化学反应
放热反应
吸热反应
燃烧反应
中和反应
金属与酸或水的反应
多数化合反应
……
多数分解反应
金属氧化物的还原反应
……
内能
内能是体系内物质的各种能量的总和。内能受温度、压强、物质的聚集状态的影响。
体系与环境
被研究的物质系统称为体系,体系以外的其他部分称为环境。
焓变
焓( H )是与内能有关的物理量,生成物与反应物的焓值差称作焓变( ΔH )。
ΔH = H生成物 - H反应物
ΔH 的单位:kJ/mol(或kJ ? mol-1)
ΔH 表示反应热(恒压条件)
ΔH 为“-”或ΔH < 0,为放热反应
ΔH 为“+”或ΔH > 0,为吸热反应
想一想:反应H2(g) + Cl2(g) 2HCl(g)的ΔH 0(填“>”或“<”),说明你的判断依据:
点燃
<
燃烧都是放热反应
断裂化学键吸收能量
形成化学键释放能量
H2(g) + Cl2(g) 2HCl(g) ΔH =?
吸收:436 kJ+243 kJ=679 kJ
释放:431 kJ/mol×2 mol=862 kJ
ΔH =-183 kJ/mol
436 kJ/mol
能量
243 kJ/mol
能量
431 kJ/mol
能量
431 kJ/mol
能量
H2(g) + Cl2(g) 2HCl(g) ΔH =?
键能:拆开1 mol气态分子为气态原子所需要的能量
模型,非反应的真实过程!
ΔH =∑E反应物键能-∑E生成物键能
H2(g) + Cl2(g) 2HCl(g) ΔH =?
Cl2 Cl + Cl (链的引发) ①
Cl + H2 HCl + H ②
H + Cl2 HCl + Cl ③
……
Cl + Cl Cl2 (链的终止) ④
(链的传递)
H2(g) + Cl2(g) 2HCl(g) ΔH =?
实验测得:ΔH =-184.6 kJ/mol
理论分析:ΔH =-183 kJ/mol
H2(g) + Cl2(g) 2HCl(g) ΔH =?
真实过程 假想过程
反应过程
能量
H2(g)+Cl2(g)
2HCl(g)
反应热
1 mol H2(g)中的H-H键断裂需吸收436 kJ的能量,1 mol O2(g)中的化学键断裂需吸收498 kJ的能量,形成H2O(g)中1 mol H-O键要释放463.4 kJ的能量。计算H2(g)和O2(g)生成1 molH2O(g)的反应热。
H2(g) O2(g) H2O(g)
物质变化 消耗 1 mol 消耗 mol 生成 1 mol
化学键变化 断裂 1 mol 断裂 mol 形成 2 mol
能量变化 吸收
+436 kJ 吸收
+498 kJ/mol× mol 释放
-463.4 kJ/mol× 2 mol
1
2
1
2
1
2
ΔH =∑E反应物键能-∑E生成物键能=-241.8 kJ/mol
H2(g) + Cl2(g) 2HCl(g) ΔH =-183 kJ/mol
H2(g) + O2(g) H2O(g) ΔH =-241.8 kJ/mol
1
2
热化学方程式
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
物质变化
能量变化
状态
条件
化学计量数
符号
数值
单位
物质变化
能量变化
状态
条件
化学计量数
符号
数值
单位
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
必须标注,固体(s)、液体(l)、气体(g)、溶液(aq)
H2(g) + O2(g) H2O(g) ΔH =-241.8 kJ/mol
1
2
I2(g) + H2(g) 2HI(g) ΔH =-9.48 kJ/mol
I2(s) + H2(g) 2HI(g) ΔH =+26.48 kJ/mol
指明反应时的温度和压强,25 ℃、101 kPa可以不注明
物质变化
能量变化
状态
符号
数值
单位
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
条件
化学计量数
不表示分子数,仅表示物质的量,可以是整数,也可以是分数
物质变化
能量变化
状态
符号
数值
单位
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
条件
化学计量数
“+”为吸热反应,“-”为放热反应
物质变化
能量变化
状态
符号
数值
单位
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
条件
化学计量数
数值与化学计量数相对应
H2(g) + O2(g) H2O(g) ΔH =-241.8 kJ/mol
1
2
2H2(g) + O2(g) 2H2O(g) ΔH =-483.6 kJ/mol
物质变化
能量变化
状态
符号
数值
单位
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
条件
化学计量数
mol-1表示每摩尔反应
2H2(g) + O2(g) 2H2O(g) ΔH =-483.6 kJ/mol
物质变化
能量变化
状态
符号
数值
单位
H2(g) + O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
条件
化学计量数
H2(g) + O2(g) H2O(g) ΔH =-241.8 kJ/mol
1
2
化学反应与
能量的变化
宏观
微观
符号
体系与环境间热交换
化学键的断裂与形成
热化学方程式
知识清单
放热反应 吸热反应
∑E反应物 > ∑E生成物 ∑E反应物 < ∑E生成物
体系向环境释放热量 体系从环境吸收热量
∑E反应物键能 < ∑E生成物键能 ∑E反应物键能 > ∑E生成物键能
ΔH 为“-”或ΔH < 0 ΔH 为“+”或ΔH > 0
知识清单
想象模型
方法提升
ΔH =∑E反应物键能-∑E生成物键能
符号模型
方法提升
质量
守恒
能量
守恒
表示
热化学
方程式
物质
变化
能量
变化
遵循
遵循
基础
火箭推进剂在燃烧室燃烧,将化学能转换为燃烧产物的热能,这是火箭发动机的第一个能量转换过程。燃烧产物从燃烧室经过喷管高速喷出,将热能转换为射流的动能,在喷管中完成了火箭发动机的第二个能量转换过程。高速气流从喷管中喷出,对飞行器做功,转换为飞行器的飞行动能。
H2(g) + Cl2(g) 2HCl(g) ΔH =-183 kJ/mol
H2(g) + O2(g) H2O(g) ΔH =-241.8 kJ/mol
1
2
单位质量推进剂产生热量: ≈ 2.5 kJ/g
183 kJ
2 g+71 g
单位质量推进剂产生热量: ≈ 13.4 kJ/g
241.8 kJ
2 g+16 g
放热反应都可以作为火箭推进剂反应吗?
第四代推进剂——液氢液氧
反应过程
能量
H2(g)+ O2(g)
H2O(l)
ΔH1 =-285.8 kJ/mol
H2O(g)
H2(l)+ O2(l)
ΔH2
H2(g)和O2(g)反应生成1 mol H2O(l),放出热量285.8 kJ。
1
2
1
2
第三代推进剂——液氧煤油
煤油的重要成分是十二烷(C12H26),1 mol C12H26(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出8 087 kJ热量。写出反应的热化学方程式。
C12H26(l) + O2(g) 12CO2(g) + 13H2O(l)ΔH =-8 087 kJ/mol
37
2
第二代推进剂——肼(H2N-NH2)+氧化剂
请根据示意图写出肼燃烧生成气态N2和气态水的热化学方程式。
N2H4(g) + O2(g) N2(g) + 2H2O(g) ΔH =-534 kJ/mol
已知:断裂1 mol O2(g)中的化学键需要吸收500 kJ的能量,断裂
1 mol N≡N键和1 mol N-N键分别需要吸收942 kJ和154 kJ的能量,判断断裂1 mol N-H键所需的能量 。
391 kJ
500 kJ+154 kJ+4x kJ=2 218 kJ
火药
偏二甲肼
四氧化二氮
液氧煤油
液氢液氧
我国火箭推进剂的发展史
人工降雨用的小火箭。
技术成熟,
价格低廉,
但有剧毒。
无毒,性能高,燃料密度高,火箭直径比较小,技术成熟,价格低廉。
无毒,性能奇高。氢氧发动机技术门槛高。
