鲁科版高一化学必修二 1.1 原子结构与元素性质(35张ppt)
文档属性
| 名称 | 鲁科版高一化学必修二 1.1 原子结构与元素性质(35张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-01 22:54:25 | ||
图片预览








文档简介
(共35张PPT)
第一章 第一节
原子结构与元素性质(1)
高一年级 化学
一、原子结构
英国物理学家卢瑟福(1871-1937)
著名原子核物理学之父
1908年,研究放射化学荣获诺贝尔化学奖
1911年,提出卢瑟福原子模型
要考察原子的内部构造,最好的办法是打开它。
α粒子是放射性物质衰变时放射出来的粒子(氦核),带正电荷,速度每秒可达两万公里。
绝大多数α粒子穿过金箔后仍沿原来的方向前进;
有少数α粒子发生了偏转;
极少数偏转超过90°,甚至被反弹回来。
任务1.根据实验,你认为卢瑟福对原子结构能做出哪些推测?
原子中心有一个体积很小、带正电荷的原子核;
原子核集中了原子的全部正电荷和几乎所有的质量;
核外有 “广阔”的运动空间;
带负电的电子在核外绕核旋转。
卢瑟福
核式原子模型
← 直径10-10m →
核心问题1:原子核的内部结构是怎样的?
核心问题2:电子在核外空间的运动状态?
1919年,卢瑟福用α粒子轰击氮原子核,发现了质子。
1932年,查德威克用α粒子轰击铍原子核,发现了中子。
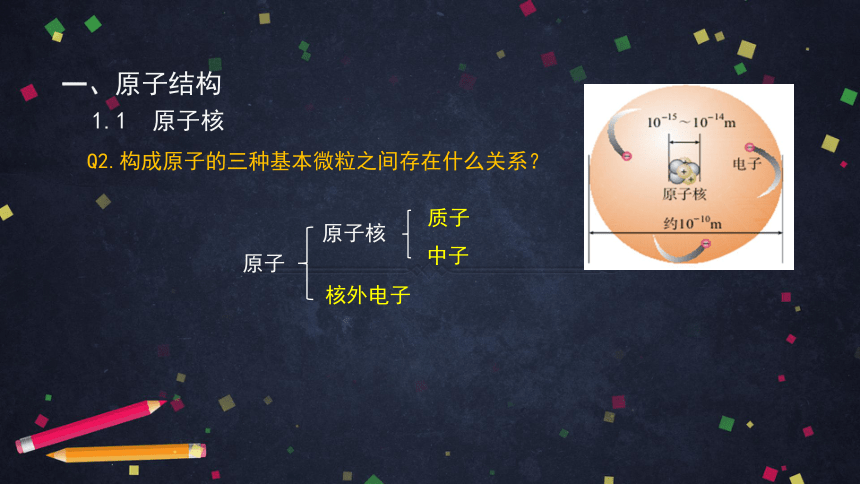
一、原子结构
1.原子核 核素
Q1.原子核是不是最小微粒?
原子
原子核
核外电子
质子
中子
核力
一、原子结构
1.1 原子核
Q2.构成原子的三种基本微粒之间存在什么关系?
原子
原子核
核外电子
质子
中子
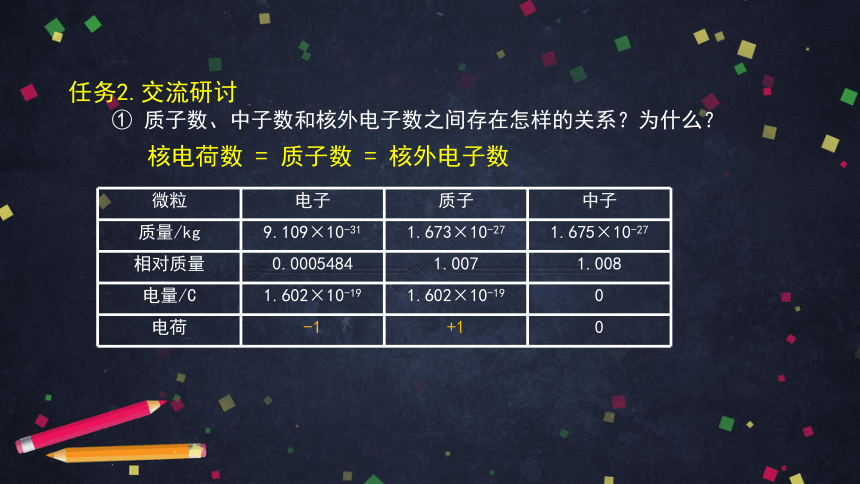
任务2.交流研讨 根据表中数据思考:
① 质子数、中子数和核外电子数之间存在怎样的关系?为什么?
② 原子的质量主要由哪些微粒决定?
③ 如果忽略电子的质量,质子和中子的相对质量分别取近似整数值,
则原子的相对质量在数值上与质子数和中子数有什么关系?
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
任务2.交流研讨
① 质子数、中子数和核外电子数之间存在怎样的关系?为什么?
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
核电荷数 = 质子数 = 核外电子数
任务2.交流研讨
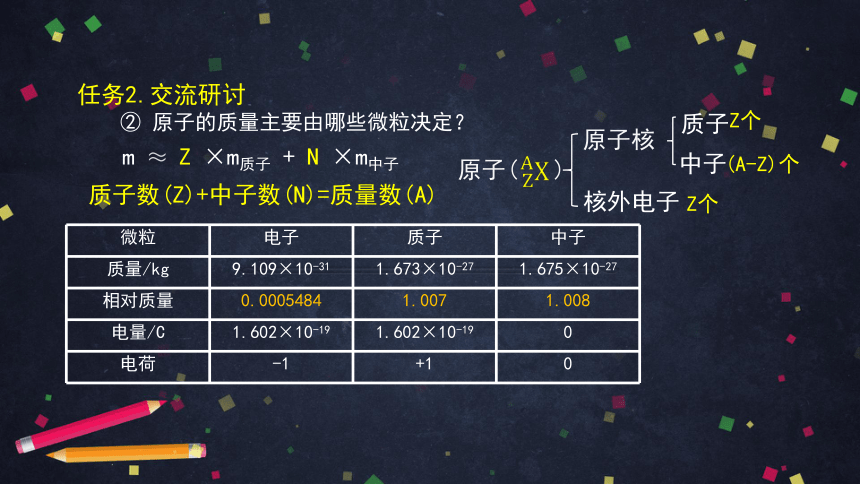
② 原子的质量主要由哪些微粒决定?
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
质子数(Z)+中子数(N)=质量数(A)
原子( )
原子核
核外电子
质子
中子
Z个
(A-Z)个
Z个
m ≈ Z ×m质子 + N ×m中子
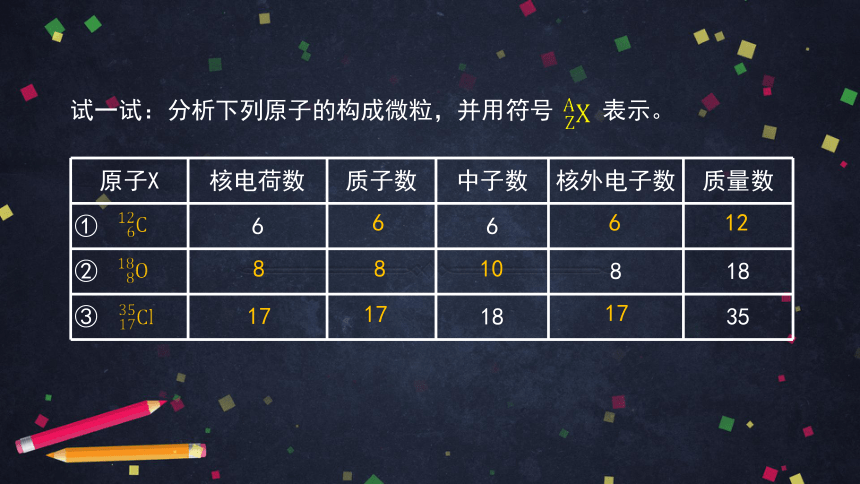
原子X 核电荷数 质子数 中子数 核外电子数 质量数
① 6 6
② 8 18
③ 18 35
6
6
12
8
8
10
17
17
17
试一试:分析下列原子的构成微粒,并用符号 表示。
任务2.交流研讨
③ 如果忽略电子的质量,质子和中子的相对质量分别取近似整数值,则原
子的相对质量在数值上与质子数和中子数有什么关系?
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
相对原子质量=
m原子
=
Z×m质子 + N×m中子+ Z×m电子
m12C/12
≈
Z×m质子 + N×m中子
≈Z + N
= A
6
m12C/12
6
m12C/12
6
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
任务3.观察思考
比较氕、氘、氚三种原子结构有何异同?
如何用符号表示这三种原子?
氕、氘、氚属于同一种元素吗?
元素:具有相同质子数的同一类原子的总称。
原子 质子数 中子数 电子数
氕 H 1 0 1
氘 D 1 1 1
氚 T 1 2 1
氢元素
核素:具有相同数目的质子和相同数目的中子的一类原子。
一、原子结构
1.2 核素
Q1.核素与元素之间的区别与联系。
核素:具有相同数目的质子和相同数目的中子的一类原子。
元素:具有相同质子数的同一类原子的总称。
元素
核素
1
核素
3
核素
2
……
一、原子结构
1.2 核素
元素 核素1 核素2 核素3
碳
氧
氯
铀
质子数相同而中子数不同的同一种元素的不同核素互称同位素。
Q2. 如何表示同一元素的不同种核素之间的关系?
元素
核素
1
核素
3
核素
2
……
同位素
研究发现:天然存在的某元素,不论是游离态还是化合态,各种核素在这种元素的所有核素中所占比例一般为定值。
同位素 相对原子质量 原子个数百分比
34.97 75.77%
36.97 24.23%
资料在线: 了解元素的相对原子质量
氯元素的相对原子质量 =34.97×75.77% + 36.97×24.23%
≈ 35.45
确定磷在植物中的作用部位。
消灭害虫;杂交育种;金属制品探伤;γ刀手术等。
有助于诊断甲状腺器质性疾病。
拓展视野: 你了解放射性同位素吗?
拓展视野:未来的能源——核聚变能
一、原子结构
2. 核外电子排布
Q1:电子在核外空间的运动状态是怎样的?
一、原子结构
2. 核外电子排布
Q1:电子在核外空间的运动状态是怎样的?
核外电子在一定的轨道上绕核运行;
在不同轨道上运动的电子具有不同的能量;
当电子从一个轨道跃迁到另一个轨道时会辐射或吸收一定的能量。
一、原子结构
2. 核外电子排布
多电子原子中,电子分别在能量不同区域运动:
能量低的电子通常在离核较近的区域运动,
能量高的电子通常在离核较远的区域运动,
电子在原子核外离核由近到远,能量由低到高的不同电子层分层排布。
Q1:电子在核外空间的运动状态是怎样的?
电子层模型
电子层模型
n(电子层):1, 2, 3, 4, 5, 6, 7
符号: K、L、M、N、O、P、Q
离核远近:
能量高低:
近
远
高
低
一、原子结构
2. 核外电子排布
Q2:核外电子分层排布规律
电子排布时总是尽先占据能量较低的轨道,然后依次进入能量较高的轨道。
Q3:每一电子层最多容纳多少电子?
2. 核外电子排布
一、原子结构
核电荷数 元素名称 元素符号 各电子层电子数
K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
Q3:每一电子层最多排布多少电子?
2. 核外电子排布
一、原子结构
每个电子层最多容纳2n2个电子
最外层最多不超过8个(K层不超过2个)
次外层最多不超过18个
原子光谱和理论分析结果:
核电
荷数 元素
名称 元素符号 各电子层电子数
K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
Na
+11
2
8
1
电子层
M层电子数
粒子符号
原子核
核内质子数或核电荷数
K
L
M
原子结构示意图的规范表示
任务4:依据规律写出1~20号元素原子结构示意图
K层: 1→2
M层: 1→8
L层: 1→8
单位体积内小黑点的疏密程度表示电子在核外空间某处出现的概率大小。
小黑点越密,电子出现的概率越大;
小黑点越疏,电子出现的概率越小。
拓展视野:了解电子云模型
拓展视野:
回顾原子模型发展史,归纳科学研究的一般思路和方法。
观察
假说
实验
模型(理论)
进一步实验
若实验结果不支持假说,则需要改进假说
若预测结果不符合模型,
则需要改进模型
回顾原子模型发展史,归纳科学研究的一般思路和方法。
应用实践1
下列有关钯原子 的说法错误的是( )
A.核电荷数为46 B.质子数为46
C.电子数为46 D.中子数为46
D
医学界通过用放射性14C标记,发现C60的羧酸衍生物在特定条件下可断裂DNA杀死细胞,抑制艾滋病。关于14C的下列说法中正确的是( )
A.14C原子与12C原子的化学性质不同
B.14C原子与14N原子所含中子数相同
C.14C是C60的同素异形体
D.14C与12C、13C是碳元素的三种核素
D
同素异形体:同种元素形成的不同单质。例如:氧气O2和臭氧O3 、金刚石和石墨、红磷和白磷等。
应用实践2
有aXn+和bYm-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
A.b-a=n+m B.a-b=n-m
C.核电荷数b<a D.质子数b>a
C
a-n
应用实践3
= b+m
已知R2+核内有N个中子,质量数为A,则m g R2+中含有电子的物质的量为 mol
应用实践4
解析:
R2+核内有N个中子,质量数为A,质子数(A-N),阳离子的电子数(A-N-2)
R2+物质的量为m/A mol ,所以电子的物质的量为 m(A-N-2)/A mol 。
m(A-N-2)/A
第一章 第一节
原子结构与元素性质(1)
高一年级 化学
一、原子结构
英国物理学家卢瑟福(1871-1937)
著名原子核物理学之父
1908年,研究放射化学荣获诺贝尔化学奖
1911年,提出卢瑟福原子模型
要考察原子的内部构造,最好的办法是打开它。
α粒子是放射性物质衰变时放射出来的粒子(氦核),带正电荷,速度每秒可达两万公里。
绝大多数α粒子穿过金箔后仍沿原来的方向前进;
有少数α粒子发生了偏转;
极少数偏转超过90°,甚至被反弹回来。
任务1.根据实验,你认为卢瑟福对原子结构能做出哪些推测?
原子中心有一个体积很小、带正电荷的原子核;
原子核集中了原子的全部正电荷和几乎所有的质量;
核外有 “广阔”的运动空间;
带负电的电子在核外绕核旋转。
卢瑟福
核式原子模型
← 直径10-10m →
核心问题1:原子核的内部结构是怎样的?
核心问题2:电子在核外空间的运动状态?
1919年,卢瑟福用α粒子轰击氮原子核,发现了质子。
1932年,查德威克用α粒子轰击铍原子核,发现了中子。
一、原子结构
1.原子核 核素
Q1.原子核是不是最小微粒?
原子
原子核
核外电子
质子
中子
核力
一、原子结构
1.1 原子核
Q2.构成原子的三种基本微粒之间存在什么关系?
原子
原子核
核外电子
质子
中子
任务2.交流研讨 根据表中数据思考:
① 质子数、中子数和核外电子数之间存在怎样的关系?为什么?
② 原子的质量主要由哪些微粒决定?
③ 如果忽略电子的质量,质子和中子的相对质量分别取近似整数值,
则原子的相对质量在数值上与质子数和中子数有什么关系?
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
任务2.交流研讨
① 质子数、中子数和核外电子数之间存在怎样的关系?为什么?
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
核电荷数 = 质子数 = 核外电子数
任务2.交流研讨
② 原子的质量主要由哪些微粒决定?
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
质子数(Z)+中子数(N)=质量数(A)
原子( )
原子核
核外电子
质子
中子
Z个
(A-Z)个
Z个
m ≈ Z ×m质子 + N ×m中子
原子X 核电荷数 质子数 中子数 核外电子数 质量数
① 6 6
② 8 18
③ 18 35
6
6
12
8
8
10
17
17
17
试一试:分析下列原子的构成微粒,并用符号 表示。
任务2.交流研讨
③ 如果忽略电子的质量,质子和中子的相对质量分别取近似整数值,则原
子的相对质量在数值上与质子数和中子数有什么关系?
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
相对原子质量=
m原子
=
Z×m质子 + N×m中子+ Z×m电子
m12C/12
≈
Z×m质子 + N×m中子
≈Z + N
= A
6
m12C/12
6
m12C/12
6
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
任务3.观察思考
比较氕、氘、氚三种原子结构有何异同?
如何用符号表示这三种原子?
氕、氘、氚属于同一种元素吗?
元素:具有相同质子数的同一类原子的总称。
原子 质子数 中子数 电子数
氕 H 1 0 1
氘 D 1 1 1
氚 T 1 2 1
氢元素
核素:具有相同数目的质子和相同数目的中子的一类原子。
一、原子结构
1.2 核素
Q1.核素与元素之间的区别与联系。
核素:具有相同数目的质子和相同数目的中子的一类原子。
元素:具有相同质子数的同一类原子的总称。
元素
核素
1
核素
3
核素
2
……
一、原子结构
1.2 核素
元素 核素1 核素2 核素3
碳
氧
氯
铀
质子数相同而中子数不同的同一种元素的不同核素互称同位素。
Q2. 如何表示同一元素的不同种核素之间的关系?
元素
核素
1
核素
3
核素
2
……
同位素
研究发现:天然存在的某元素,不论是游离态还是化合态,各种核素在这种元素的所有核素中所占比例一般为定值。
同位素 相对原子质量 原子个数百分比
34.97 75.77%
36.97 24.23%
资料在线: 了解元素的相对原子质量
氯元素的相对原子质量 =34.97×75.77% + 36.97×24.23%
≈ 35.45
确定磷在植物中的作用部位。
消灭害虫;杂交育种;金属制品探伤;γ刀手术等。
有助于诊断甲状腺器质性疾病。
拓展视野: 你了解放射性同位素吗?
拓展视野:未来的能源——核聚变能
一、原子结构
2. 核外电子排布
Q1:电子在核外空间的运动状态是怎样的?
一、原子结构
2. 核外电子排布
Q1:电子在核外空间的运动状态是怎样的?
核外电子在一定的轨道上绕核运行;
在不同轨道上运动的电子具有不同的能量;
当电子从一个轨道跃迁到另一个轨道时会辐射或吸收一定的能量。
一、原子结构
2. 核外电子排布
多电子原子中,电子分别在能量不同区域运动:
能量低的电子通常在离核较近的区域运动,
能量高的电子通常在离核较远的区域运动,
电子在原子核外离核由近到远,能量由低到高的不同电子层分层排布。
Q1:电子在核外空间的运动状态是怎样的?
电子层模型
电子层模型
n(电子层):1, 2, 3, 4, 5, 6, 7
符号: K、L、M、N、O、P、Q
离核远近:
能量高低:
近
远
高
低
一、原子结构
2. 核外电子排布
Q2:核外电子分层排布规律
电子排布时总是尽先占据能量较低的轨道,然后依次进入能量较高的轨道。
Q3:每一电子层最多容纳多少电子?
2. 核外电子排布
一、原子结构
核电荷数 元素名称 元素符号 各电子层电子数
K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
Q3:每一电子层最多排布多少电子?
2. 核外电子排布
一、原子结构
每个电子层最多容纳2n2个电子
最外层最多不超过8个(K层不超过2个)
次外层最多不超过18个
原子光谱和理论分析结果:
核电
荷数 元素
名称 元素符号 各电子层电子数
K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
Na
+11
2
8
1
电子层
M层电子数
粒子符号
原子核
核内质子数或核电荷数
K
L
M
原子结构示意图的规范表示
任务4:依据规律写出1~20号元素原子结构示意图
K层: 1→2
M层: 1→8
L层: 1→8
单位体积内小黑点的疏密程度表示电子在核外空间某处出现的概率大小。
小黑点越密,电子出现的概率越大;
小黑点越疏,电子出现的概率越小。
拓展视野:了解电子云模型
拓展视野:
回顾原子模型发展史,归纳科学研究的一般思路和方法。
观察
假说
实验
模型(理论)
进一步实验
若实验结果不支持假说,则需要改进假说
若预测结果不符合模型,
则需要改进模型
回顾原子模型发展史,归纳科学研究的一般思路和方法。
应用实践1
下列有关钯原子 的说法错误的是( )
A.核电荷数为46 B.质子数为46
C.电子数为46 D.中子数为46
D
医学界通过用放射性14C标记,发现C60的羧酸衍生物在特定条件下可断裂DNA杀死细胞,抑制艾滋病。关于14C的下列说法中正确的是( )
A.14C原子与12C原子的化学性质不同
B.14C原子与14N原子所含中子数相同
C.14C是C60的同素异形体
D.14C与12C、13C是碳元素的三种核素
D
同素异形体:同种元素形成的不同单质。例如:氧气O2和臭氧O3 、金刚石和石墨、红磷和白磷等。
应用实践2
有aXn+和bYm-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
A.b-a=n+m B.a-b=n-m
C.核电荷数b<a D.质子数b>a
C
a-n
应用实践3
= b+m
已知R2+核内有N个中子,质量数为A,则m g R2+中含有电子的物质的量为 mol
应用实践4
解析:
R2+核内有N个中子,质量数为A,质子数(A-N),阳离子的电子数(A-N-2)
R2+物质的量为m/A mol ,所以电子的物质的量为 m(A-N-2)/A mol 。
m(A-N-2)/A
