人教版高一化学必修2第3章第2节来自石油和煤的两种基本化工原料(共25张PPT)
文档属性
| 名称 | 人教版高一化学必修2第3章第2节来自石油和煤的两种基本化工原料(共25张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-02 11:42:29 | ||
图片预览




文档简介
(共25张PPT)
3.2.2《苯》
第三章 有机化合物 第二节《来自石油和煤的两种基本化工原料 》 第2课时
19世纪,欧洲许多国家都使用煤气照明。煤气通常是压缩在桶里贮运的,人们发现这种桶里总有一种油状液体,但长时间无人问津。英国科学家法拉第对这种液体产生浓厚的兴趣,他花了整整五年时间提取这种液体,从中得到了苯:一种无色油状液体。
苯的发现史
·
探
1.苯的物理性质
(色、态、味、密度、熔点、沸点、溶解性、特性)
(1).无色,有特殊芳香气味的液体
(2).密度小于水(不溶于水)
(3).易溶有机溶剂
(4).熔点5.5℃, 沸点80.1℃
(5).易挥发(密封保存)
(6).苯蒸气有毒
1.苯的物理性质
……
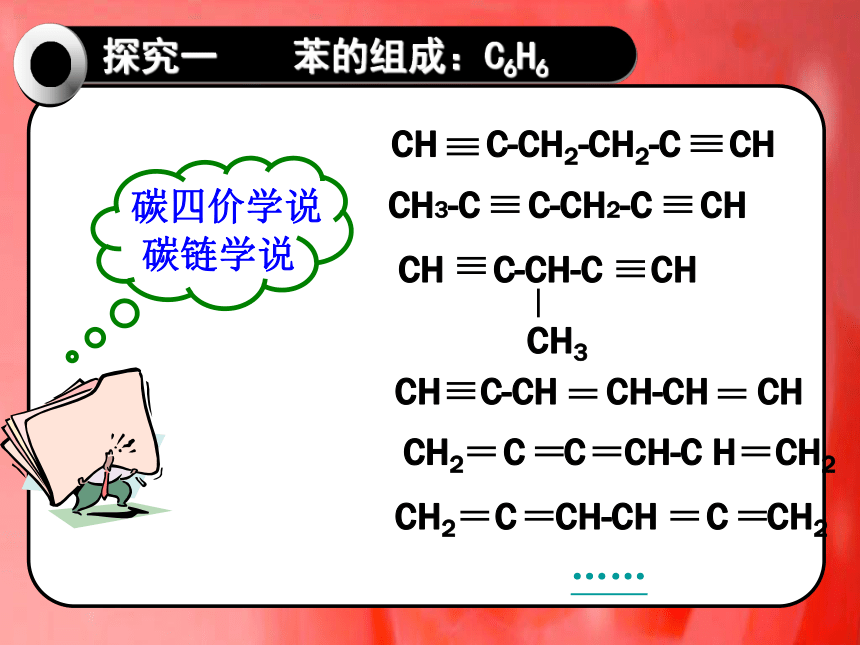
苯的组成:C6H6
碳四价学说
碳链学说
探究一
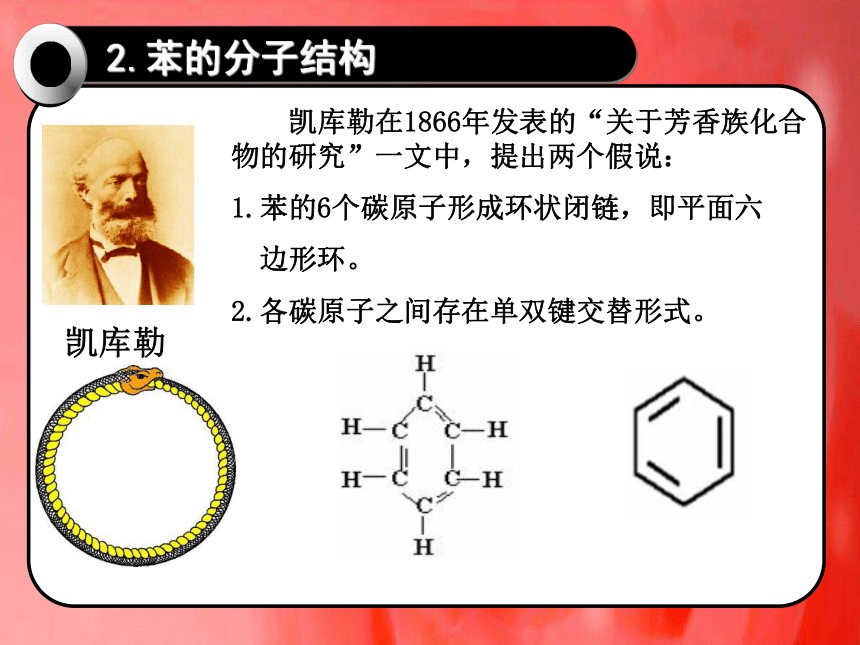
2.苯的分子结构
凯库勒在1866年发表的“关于芳香族化合物的研究”一文中,提出两个假说:
1.苯的6个碳原子形成环状闭链,即平面六
边形环。
2.各碳原子之间存在单双键交替形式。
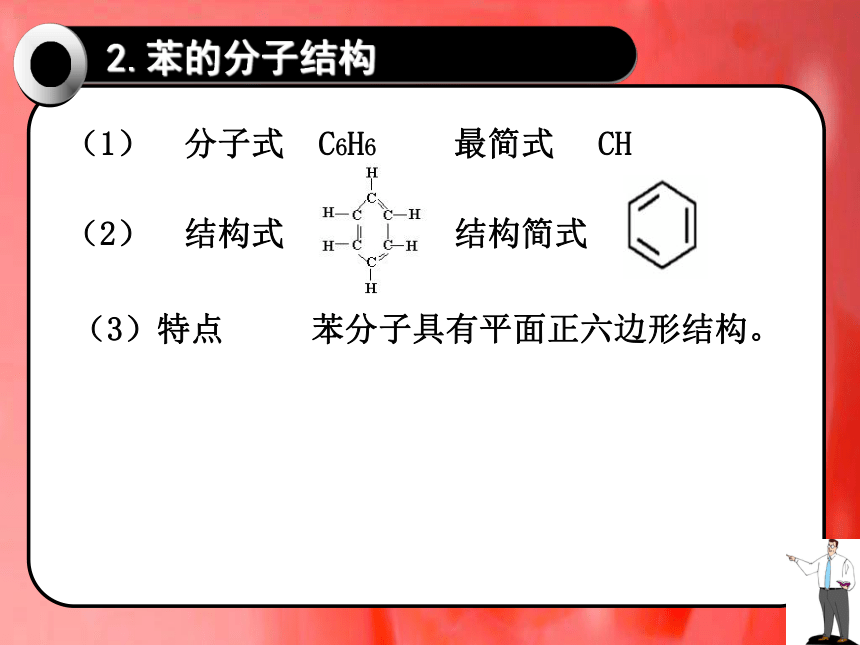
(3)特点 苯分子具有平面正六边形结构。
(1) 分子式 C6H6 最简式 CH
2.苯的分子结构
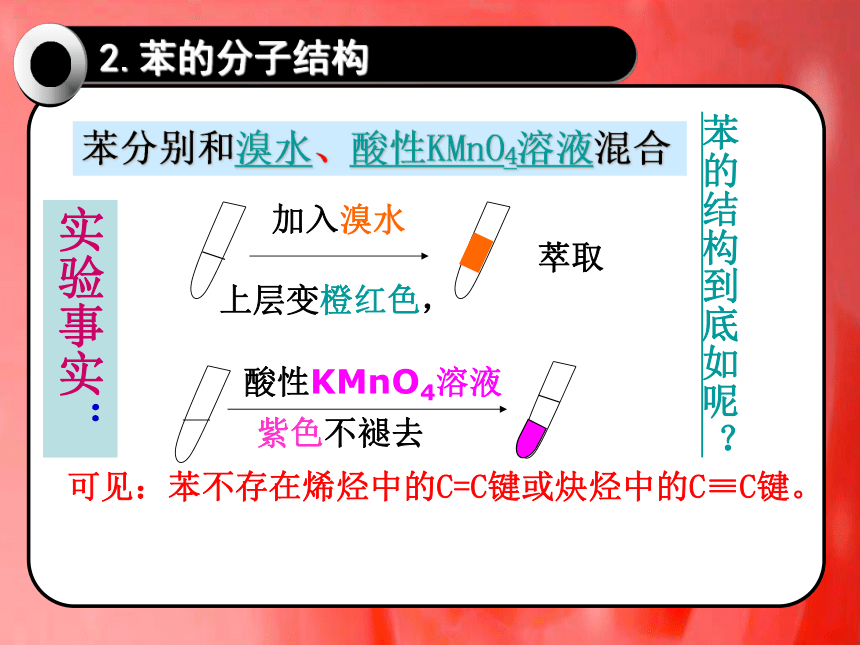
加入溴水
上层变橙红色,
酸性KMnO4溶液
紫色不褪去
可见:苯不存在烯烃中的C=C键或炔烃中的C≡C键。
苯的结构到底如呢?
苯分别和溴水、酸性KMnO4溶液混合
实验事实:
萃取
2.苯的分子结构
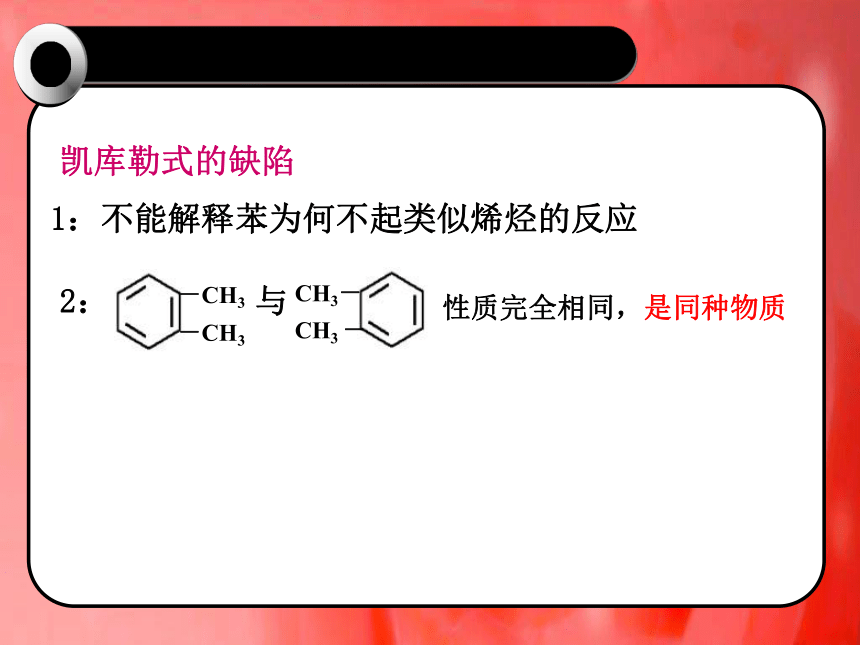
1:不能解释苯为何不起类似烯烃的反应
凯库勒式的缺陷
性质完全相同,是同种物质
现代科学技术用显微镜拍摄的苯分子结构:
比例模型
球棍模型
现代科学技术证明苯具有平面正六边形的结构。 苯环上不是由碳碳单键和双键交替构成,苯环上的碳碳键是介于单键和双键之间的独特的键。
C-C
1.54×10-10m
C=C
1.33×10-10m
2.苯的分子结构
通常情况下,苯的性质比较稳定。在一定条件下,苯可发生以下反应:
A、取代反应:
3.苯的化学性质:
溴苯
反应条件:纯溴、催化剂
①卤代
苯与溴的反应
3.苯的化学性质:
?为什么实验加入的是Fe单质
?实验中长导管的作用
?如何证明反应为取代反应而不是加成反应
④对反应后的溴苯如何进行提纯
3.苯的化学性质:
?2Fe+3Br2=FeBr3
?长导管作用:冷凝回流,导气
?先加AgNO3溶液生成不溶于稀HNO3的淡黄色沉淀,再加入镁粉,产生H2,证明含有HBr
3.苯的化学性质:
④除杂步骤: a.水洗(FeBr3,部分HBr)
b.碱洗(Br2,残余HBr)
c.水洗(NaOH,NaBr,NaBrO)
d.干燥(H2O)
f.蒸馏(苯)
3.苯的化学性质:
现象:导管口有白雾,锥形瓶中滴入AgNO3溶液,出现浅黄色沉淀;烧瓶中液体倒入盛有水的烧杯中,烧杯底部出现油状的褐色液体。
①溴水不与苯发生反应
②溴苯是不溶于水,密度比水大的无色,油状液体,能溶解溴,溴苯溶解了溴时呈褐色。
注意:
3.苯的化学性质:
②硝化 (苯分子中的H原子被硝基取代的反应)
硝基苯:苦杏仁味的无色油状液体,不溶于水,密度比水大,有毒,是制造染料的重要原料。
3.苯的化学性质:
B、氧化反应
现象:
明亮的火焰、浓烟
(含碳量高)
苯易燃烧,但很难被酸性高锰酸钾氧化,在一般情况下不能使酸性高锰酸钾溶液褪色
C、苯的加成反应:
注意:苯不能与溴水发生加成反应(但能萃取溴
而使水层褪色),说明它比烯烃、炔烃难
进行加成反应。
总结:
苯的特殊结构
苯的特殊性质
饱和烃
不饱和烃
取代反应
加成反应
2.易取代,难加成。
苯的化学性质(较稳定):
1、难氧化(但可燃);
4.苯用途:
合成纤维、合成橡胶、塑料、农药、医药、染料、香料等。苯也常用于有机溶剂
1.(双选)通过化学反应能使溴水褪色,且能使高锰酸钾酸性溶液褪色的是( )
A.苯 B.乙烷
C.乙烯 D.二氧化硫
C、D
2、下列关于苯分子结构的说法中,错误的是(? )
A、各原子均位于同一平面上,6个碳原子彼此连接成为一个平面正六边形的结构。
B、苯环中含有3个C-C单键,3个C=C双键
C、苯环中碳碳键的键长介于C-C和C=C之间
D、苯分子中各个键角都为120o
3、能够证明苯分子中不存在碳碳单、双键交替排布的事实是( )
A、苯的一溴代物没有同分异构体
B、苯的邻位二溴代物只有一种
C、苯的对位二溴代物只有一种
D、苯的间位二溴代物只有一种
B
3.2.2《苯》
第三章 有机化合物 第二节《来自石油和煤的两种基本化工原料 》 第2课时
19世纪,欧洲许多国家都使用煤气照明。煤气通常是压缩在桶里贮运的,人们发现这种桶里总有一种油状液体,但长时间无人问津。英国科学家法拉第对这种液体产生浓厚的兴趣,他花了整整五年时间提取这种液体,从中得到了苯:一种无色油状液体。
苯的发现史
·
探
1.苯的物理性质
(色、态、味、密度、熔点、沸点、溶解性、特性)
(1).无色,有特殊芳香气味的液体
(2).密度小于水(不溶于水)
(3).易溶有机溶剂
(4).熔点5.5℃, 沸点80.1℃
(5).易挥发(密封保存)
(6).苯蒸气有毒
1.苯的物理性质
……
苯的组成:C6H6
碳四价学说
碳链学说
探究一
2.苯的分子结构
凯库勒在1866年发表的“关于芳香族化合物的研究”一文中,提出两个假说:
1.苯的6个碳原子形成环状闭链,即平面六
边形环。
2.各碳原子之间存在单双键交替形式。
(3)特点 苯分子具有平面正六边形结构。
(1) 分子式 C6H6 最简式 CH
2.苯的分子结构
加入溴水
上层变橙红色,
酸性KMnO4溶液
紫色不褪去
可见:苯不存在烯烃中的C=C键或炔烃中的C≡C键。
苯的结构到底如呢?
苯分别和溴水、酸性KMnO4溶液混合
实验事实:
萃取
2.苯的分子结构
1:不能解释苯为何不起类似烯烃的反应
凯库勒式的缺陷
性质完全相同,是同种物质
现代科学技术用显微镜拍摄的苯分子结构:
比例模型
球棍模型
现代科学技术证明苯具有平面正六边形的结构。 苯环上不是由碳碳单键和双键交替构成,苯环上的碳碳键是介于单键和双键之间的独特的键。
C-C
1.54×10-10m
C=C
1.33×10-10m
2.苯的分子结构
通常情况下,苯的性质比较稳定。在一定条件下,苯可发生以下反应:
A、取代反应:
3.苯的化学性质:
溴苯
反应条件:纯溴、催化剂
①卤代
苯与溴的反应
3.苯的化学性质:
?为什么实验加入的是Fe单质
?实验中长导管的作用
?如何证明反应为取代反应而不是加成反应
④对反应后的溴苯如何进行提纯
3.苯的化学性质:
?2Fe+3Br2=FeBr3
?长导管作用:冷凝回流,导气
?先加AgNO3溶液生成不溶于稀HNO3的淡黄色沉淀,再加入镁粉,产生H2,证明含有HBr
3.苯的化学性质:
④除杂步骤: a.水洗(FeBr3,部分HBr)
b.碱洗(Br2,残余HBr)
c.水洗(NaOH,NaBr,NaBrO)
d.干燥(H2O)
f.蒸馏(苯)
3.苯的化学性质:
现象:导管口有白雾,锥形瓶中滴入AgNO3溶液,出现浅黄色沉淀;烧瓶中液体倒入盛有水的烧杯中,烧杯底部出现油状的褐色液体。
①溴水不与苯发生反应
②溴苯是不溶于水,密度比水大的无色,油状液体,能溶解溴,溴苯溶解了溴时呈褐色。
注意:
3.苯的化学性质:
②硝化 (苯分子中的H原子被硝基取代的反应)
硝基苯:苦杏仁味的无色油状液体,不溶于水,密度比水大,有毒,是制造染料的重要原料。
3.苯的化学性质:
B、氧化反应
现象:
明亮的火焰、浓烟
(含碳量高)
苯易燃烧,但很难被酸性高锰酸钾氧化,在一般情况下不能使酸性高锰酸钾溶液褪色
C、苯的加成反应:
注意:苯不能与溴水发生加成反应(但能萃取溴
而使水层褪色),说明它比烯烃、炔烃难
进行加成反应。
总结:
苯的特殊结构
苯的特殊性质
饱和烃
不饱和烃
取代反应
加成反应
2.易取代,难加成。
苯的化学性质(较稳定):
1、难氧化(但可燃);
4.苯用途:
合成纤维、合成橡胶、塑料、农药、医药、染料、香料等。苯也常用于有机溶剂
1.(双选)通过化学反应能使溴水褪色,且能使高锰酸钾酸性溶液褪色的是( )
A.苯 B.乙烷
C.乙烯 D.二氧化硫
C、D
2、下列关于苯分子结构的说法中,错误的是(? )
A、各原子均位于同一平面上,6个碳原子彼此连接成为一个平面正六边形的结构。
B、苯环中含有3个C-C单键,3个C=C双键
C、苯环中碳碳键的键长介于C-C和C=C之间
D、苯分子中各个键角都为120o
3、能够证明苯分子中不存在碳碳单、双键交替排布的事实是( )
A、苯的一溴代物没有同分异构体
B、苯的邻位二溴代物只有一种
C、苯的对位二溴代物只有一种
D、苯的间位二溴代物只有一种
B
