人教版高二化学选修5 第一章复习(47张ppt)
文档属性
| 名称 | 人教版高二化学选修5 第一章复习(47张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-04 00:00:00 | ||
图片预览








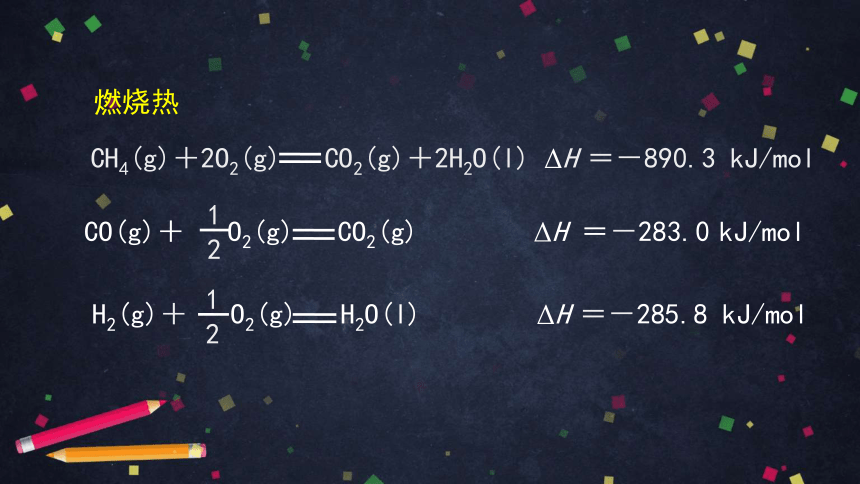

文档简介
(共47张PPT)
第一章复习
高二年级 化学
我们应该从哪些角度去选择燃料呢?
物质的燃烧热
开采、运输、储存条件
对生态环境的影响
......
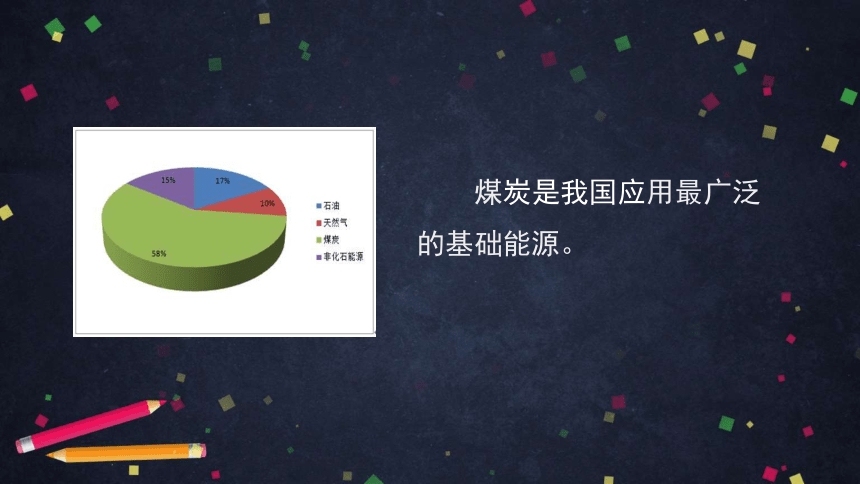
煤炭是我国应用最广泛的基础能源。
通过煤的干馏和煤的气化可以获得以 CO、H2 为主要成分的管道煤气。
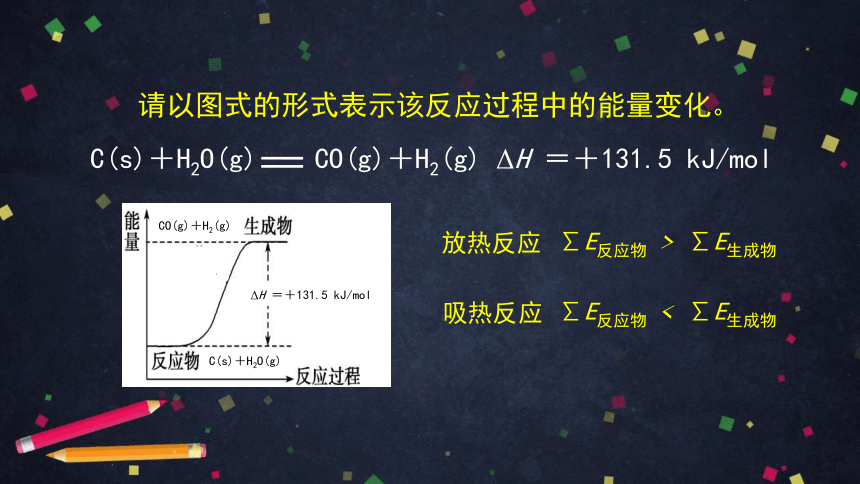
已知,1 mol C(s)与适量 H2O(g) 反应生成 CO(g) 和 H2(g),吸收 131.5 kJ 的能量。
请写出该反应的热化学方程式。
C(s)+H2O(g) CO(g)+H2(g) ΔH =+131.5 kJ/mol
热化学方程式
化学反应中能量变化的表达
请以图式的形式表示该反应过程中的能量变化。
放热反应
∑E反应物 > ∑E生成物
吸热反应
∑E反应物 < ∑E生成物
CO(g)+H2(g)
C(s)+H2O(g)
ΔH =+131.5 kJ/mol
C(s)+H2O(g) CO(g)+H2(g) ΔH =+131.5 kJ/mol
清洁
热量
现今天然气主要作为家用燃料的原因是什么呢?
25 ℃、101 kPa,一些物质的燃烧热
名称 化学式 ΔH /(kJ·mol-1)
甲烷 CH4(g) -890.3
一氧化碳 CO(g) -283.0
氢气 H2(g) -285.8
请根据燃烧热的定义和表格中的数据,判断下面呈现的热化学方程式是否正确?
H2(g)+ O2(g) H2O(g) ΔH =-285.8 kJ/mol
1
2
2CO(g)+O2(g) 2CO2(g) ΔH =-283.0 kJ/mol
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH =-890.3 kJ/mol
燃烧热是指在 101 kPa 时,1 mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量。
燃烧热
2CO(g)+O2(g) 2CO2(g) ΔH =-283.0 kJ/mol
H2(g)+ O2(g) H2O(g) ΔH =-285.8 kJ/mol
1
2
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH =-890.3 kJ/mol
燃烧热
H2(g)+ O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
燃烧热
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH =-890.3 kJ/mol
CO(g)+ O2(g) CO2(g) ΔH =-283.0 kJ/mol
1
2
燃烧热
在家中烧开 1 L 水需要用多少升标准状况下的甲烷呢?
Q =c·m·Δt
4.18 J/ ( g·℃ )
1 L 水的质量是 1 000 g
25℃ 升高到 100 ℃
Q =c·m·Δt =4.18 J/( g·℃ )×1 000 g × 75 ℃ = 3.135×105 J
CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH =-802.3 kJ/mol
22.4 L
V
802.3 kJ
313.5 kJ
=
22.4 L
V L
802.3 kJ
313.5 kJ
V =8.753 L
Q =c·m·Δt =4.18 J/( g·℃ )×1 000 g × 75 ℃ = 3.135×105 J
我国是煤炭能源消费大国,若能以煤为原料生产出更加清洁、热值更高的甲烷将会进一步提升能源利用率。
科研人员尝试以煤干馏后获得的焦炉气(主要成分为 CO、H2)合成甲烷。
CO+3H2 CH4+H2O
如何获知这个化学反应的反应热呢?
键能估算
盖斯定律
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =?
若利用键能数据对该反应的反应热进行估算,你需要哪些键能数值?
反应热的计算
键能估算
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =?
反应热与反应物、生成物的键能存在怎样的关系呢?
∑E反应物键能 < ∑E生成物键能
放热反应
∑E反应物键能 > ∑E生成物键能
吸热反应
反应热的计算
键能估算
化学键 H-H C O O-H C-H
E/(kJ/mol) 436 1 076 465 413
吸收:1 076 kJ+3 mol×436 kJ/mol=2 384 kJ
释放:4 mol×413 kJ/mol+2 mol×465 kJ/mol=2 582 kJ
ΔH =∑E反应物键能-∑E生成物键能
反应热的计算
键能估算
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =?
化学键 H-H C O O-H C-H
E/(kJ/mol) 436 1 076 465 413
反应热的计算
键能估算
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =-198 kJ/mol
盖斯定律
反应热的计算
已知下列反应的反应热
① CO(g)+ O2(g) CO2(g) ΔH1 =-283.0 kJ/mol
1
2
② H2(g)+ O2(g) H2O(g) ΔH2 =-241.8 kJ/mol
1
2
③ CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH3 =-802.3 kJ/mol
试求出 CO(g)+3H2(g) CH4(g)+H2O(g)
的 ΔH =?
盖斯定律
反应热的计算
① CO(g)+ O2(g) CO2(g) ΔH1 =-283.0 kJ/mol
1
2
② H2(g)+ O2(g) H2O(g) ΔH2 =-241.8 kJ/mol
1
2
③ CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH3 =-802.3 kJ/mol
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =?
① CO(g)+ O2(g) CO2(g) ΔH1 =-283.0 kJ/mol
1
2
盖斯定律
反应热的计算
③ CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH3 =-802.3 kJ/mol
-)
CO(g)+2H2O(g) CH4(g)+ O2(g) ΔH1-ΔH3
3
2
④
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =?
盖斯定律
反应热的计算
② H2(g)+ O2(g) H2O(g) ΔH2 =-241.8 kJ/mol
1
2
CO(g)+2H2O(g) CH4(g)+ O2(g) ΔH1-ΔH3
3
2
④
②×3+④
3ΔH2+ΔH1-ΔH3
ΔH =-206.1 kJ/mol
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =?
CO(g)+3H2(g) CH4(g)+H2O(g)
内容梳理
热化学方程式
物质变化
能量变化
伴随
合理使用
应用
定性
定量
化学反应分为放热反应、吸热反应
反应体系能量变化与化学键断裂和形成有关。
键能估算
实验测定
盖斯定律
物质的多少
物质所处的聚集状态
反应体系吸收或放出热量的多少
以 【例1】:太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
以 上述过程总反应的热化学方程式是什么呢?
反应Ⅰ SO2(g)+I2(g)+2H2O(l) 2HI(aq)+H2SO4(aq) ΔH1 =-213 kJ/mol
反应Ⅱ H2SO4(aq) SO2(g)+H2O(l)+ O2(g) ΔH2 =+327 kJ/mol
反应Ⅲ 2HI(aq) H2(g)+I2(g) ΔH3 =+172 kJ/mol
1
2
+)
以 借助能量制备物质
1
2
H2O(l) H2(g)+ O2(g)
ΔH1+ΔH2+ΔH3
反应Ⅰ SO2(g)+I2(g)+2H2O(l) 2HI(aq)+H2SO4(aq) ΔH1 =-213 kJ/mol
反应Ⅱ H2SO4(aq) SO2(g)+H2O(l)+ O2(g) ΔH2 =+327 kJ/mol
反应Ⅲ 2HI(aq) H2(g)+I2(g) ΔH3 =+172 kJ/mol
1
2
相关反应的热化学方程式为: 反应I:SO2(g) + I2(g) + 2H2O(l)=2HI(aq) + H2SO4(aq) ΔH1=﹣213 kJ·mol-1 反应II:H2SO4(aq)=SO2(g) + H2O(l) +
【例2】 为了更好地实现能源的合理使用,近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
相关反应的热化学方程式为: 反应I:SO2(g) + I2(g) + 2H2O(l)=2HI(aq) + H2SO4(aq) ΔH1=﹣213 kJ·mol-1 反应II:H2SO4(aq)=SO2(g) + H2O(l) +
(1) 请写出反应Ⅱ的热化学方程式。
反应Ⅰ 2H2SO4(l) 2SO2(g)+2H2O(g)+O2(g) ΔH1 =+551 kJ/mol 反应Ⅲ S(s)+O2(g) SO2(g) ΔH3 =-297 kJ/mol
反应Ⅰ 2H2SO4(l) 2SO2(g)+2H2O(g)+O2(g) ΔH1 =+551 kJ/mol
反应Ⅱ 3SO2(g)+2H2O(g) 2H2SO4(l)+S(s) ΔH2 =?
反应Ⅲ S(s)+O2(g) SO2(g) ΔH3 =-297 kJ/mol
2SO2(g)+2H2O(g)+O2(g) 2H2SO4(l) -ΔH1
SO2(g) S(s)+O2(g) -ΔH3
+)
反应Ⅱ 3SO2(g)+2H2O(g) 2H2SO4(l)+S(s) ΔH2 =-254 kJ/mol
2SO2(g)+2H2O(g)+O2(g) 2H2SO4(l) -ΔH1
SO2(g) S(s)+O2(g) -ΔH3
3SO2(g)+2H2O(g) 2H2SO4(l)+S(s) -ΔH1-ΔH3
(2) 观察这三个反应的热化学方程式,你有什么发现吗?
此热化学循环过程中没有实质意义上的物质转化。
反应Ⅰ 2H2SO4(l) 2SO2(g)+2H2O(g)+O2(g) ΔH1 =+551 kJ/mol
反应Ⅱ 3SO2(g)+2H2O(g) 2H2SO4(l)+S(s) ΔH2 =-254 kJ/mol
反应Ⅲ S(s)+O2(g) SO2(g) ΔH3 =-297 kJ/mol
经过这样的发现你能想到什么呢?
1、在此循环过程中物质转化的作用是传递能量。
2、能量守恒是盖斯定律运用的基础。
以 利用物质传递能量
总结提升
物质变化
能量变化
伴随
提供
条件
质量守恒定律
能量守恒定律
调控
利用
化学反应
在物质变化中实现能量转化
基于物质的性质开发新的能源
通过改变路径实现高能转化
练习 1 :根据下图回答问题
1、请分别写出图 1、图 2 对应反应的热化学方程式。
图1:CO(g)+H2O(g) CO2(g)+H2(g) ΔH =-41 kJ/mol
图2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH =+41 kJ/mol
2、图 2 中若 H2O 的状态为液态,则能量变化曲线会如何变化呢?
练习 1 :根据下图回答问题
3、图 2 中若 H2O 的状态为液态, 曲线 ① 表示的能量变化是否正确呢?
练习 1 :根据下图回答问题
已知:H2O(l) H2O(g) ΔH =+44 kJ/mol
CO2(g)+H2(g) CO(g)+H2O(l) ΔH =-3 kJ/mol
图2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH =+41 kJ/mol
已知:H2O(l) H2O(g) ΔH =+44 kJ/mol
练习 2 :
H2S(g)+H2SO4(aq) S(s)+2H2O(l)+SO2(g) ΔH4 =+61 kJ/mol
H2SO4(aq) SO2(g)+ O2(g)+H2O(l) ΔH1 =+327 kJ/mol
1
2
2HI(aq) H2(g)+I2(s) ΔH3 =+110 kJ/mol
SO2(g)+I2(s)+2H2O(l) H2SO4(aq)+2HI(aq) ΔH2 =-151 kJ/mol
热化学硫碘循环水分解制氢系统 1
热化学硫碘循环硫化氢分解制氢系统 2
系统1、系统2制氢的热化学方程式分别是什么呢?
相关反应的热化学方程式为: 反应I:SO2(g) + I2(g) + 2H2O(l)=2HI(aq) + H2SO4(aq) ΔH1=﹣213 kJ·mol-1 反应II:H2SO4(aq)=SO2(g) + H2O(l) +
H2SO4(aq) SO2(g)+ O2(g)+H2O(l) ΔH1 =+327 kJ/mol
1
2
2HI(aq) H2(g)+I2(s) ΔH3 =+110 kJ/mol
SO2(g)+I2(s)+2H2O(l) H2SO4(aq)+2HI(aq) ΔH2 =-151 kJ/mol
热化学硫碘循环水分解制氢系统 1
+)
H2O(l) H2(g)+ O2(g) ΔH1+ΔH2+ΔH3
1
2
H2O(l) H2(g)+ O2(g) ΔH =+286 kJ/mol
1
2
相关反应的热化学方程式为: 反应I:SO2(g) + I2(g) + 2H2O(l)=2HI(aq) + H2SO4(aq) ΔH1=﹣213 kJ·mol-1 反应II:H2SO4(aq)=SO2(g) + H2O(l) +
H2S(g)+H2SO4(aq) S(s)+2H2O(l)+SO2(g) ΔH4 =+61 kJ/mol
2HI(aq) H2(g)+I2(s) ΔH3 =+110 kJ/mol
SO2(g)+I2(s)+2H2O(l) H2SO4(aq)+2HI(aq) ΔH2 =-151 kJ/mol
热化学硫碘循环硫化氢分解制氢系统 2
+)
H2S(g) H2(g)+S(s) ΔH2+ΔH3+ΔH4
H2S(g) H2(g)+S(s) ΔH =+20 kJ/mol
练习3:通过以下反应可以获得新型能源二甲醚 ( CH3OCH3 )
① C(s)+H2O(g) CO(g)+H2(g) ΔH1 = a kJ/mol
② CO(g)+H2O(g) CO2(g)+H2(g) ΔH2 = b kJ/mol
③ CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3 = c kJ/mol
④ 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH4 = d kJ/mol
根据以上热化学方程式求出:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的 ΔH =?
① C(s)+H2O(g) CO(g)+H2(g) ΔH1 = a kJ/mol
② CO(g)+H2O(g) CO2(g)+H2(g) ΔH2 = b kJ/mol
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的 ΔH =?
④ 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH4 = d kJ/mol
③ CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3 = c kJ/mol
③ CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3 = c kJ/mol
④+③×2:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH5 = (d+2c) kJ/mol
④ 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH4 = d kJ/mol
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的 ΔH =?
⑤ 2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)ΔH5 = (d+2c) kJ/mol
② CO(g)+H2O(g) CO2(g)+H2(g) ΔH2 = b kJ/mol
⑤+②×2:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH =(d+2c+2b) kJ/mol
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的 ΔH =?
第一章复习
高二年级 化学
我们应该从哪些角度去选择燃料呢?
物质的燃烧热
开采、运输、储存条件
对生态环境的影响
......
煤炭是我国应用最广泛的基础能源。
通过煤的干馏和煤的气化可以获得以 CO、H2 为主要成分的管道煤气。
已知,1 mol C(s)与适量 H2O(g) 反应生成 CO(g) 和 H2(g),吸收 131.5 kJ 的能量。
请写出该反应的热化学方程式。
C(s)+H2O(g) CO(g)+H2(g) ΔH =+131.5 kJ/mol
热化学方程式
化学反应中能量变化的表达
请以图式的形式表示该反应过程中的能量变化。
放热反应
∑E反应物 > ∑E生成物
吸热反应
∑E反应物 < ∑E生成物
CO(g)+H2(g)
C(s)+H2O(g)
ΔH =+131.5 kJ/mol
C(s)+H2O(g) CO(g)+H2(g) ΔH =+131.5 kJ/mol
清洁
热量
现今天然气主要作为家用燃料的原因是什么呢?
25 ℃、101 kPa,一些物质的燃烧热
名称 化学式 ΔH /(kJ·mol-1)
甲烷 CH4(g) -890.3
一氧化碳 CO(g) -283.0
氢气 H2(g) -285.8
请根据燃烧热的定义和表格中的数据,判断下面呈现的热化学方程式是否正确?
H2(g)+ O2(g) H2O(g) ΔH =-285.8 kJ/mol
1
2
2CO(g)+O2(g) 2CO2(g) ΔH =-283.0 kJ/mol
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH =-890.3 kJ/mol
燃烧热是指在 101 kPa 时,1 mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量。
燃烧热
2CO(g)+O2(g) 2CO2(g) ΔH =-283.0 kJ/mol
H2(g)+ O2(g) H2O(g) ΔH =-285.8 kJ/mol
1
2
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH =-890.3 kJ/mol
燃烧热
H2(g)+ O2(g) H2O(l) ΔH =-285.8 kJ/mol
1
2
燃烧热
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH =-890.3 kJ/mol
CO(g)+ O2(g) CO2(g) ΔH =-283.0 kJ/mol
1
2
燃烧热
在家中烧开 1 L 水需要用多少升标准状况下的甲烷呢?
Q =c·m·Δt
4.18 J/ ( g·℃ )
1 L 水的质量是 1 000 g
25℃ 升高到 100 ℃
Q =c·m·Δt =4.18 J/( g·℃ )×1 000 g × 75 ℃ = 3.135×105 J
CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH =-802.3 kJ/mol
22.4 L
V
802.3 kJ
313.5 kJ
=
22.4 L
V L
802.3 kJ
313.5 kJ
V =8.753 L
Q =c·m·Δt =4.18 J/( g·℃ )×1 000 g × 75 ℃ = 3.135×105 J
我国是煤炭能源消费大国,若能以煤为原料生产出更加清洁、热值更高的甲烷将会进一步提升能源利用率。
科研人员尝试以煤干馏后获得的焦炉气(主要成分为 CO、H2)合成甲烷。
CO+3H2 CH4+H2O
如何获知这个化学反应的反应热呢?
键能估算
盖斯定律
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =?
若利用键能数据对该反应的反应热进行估算,你需要哪些键能数值?
反应热的计算
键能估算
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =?
反应热与反应物、生成物的键能存在怎样的关系呢?
∑E反应物键能 < ∑E生成物键能
放热反应
∑E反应物键能 > ∑E生成物键能
吸热反应
反应热的计算
键能估算
化学键 H-H C O O-H C-H
E/(kJ/mol) 436 1 076 465 413
吸收:1 076 kJ+3 mol×436 kJ/mol=2 384 kJ
释放:4 mol×413 kJ/mol+2 mol×465 kJ/mol=2 582 kJ
ΔH =∑E反应物键能-∑E生成物键能
反应热的计算
键能估算
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =?
化学键 H-H C O O-H C-H
E/(kJ/mol) 436 1 076 465 413
反应热的计算
键能估算
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =-198 kJ/mol
盖斯定律
反应热的计算
已知下列反应的反应热
① CO(g)+ O2(g) CO2(g) ΔH1 =-283.0 kJ/mol
1
2
② H2(g)+ O2(g) H2O(g) ΔH2 =-241.8 kJ/mol
1
2
③ CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH3 =-802.3 kJ/mol
试求出 CO(g)+3H2(g) CH4(g)+H2O(g)
的 ΔH =?
盖斯定律
反应热的计算
① CO(g)+ O2(g) CO2(g) ΔH1 =-283.0 kJ/mol
1
2
② H2(g)+ O2(g) H2O(g) ΔH2 =-241.8 kJ/mol
1
2
③ CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH3 =-802.3 kJ/mol
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =?
① CO(g)+ O2(g) CO2(g) ΔH1 =-283.0 kJ/mol
1
2
盖斯定律
反应热的计算
③ CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH3 =-802.3 kJ/mol
-)
CO(g)+2H2O(g) CH4(g)+ O2(g) ΔH1-ΔH3
3
2
④
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =?
盖斯定律
反应热的计算
② H2(g)+ O2(g) H2O(g) ΔH2 =-241.8 kJ/mol
1
2
CO(g)+2H2O(g) CH4(g)+ O2(g) ΔH1-ΔH3
3
2
④
②×3+④
3ΔH2+ΔH1-ΔH3
ΔH =-206.1 kJ/mol
CO(g)+3H2(g) CH4(g)+H2O(g)
ΔH =?
CO(g)+3H2(g) CH4(g)+H2O(g)
内容梳理
热化学方程式
物质变化
能量变化
伴随
合理使用
应用
定性
定量
化学反应分为放热反应、吸热反应
反应体系能量变化与化学键断裂和形成有关。
键能估算
实验测定
盖斯定律
物质的多少
物质所处的聚集状态
反应体系吸收或放出热量的多少
以 【例1】:太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
以 上述过程总反应的热化学方程式是什么呢?
反应Ⅰ SO2(g)+I2(g)+2H2O(l) 2HI(aq)+H2SO4(aq) ΔH1 =-213 kJ/mol
反应Ⅱ H2SO4(aq) SO2(g)+H2O(l)+ O2(g) ΔH2 =+327 kJ/mol
反应Ⅲ 2HI(aq) H2(g)+I2(g) ΔH3 =+172 kJ/mol
1
2
+)
以 借助能量制备物质
1
2
H2O(l) H2(g)+ O2(g)
ΔH1+ΔH2+ΔH3
反应Ⅰ SO2(g)+I2(g)+2H2O(l) 2HI(aq)+H2SO4(aq) ΔH1 =-213 kJ/mol
反应Ⅱ H2SO4(aq) SO2(g)+H2O(l)+ O2(g) ΔH2 =+327 kJ/mol
反应Ⅲ 2HI(aq) H2(g)+I2(g) ΔH3 =+172 kJ/mol
1
2
相关反应的热化学方程式为: 反应I:SO2(g) + I2(g) + 2H2O(l)=2HI(aq) + H2SO4(aq) ΔH1=﹣213 kJ·mol-1 反应II:H2SO4(aq)=SO2(g) + H2O(l) +
【例2】 为了更好地实现能源的合理使用,近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
相关反应的热化学方程式为: 反应I:SO2(g) + I2(g) + 2H2O(l)=2HI(aq) + H2SO4(aq) ΔH1=﹣213 kJ·mol-1 反应II:H2SO4(aq)=SO2(g) + H2O(l) +
(1) 请写出反应Ⅱ的热化学方程式。
反应Ⅰ 2H2SO4(l) 2SO2(g)+2H2O(g)+O2(g) ΔH1 =+551 kJ/mol 反应Ⅲ S(s)+O2(g) SO2(g) ΔH3 =-297 kJ/mol
反应Ⅰ 2H2SO4(l) 2SO2(g)+2H2O(g)+O2(g) ΔH1 =+551 kJ/mol
反应Ⅱ 3SO2(g)+2H2O(g) 2H2SO4(l)+S(s) ΔH2 =?
反应Ⅲ S(s)+O2(g) SO2(g) ΔH3 =-297 kJ/mol
2SO2(g)+2H2O(g)+O2(g) 2H2SO4(l) -ΔH1
SO2(g) S(s)+O2(g) -ΔH3
+)
反应Ⅱ 3SO2(g)+2H2O(g) 2H2SO4(l)+S(s) ΔH2 =-254 kJ/mol
2SO2(g)+2H2O(g)+O2(g) 2H2SO4(l) -ΔH1
SO2(g) S(s)+O2(g) -ΔH3
3SO2(g)+2H2O(g) 2H2SO4(l)+S(s) -ΔH1-ΔH3
(2) 观察这三个反应的热化学方程式,你有什么发现吗?
此热化学循环过程中没有实质意义上的物质转化。
反应Ⅰ 2H2SO4(l) 2SO2(g)+2H2O(g)+O2(g) ΔH1 =+551 kJ/mol
反应Ⅱ 3SO2(g)+2H2O(g) 2H2SO4(l)+S(s) ΔH2 =-254 kJ/mol
反应Ⅲ S(s)+O2(g) SO2(g) ΔH3 =-297 kJ/mol
经过这样的发现你能想到什么呢?
1、在此循环过程中物质转化的作用是传递能量。
2、能量守恒是盖斯定律运用的基础。
以 利用物质传递能量
总结提升
物质变化
能量变化
伴随
提供
条件
质量守恒定律
能量守恒定律
调控
利用
化学反应
在物质变化中实现能量转化
基于物质的性质开发新的能源
通过改变路径实现高能转化
练习 1 :根据下图回答问题
1、请分别写出图 1、图 2 对应反应的热化学方程式。
图1:CO(g)+H2O(g) CO2(g)+H2(g) ΔH =-41 kJ/mol
图2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH =+41 kJ/mol
2、图 2 中若 H2O 的状态为液态,则能量变化曲线会如何变化呢?
练习 1 :根据下图回答问题
3、图 2 中若 H2O 的状态为液态, 曲线 ① 表示的能量变化是否正确呢?
练习 1 :根据下图回答问题
已知:H2O(l) H2O(g) ΔH =+44 kJ/mol
CO2(g)+H2(g) CO(g)+H2O(l) ΔH =-3 kJ/mol
图2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH =+41 kJ/mol
已知:H2O(l) H2O(g) ΔH =+44 kJ/mol
练习 2 :
H2S(g)+H2SO4(aq) S(s)+2H2O(l)+SO2(g) ΔH4 =+61 kJ/mol
H2SO4(aq) SO2(g)+ O2(g)+H2O(l) ΔH1 =+327 kJ/mol
1
2
2HI(aq) H2(g)+I2(s) ΔH3 =+110 kJ/mol
SO2(g)+I2(s)+2H2O(l) H2SO4(aq)+2HI(aq) ΔH2 =-151 kJ/mol
热化学硫碘循环水分解制氢系统 1
热化学硫碘循环硫化氢分解制氢系统 2
系统1、系统2制氢的热化学方程式分别是什么呢?
相关反应的热化学方程式为: 反应I:SO2(g) + I2(g) + 2H2O(l)=2HI(aq) + H2SO4(aq) ΔH1=﹣213 kJ·mol-1 反应II:H2SO4(aq)=SO2(g) + H2O(l) +
H2SO4(aq) SO2(g)+ O2(g)+H2O(l) ΔH1 =+327 kJ/mol
1
2
2HI(aq) H2(g)+I2(s) ΔH3 =+110 kJ/mol
SO2(g)+I2(s)+2H2O(l) H2SO4(aq)+2HI(aq) ΔH2 =-151 kJ/mol
热化学硫碘循环水分解制氢系统 1
+)
H2O(l) H2(g)+ O2(g) ΔH1+ΔH2+ΔH3
1
2
H2O(l) H2(g)+ O2(g) ΔH =+286 kJ/mol
1
2
相关反应的热化学方程式为: 反应I:SO2(g) + I2(g) + 2H2O(l)=2HI(aq) + H2SO4(aq) ΔH1=﹣213 kJ·mol-1 反应II:H2SO4(aq)=SO2(g) + H2O(l) +
H2S(g)+H2SO4(aq) S(s)+2H2O(l)+SO2(g) ΔH4 =+61 kJ/mol
2HI(aq) H2(g)+I2(s) ΔH3 =+110 kJ/mol
SO2(g)+I2(s)+2H2O(l) H2SO4(aq)+2HI(aq) ΔH2 =-151 kJ/mol
热化学硫碘循环硫化氢分解制氢系统 2
+)
H2S(g) H2(g)+S(s) ΔH2+ΔH3+ΔH4
H2S(g) H2(g)+S(s) ΔH =+20 kJ/mol
练习3:通过以下反应可以获得新型能源二甲醚 ( CH3OCH3 )
① C(s)+H2O(g) CO(g)+H2(g) ΔH1 = a kJ/mol
② CO(g)+H2O(g) CO2(g)+H2(g) ΔH2 = b kJ/mol
③ CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3 = c kJ/mol
④ 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH4 = d kJ/mol
根据以上热化学方程式求出:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的 ΔH =?
① C(s)+H2O(g) CO(g)+H2(g) ΔH1 = a kJ/mol
② CO(g)+H2O(g) CO2(g)+H2(g) ΔH2 = b kJ/mol
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的 ΔH =?
④ 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH4 = d kJ/mol
③ CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3 = c kJ/mol
③ CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3 = c kJ/mol
④+③×2:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH5 = (d+2c) kJ/mol
④ 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH4 = d kJ/mol
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的 ΔH =?
⑤ 2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)ΔH5 = (d+2c) kJ/mol
② CO(g)+H2O(g) CO2(g)+H2(g) ΔH2 = b kJ/mol
⑤+②×2:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH =(d+2c+2b) kJ/mol
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的 ΔH =?
