高中化学选修4课件:化学反应原理--绪言 (28张PPT)
文档属性
| 名称 | 高中化学选修4课件:化学反应原理--绪言 (28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 200.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-05 19:56:54 | ||
图片预览








文档简介
(共28张PPT)
选修四 《化学反应原理 》学习安排:
1、课前一定好好预习,预习时尽量完成教材后附带的练习,由课代表布置检查。
2、及时完成所订资料中相应内容,课代表负责布置并督促。
3、有不懂的地方及时解决,可以问老师,同学……
化学反应原理
绪 言
绪 言
问题:
1、化学研究的核心问题是:
2、化学中最具有创造性的工作是:
3、如何实现这个过程?
化学反应
设计和创造新的分子
通常是利用已发现的原理来进行设计并实现这个过程
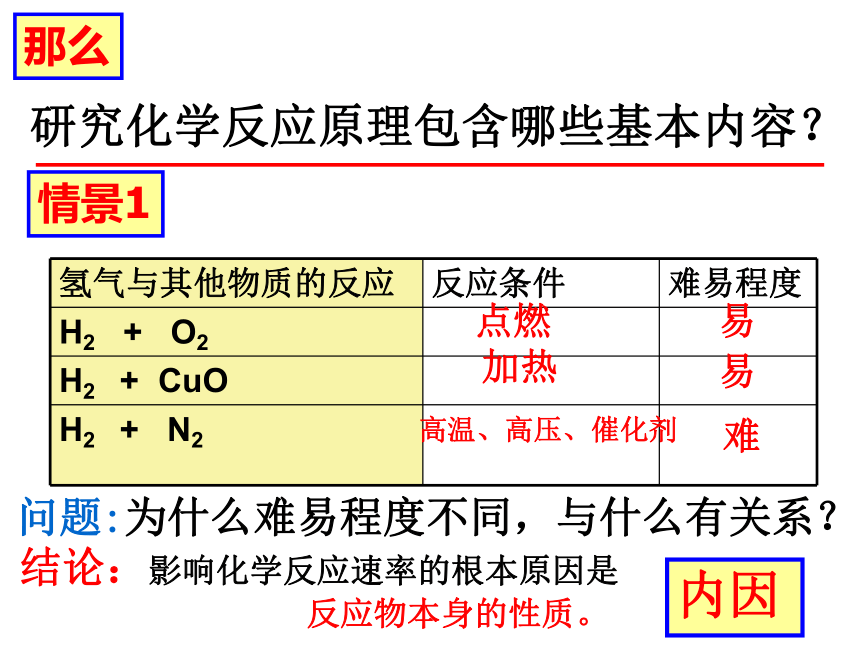
那么
研究化学反应原理包含哪些基本内容?
情景1
氢气与其他物质的反应 反应条件 难易程度
H2 + O2
H2 + CuO
H2 + N2
问题:为什么难易程度不同,与什么有关系?
结论:影响化学反应速率的根本原因是
反应物本身的性质。
内因
点燃
加热
高温、高压、催化剂
易
易
难
情景2
将H2与O2混合,在室温条件下可以稳定
存在数百年,但点燃后却会发生剧烈的
爆炸反应,而且只要配比相当,可以完
全转化成生成物。这说明了什么?
结论:
内部因素已经具备了,不同的外界条件能够不同程度的改变化学反应的速率。
情景3
H2与N2即使在高温、高压、催化剂的
条件下反应也不能完全转化为生成物,
这又说明了什么?
有些反应是有一定限度的
结论:
《化学反应原理》所研究的范围是
综 上 所 述
1、基本的化学反应原理:
包括反应速率、反应方向及反应限度。
3、从理论的高度来认识酸、碱、盐的本质及其在溶液中的反应。
4、电化学基础——富有时代气息和应用广泛的一个领域。
2、从能量变化的角度来探讨化学变化。
新课展望
分子相互碰撞是引发反应的必要条件。
3、是不是所有的碰撞都能引发反应?
2、分子间发生化学反应的必要条件是什么?
1、化学反应的本质是什么
问题探讨
反应物中旧化学键的断裂
生成物中新的化学键的形成
阅读课文P2 《简化后的有效碰撞模型》
那么
如何来研究一个反应,研究化学反应原理的基本方法和思路是怎样?
即:我们从哪些方面来认识一个反应!
先认识几个概念:
1、有效碰撞
2、活化分子和活化能
3、催化剂
一、简化后的有效碰撞模型
气体分子之间通常存在着比气体分子本身的体积要大得多的空间,因此,在常温常压下,可以认为气体分子的运动是 自由的,因而,它们之间的碰撞可以视为是随机的。
1、设想
PS:忽略了分子与分子之间的相互作用力,分子之间不存在牵制关系,故称为“自由”。
一、简化后的有效碰撞模型
在一个洁净的容器中,使H2和O2按体积比2:1的比例混合,气体分子因自由运动而不断相互碰撞(互相接触)——这是发生化学反应的必要条件。
2、模型的基本构架
假设与事实:研究结果表明,从分子的热运动看,分子发生碰撞的机会很多。如在常温常压下每个H2、O2自身或它们之间的碰撞频率为2.355×1010次/s。假如每次碰撞都能发生化学反应,则化学变化瞬间即可完成,但事实并非如此。
立论:并不是每次分子间的碰撞都会引起化学反应,只有其中部分的气体分子碰撞是有效的,即有效碰撞——这是发生化学反应的充要条件。
★有效碰撞
什么是有效碰撞?
引起分子间发生化学反应的碰撞
PS:
1、有效碰撞应当是那些本身具有较高能量的分子(活化分子)之间的碰撞;
2、分子间的碰撞是发生化学反应的必要条件;
3、而有效碰撞是发生化学反应的充要条件。
推论:
某一化学反应速率大小与
单位时间内有效碰撞的次数有关
为什么有的碰撞可以发生反应,而有的不能发生反应?与哪些因素有关?
问题:
★活化分子
什么是活化分子?
PS:
1、发生有效碰撞的分子一定是活化分子;
2、但活化分子的碰撞不一定是有效碰撞;
推论:
具有较高能量,能够发生有效碰撞的分子
有效碰撞次数的多少与
单位体积内反应物中活化分子的多少有关。
活化分子的多少又与什么有关?
问题:
★活化能
什么是活化能?
PS:
1、活化能的大小虽然意味着一般分子成为活化分子的难易,但是却对这个化学反应前后的能量变化并不产生任何影响。
2、向系统提供活化能的方法:加热、光照、超声波、核辐射、外加磁场、摩擦……
活化分子高出反应物分子平均能量的部分
活化分子
活化分子:能够发生有效碰撞的分子
活化能:活化分子所多出的那部分能量E1
能量
反应过程
生成物
反应物
反应热
E1
E2
活化分子
该反应是放热反还是吸热反应?
活化能与反应热有关吗 ?
科学探究
1、活化能的大小与反应的速率有何关系?为什么?
2、有没有活化能为0的反应?举例说明?
活化能越小,相同条件下活化分子百分数越多,单位体积内活化分子的数目越多,单位时间单位体积内有效碰撞的次数就越多,反应的速率就越大。
有。
如①离子之间的反应 ②距离地面50~85km的大气层中的自由原子之间的反应
参阅课文P4第一段。
问题探究
结论:
活化分子的多少与该反应的活化能的大小有关,
活化能的大小是由反应物分子的性质决定,
内因起主要决定作用
推论:
活化能越小则一般分子成为活化分子越容易,
则活化分子越多,
则单位时间内有效碰撞越多,
则反应速率越快。
碰撞 有效碰撞 活化分子 活化能
就下列的每个词说句话,试试看:
常温常压下,每个氢分子和氧分子自身或它们之间每秒平均碰撞2.355*1010次,如果每一次碰撞都能发生反应,那么整个容器内的氢气和氧气将在瞬间变成水。
能发生化学反应的碰撞叫有效碰撞。
碰撞是发生化学反应的必要条件,有效碰撞才是发生化学反应的充分条件。
具有足够的能量能发生有效碰撞的分子叫活化分子。
活化分子间要发生有效碰撞,还要有合适的取向。
活化分子所多出的那部分能量叫活化能。
在相同条件下,反应的活化能越大,则该反应的速率越小。
归 纳 总 结
一个反应要发生一般要经历哪些过程?
普通
分子
得到能量
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
活化能
1、为什么可燃物有氧气参与,还必须达到着火点才能燃烧?
2、催化剂在我们技术改造和生产中起关键作用,它主要作用是提高化学反应速率,试想一下为什么催化剂能提高反应速率?
解释问题
怎样改变反应的活化能为来加快反应的速率?是何措施?
能量
反应过程
生成物
反应物
反应热
E1
E2
活化分子
加了催化剂
没加催化剂
问题研究
练习
1.实验室制氢气时,若向稀硫酸中加几滴硫酸铜溶液,则产生氢气的速率加快,该反应中硫酸铜 催化剂(填:是、不是)。
2.单独加热氯酸钾,产生氧气的速率小,而将少量高锰酸钾和氯酸钾混合共热制氧气,产生氧气的速率明显加快,该实验中高锰酸钾 催化剂(填:是、不是)。
不是
不是
练习
3. 是发生化学反应的必要条件, 是发生化学反应的充要条件。
4.活化分子指的是能够 。
5.活化能的大小意味着一般分子成为活化分子的 ,活化能的大小不影响 ,活化能的作用在于 使 。
6.常用的提供活化能的方法有
等。
碰撞
有效碰撞
发生有效碰撞的分子
难易
反应前后的能量变化
反应物活化
加热、光照、超声波、核辐射 、 外加碰场
7.什么是有效碰撞?
8.某一化学反应的速率大小与单位时间
内 有关 。
9.什么是活化分子?
引起分子间的化学反应的碰撞是有效碰撞
有效碰撞的次数
具有较高能量,能够发生有效碰撞的分子是活化分子,发生有效碰撞的分子一定是活化分子,但活化分子的碰撞不一定是有效碰撞。有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关
10.什么是活化能?
活化分子高出反应物分子平均能量的部分是活化能。如图:
活化能的大小是由反应物分子的性质决定,(内因)活化能越小则一般分子成为活化分子越容易,则活化分子越多,则单位时间内有效碰撞越多,则反应速率越快。
11.什么是催化剂?
催化剂是能改变化学反应的速率,但反应前后本身性质和质量都不改变的物质,
催化剂作用:可以降低化学反应所需的活化能,也就等于提高了活化分子的百分数,从而提高了有效碰撞的频率.反应速率大幅提高.
选修四 《化学反应原理 》学习安排:
1、课前一定好好预习,预习时尽量完成教材后附带的练习,由课代表布置检查。
2、及时完成所订资料中相应内容,课代表负责布置并督促。
3、有不懂的地方及时解决,可以问老师,同学……
化学反应原理
绪 言
绪 言
问题:
1、化学研究的核心问题是:
2、化学中最具有创造性的工作是:
3、如何实现这个过程?
化学反应
设计和创造新的分子
通常是利用已发现的原理来进行设计并实现这个过程
那么
研究化学反应原理包含哪些基本内容?
情景1
氢气与其他物质的反应 反应条件 难易程度
H2 + O2
H2 + CuO
H2 + N2
问题:为什么难易程度不同,与什么有关系?
结论:影响化学反应速率的根本原因是
反应物本身的性质。
内因
点燃
加热
高温、高压、催化剂
易
易
难
情景2
将H2与O2混合,在室温条件下可以稳定
存在数百年,但点燃后却会发生剧烈的
爆炸反应,而且只要配比相当,可以完
全转化成生成物。这说明了什么?
结论:
内部因素已经具备了,不同的外界条件能够不同程度的改变化学反应的速率。
情景3
H2与N2即使在高温、高压、催化剂的
条件下反应也不能完全转化为生成物,
这又说明了什么?
有些反应是有一定限度的
结论:
《化学反应原理》所研究的范围是
综 上 所 述
1、基本的化学反应原理:
包括反应速率、反应方向及反应限度。
3、从理论的高度来认识酸、碱、盐的本质及其在溶液中的反应。
4、电化学基础——富有时代气息和应用广泛的一个领域。
2、从能量变化的角度来探讨化学变化。
新课展望
分子相互碰撞是引发反应的必要条件。
3、是不是所有的碰撞都能引发反应?
2、分子间发生化学反应的必要条件是什么?
1、化学反应的本质是什么
问题探讨
反应物中旧化学键的断裂
生成物中新的化学键的形成
阅读课文P2 《简化后的有效碰撞模型》
那么
如何来研究一个反应,研究化学反应原理的基本方法和思路是怎样?
即:我们从哪些方面来认识一个反应!
先认识几个概念:
1、有效碰撞
2、活化分子和活化能
3、催化剂
一、简化后的有效碰撞模型
气体分子之间通常存在着比气体分子本身的体积要大得多的空间,因此,在常温常压下,可以认为气体分子的运动是 自由的,因而,它们之间的碰撞可以视为是随机的。
1、设想
PS:忽略了分子与分子之间的相互作用力,分子之间不存在牵制关系,故称为“自由”。
一、简化后的有效碰撞模型
在一个洁净的容器中,使H2和O2按体积比2:1的比例混合,气体分子因自由运动而不断相互碰撞(互相接触)——这是发生化学反应的必要条件。
2、模型的基本构架
假设与事实:研究结果表明,从分子的热运动看,分子发生碰撞的机会很多。如在常温常压下每个H2、O2自身或它们之间的碰撞频率为2.355×1010次/s。假如每次碰撞都能发生化学反应,则化学变化瞬间即可完成,但事实并非如此。
立论:并不是每次分子间的碰撞都会引起化学反应,只有其中部分的气体分子碰撞是有效的,即有效碰撞——这是发生化学反应的充要条件。
★有效碰撞
什么是有效碰撞?
引起分子间发生化学反应的碰撞
PS:
1、有效碰撞应当是那些本身具有较高能量的分子(活化分子)之间的碰撞;
2、分子间的碰撞是发生化学反应的必要条件;
3、而有效碰撞是发生化学反应的充要条件。
推论:
某一化学反应速率大小与
单位时间内有效碰撞的次数有关
为什么有的碰撞可以发生反应,而有的不能发生反应?与哪些因素有关?
问题:
★活化分子
什么是活化分子?
PS:
1、发生有效碰撞的分子一定是活化分子;
2、但活化分子的碰撞不一定是有效碰撞;
推论:
具有较高能量,能够发生有效碰撞的分子
有效碰撞次数的多少与
单位体积内反应物中活化分子的多少有关。
活化分子的多少又与什么有关?
问题:
★活化能
什么是活化能?
PS:
1、活化能的大小虽然意味着一般分子成为活化分子的难易,但是却对这个化学反应前后的能量变化并不产生任何影响。
2、向系统提供活化能的方法:加热、光照、超声波、核辐射、外加磁场、摩擦……
活化分子高出反应物分子平均能量的部分
活化分子
活化分子:能够发生有效碰撞的分子
活化能:活化分子所多出的那部分能量E1
能量
反应过程
生成物
反应物
反应热
E1
E2
活化分子
该反应是放热反还是吸热反应?
活化能与反应热有关吗 ?
科学探究
1、活化能的大小与反应的速率有何关系?为什么?
2、有没有活化能为0的反应?举例说明?
活化能越小,相同条件下活化分子百分数越多,单位体积内活化分子的数目越多,单位时间单位体积内有效碰撞的次数就越多,反应的速率就越大。
有。
如①离子之间的反应 ②距离地面50~85km的大气层中的自由原子之间的反应
参阅课文P4第一段。
问题探究
结论:
活化分子的多少与该反应的活化能的大小有关,
活化能的大小是由反应物分子的性质决定,
内因起主要决定作用
推论:
活化能越小则一般分子成为活化分子越容易,
则活化分子越多,
则单位时间内有效碰撞越多,
则反应速率越快。
碰撞 有效碰撞 活化分子 活化能
就下列的每个词说句话,试试看:
常温常压下,每个氢分子和氧分子自身或它们之间每秒平均碰撞2.355*1010次,如果每一次碰撞都能发生反应,那么整个容器内的氢气和氧气将在瞬间变成水。
能发生化学反应的碰撞叫有效碰撞。
碰撞是发生化学反应的必要条件,有效碰撞才是发生化学反应的充分条件。
具有足够的能量能发生有效碰撞的分子叫活化分子。
活化分子间要发生有效碰撞,还要有合适的取向。
活化分子所多出的那部分能量叫活化能。
在相同条件下,反应的活化能越大,则该反应的速率越小。
归 纳 总 结
一个反应要发生一般要经历哪些过程?
普通
分子
得到能量
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
活化能
1、为什么可燃物有氧气参与,还必须达到着火点才能燃烧?
2、催化剂在我们技术改造和生产中起关键作用,它主要作用是提高化学反应速率,试想一下为什么催化剂能提高反应速率?
解释问题
怎样改变反应的活化能为来加快反应的速率?是何措施?
能量
反应过程
生成物
反应物
反应热
E1
E2
活化分子
加了催化剂
没加催化剂
问题研究
练习
1.实验室制氢气时,若向稀硫酸中加几滴硫酸铜溶液,则产生氢气的速率加快,该反应中硫酸铜 催化剂(填:是、不是)。
2.单独加热氯酸钾,产生氧气的速率小,而将少量高锰酸钾和氯酸钾混合共热制氧气,产生氧气的速率明显加快,该实验中高锰酸钾 催化剂(填:是、不是)。
不是
不是
练习
3. 是发生化学反应的必要条件, 是发生化学反应的充要条件。
4.活化分子指的是能够 。
5.活化能的大小意味着一般分子成为活化分子的 ,活化能的大小不影响 ,活化能的作用在于 使 。
6.常用的提供活化能的方法有
等。
碰撞
有效碰撞
发生有效碰撞的分子
难易
反应前后的能量变化
反应物活化
加热、光照、超声波、核辐射 、 外加碰场
7.什么是有效碰撞?
8.某一化学反应的速率大小与单位时间
内 有关 。
9.什么是活化分子?
引起分子间的化学反应的碰撞是有效碰撞
有效碰撞的次数
具有较高能量,能够发生有效碰撞的分子是活化分子,发生有效碰撞的分子一定是活化分子,但活化分子的碰撞不一定是有效碰撞。有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关
10.什么是活化能?
活化分子高出反应物分子平均能量的部分是活化能。如图:
活化能的大小是由反应物分子的性质决定,(内因)活化能越小则一般分子成为活化分子越容易,则活化分子越多,则单位时间内有效碰撞越多,则反应速率越快。
11.什么是催化剂?
催化剂是能改变化学反应的速率,但反应前后本身性质和质量都不改变的物质,
催化剂作用:可以降低化学反应所需的活化能,也就等于提高了活化分子的百分数,从而提高了有效碰撞的频率.反应速率大幅提高.
