仁爱版初中化学九年级下册专题8《金属和金属材料》检测题(含答案)
文档属性
| 名称 | 仁爱版初中化学九年级下册专题8《金属和金属材料》检测题(含答案) | 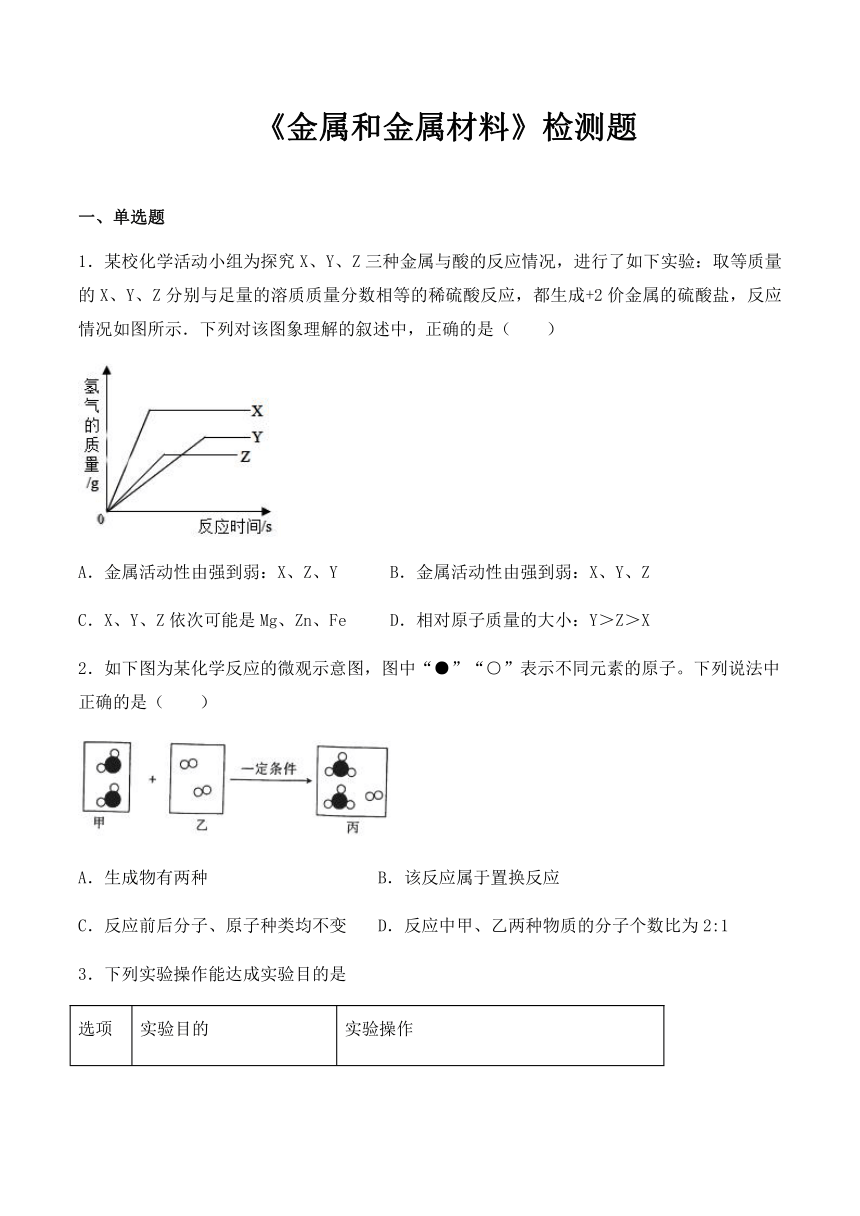 | |
| 格式 | zip | ||
| 文件大小 | 144.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-06 09:50:09 | ||
图片预览



文档简介
《金属和金属材料》检测题
一、单选题
1.某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如图所示.下列对该图象理解的叙述中,正确的是( )
A.金属活动性由强到弱:X、Z、Y B.金属活动性由强到弱:X、Y、Z
C.X、Y、Z依次可能是Mg、Zn、Fe D.相对原子质量的大小:Y>Z>X
2.如下图为某化学反应的微观示意图,图中“●”“○”表示不同元素的原子。下列说法中正确的是( )
A.生成物有两种 B.该反应属于置换反应
C.反应前后分子、原子种类均不变 D.反应中甲、乙两种物质的分子个数比为2:1
3.下列实验操作能达成实验目的是
选项 实验目的 实验操作
A 检验CO2是否集满 向集气瓶中加入澄清石灰水,振荡
B 证明CO2能与水反应 向盛满CO2的塑料瓶中倒水,拧紧瓶盖并振荡
C 证明酸与碱能发生中和反应 向氢氧化钠稀溶液中缓慢滴加稀盐酸
D 比较Cu与Ag的金属活动性 将Cu片放入AgNO3溶液中
A.A B.B C.C D.D
4.放在手心里就能熔化的稀有金属镓,其沸点为2403℃,更奇妙的是镓熔化后在-120 ℃仍不易凝固;在常温下几乎不与氧气和水反应,但能溶于强酸和强碱;与其他金属融合可改善合金性能;与硫、硒等非金属化合可生成优质的半导体材料。下列有关镓的用途的叙述错误的是 ( )
A.与硝酸反应制氢气 B.制作高温温度计
C.制晶体管材料 D.金与镓的合金用于镶牙
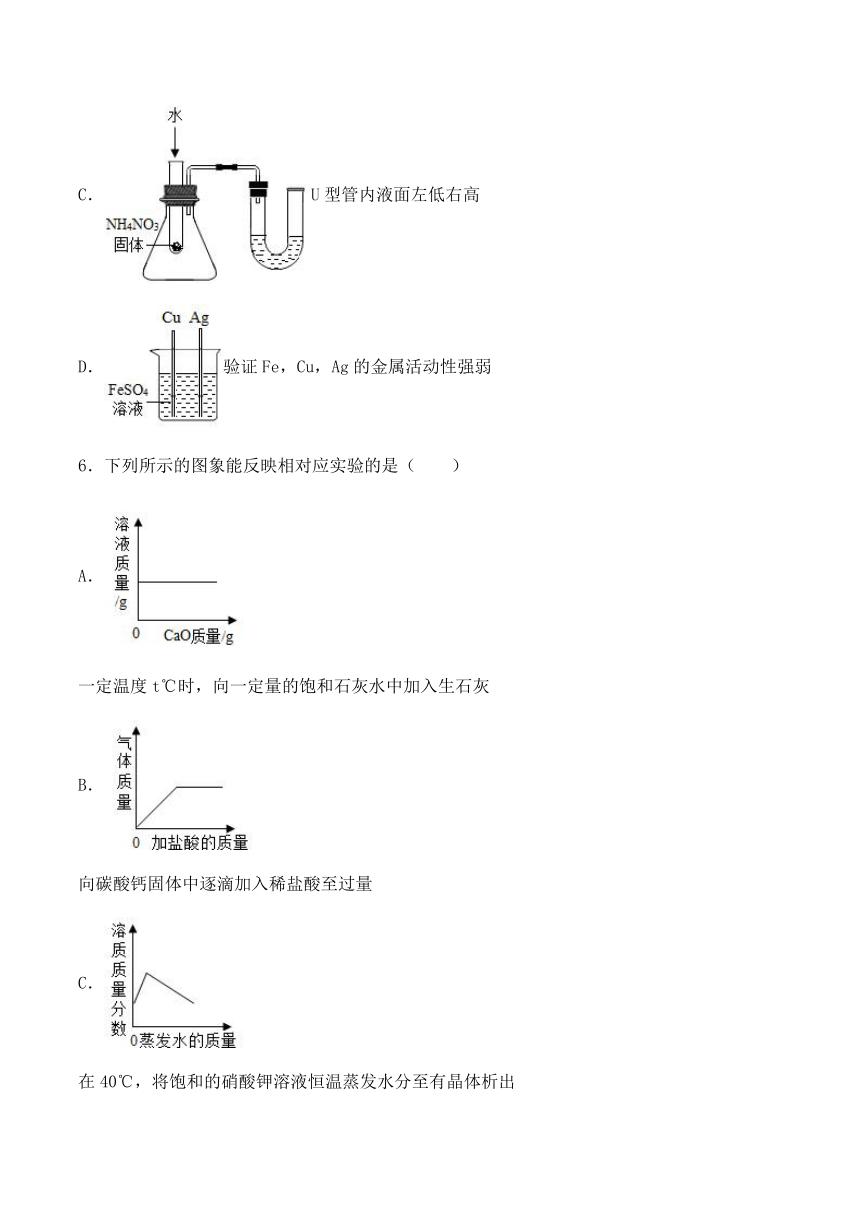
5.下列实验进行中的现象或实验原理正确的是( )
A.探究同种物质在不同溶剂中的溶解性
B.白磷始终不燃烧
C.U型管内液面左低右高
D.验证Fe,Cu,Ag的金属活动性强弱
6.下列所示的图象能反映相对应实验的是( )
A.
一定温度t℃时,向一定量的饱和石灰水中加入生石灰
B.
向碳酸钙固体中逐滴加入稀盐酸至过量
C.
在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有晶体析出
D.
将等质量的金属镁片和铁片分别与足量的稀硫酸混合
7.下列知识的整理完全正确的是
A.实验方法 B.化学与生活
①鉴别N2、CO2——用燃着的木条②熄灭酒精灯——用嘴吹灭③除去铁锈——用稀盐酸 ①世卫组织推广使用中国铁锅预防贫血症②抽成真空或充入氮气可以延缓食物腐败③进入久未开启的菜窖之前做灯火试验
C.实验记录 D.物质构成
①用50ml烧杯量取4.8ml 水②20ml水与20ml酒精混合体积小于40ml③用托盘天平称取5.6g食盐 ①物质的构成微粒相同,物理性质一定相同②空气、液氧、二氧化碳中都含氧分子③铁、铜、汞等金属由原子构成
A.A B.B C.C D.D
8.下列有关物质的性质与用途具有对应关系的是( )
A.铝具有导电性,可用于制炊具 B.活性炭具有吸附性,可用于净化水
C.盐酸具有挥发性,可用于除铁锈 D.浓硫酸具有腐蚀性,可用作干燥剂
9.分类法是化学研究的重要方法。以下分类不正确的是
A.金属:铁、铜、汞 B.氧化物:水、二氧化锰、五氧化二磷
C.混合物:冰水混合物、海水、空气 D.新能源:太阳能、氢能、核能
10.下列各组物质不能用于验证Mg、Fe、Cu三种金属活动性强弱的是
A.稀盐酸 B.MgSO4溶液 Fe、Cu
C.Mg、FeSO4溶液、Cu D.FeSO4溶液、Fe、CuSO4溶液
11.下列实验现象的描述,正确的是( )
A.硝酸铵溶于水时,溶液温度明显降低
B.硫在空气中燃烧,产生明亮的蓝紫色火焰
C.把铁钉放入硫酸铜溶液中,有铜析出
D.碳还原氧化铜,固体由红色变黑色
12.下列物质可以用铁制容器盛放的是( )
A.稀硫酸 B.稀盐酸 C.浓盐酸 D.浓硫酸
二、实验题
13.某化学兴趣小组的同学为探究铁生锈的条件,他们将等质量、相同规格的光亮的铁钉同时放入如图所示装置中进行实验.回答下列问题:
(1)一段时间后,铁钉无变化的是 ___________(填写字母);
(2)铁生锈的条件是 ________;
(3)用植物油将水封住的原因 ________;
(4)要探究铁生锈的条件,上述实验还不够完善,还需要补充的一个实验是 ___________;
(5)请你提出防止钢铁锈蚀的两条合理措施①________;②________。
14.用如图装置完成 CO 还原 Fe2O3 的实验。缓慢通入一定量的 CO。点燃酒精喷灯,继续通入 CO。一段时间后,当粉末全部变为黑色时,停止通入 CO,熄灭酒精喷灯。
(1)CO 与 Fe2O3 反应的化学方程式是________。
(2)在冷却过程中,为防止管中黑色粉末表面因与空气接触而变为红色,应补充的操作是________。
(3)有同学提出黑色粉末中还可能含有 Fe3O4。资料: Fe3O4 不与 CuSO4 溶液反应。
为验证黑色粉末成分。该同学取少量样品于烧杯中,加过量 CuSO4 溶液,充分反应。证明黑色粉末中含 Fe 和 Fe3O4 的现象是_________。
三、推断题
15.A~G是初中化学常见的物质。已知A为黑色固体单质,B为赤铁矿的主要成分,G为紫红色固体单质,它们的转化关系如图所示,请回答下列问题:
(1)写出以下物质的化学式:B_______;E______。
(2)写出反应Ⅱ的化学方程式:________________。
(3)反应Ⅲ的化学方程式为:__________________________________。
16.A-I是初中化学所学的物质,其转化关系如下图所示。按单质、氧化物、酸、碱、盐分类,A、B、D、E、F是不同类别的物质,C、G、H、I、F也是不同类别的物质;A、B、C中含有同种元素,B是导致“温室效应”的一种气体。图中“—”表示两端的物质能发生化学反应,“→”表示物质间存在相应的转化关系(部分反应物、生成物和反应条件未标出)。请回答:
(1)物质B的化学式: ;
(2)反应①的基本反应类型是 ;
(3)反应②的化学方程式是 。
17.某工厂在生产过程中会产生大量氧化铜废料(杂质与稀硫酸不发生反应且不溶于水),工厂技术科设计如下的生产流程来回收金属,其流程图如下
试回答下列有关问题:
(1)在加热条件下,氧化铜能与稀硫酸迅速反应生成硫酸铜和一种氧化物,该氧化物是相对分子质量最小的氧化物。则氧化铜与稀硫酸反应的化学方程式为________;
(2)过滤时用到的玻璃仪器有玻璃棒、烧杯和________;
(3)溶液B中的溶质为:________;
(4)若D是一种浅绿色溶液,C是一种最轻的气体,则X的化学式为________,在溶液B中加入X时发生的化学反应方程式为________。
四、计算题
18.将14.0g含杂质的锌粒,加入到盛有110.0g过量的稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为123.6g。试计算:
(1)生成氢气的质量_________;
(2)锌粒中所含锌的质量_________。
19.(1)炼铁的主要反应原理是在 的条件下,用 从含铁的矿石中将铁还原出来,(2)计算用1000t含氧化铁80%的赤铁矿石炼铁,理论上可以炼出铁的质量是多少?
20.向足量稀硫酸溶液中加入锌粉(仅含不溶于酸的杂质),充分反应,反应前后各物质的质量统计如图所示。求:
(1)锌粉中含有金属锌的质量为_____g。
(2)反应后,溶液中硫酸锌的质量分数为多少__________?(请写出计算过程)
参考答案
1.A 2.D 3.D 4.A 5.A 6.B 7.B 8.B 9.C 10.B 11.A 12.D
13.C 铁与氧气和水共同作用 隔绝空气(氧气) 将铁钉置于干燥的空气中 刷漆 涂油(其他合理答案也可)
14.3CO + Fe2O33CO2 + 2Fe 继续通 CO 至玻璃管冷却或用弹簧夹夹住气球 黑色粉末部分变红
15.Fe2O3 CO Fe+CuSO4=FeSO4+Cu
16.(1)CO2 (2)复分解反应;(3)2AgNO3+Cu==Cu(NO3)2+2Ag
17. 漏斗 H2SO4和CuSO4 Fe 、
18.0.4g 13g
19.(1)高温;CO;
(2)理论上可以炼出铁的质量是560t.
20.6.5g 12.5%
