人教版高中化学选修四第二章第3节第7课时 转化率和图像 课件(共26张PPT)
文档属性
| 名称 | 人教版高中化学选修四第二章第3节第7课时 转化率和图像 课件(共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 511.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-06 17:58:03 | ||
图片预览







文档简介
课件26张PPT。第七课时 转化率和图像1.认识转化率和反应物的量、化学平衡移动之间的关系。
2.认识化学反应速率、化学平衡典型图像。
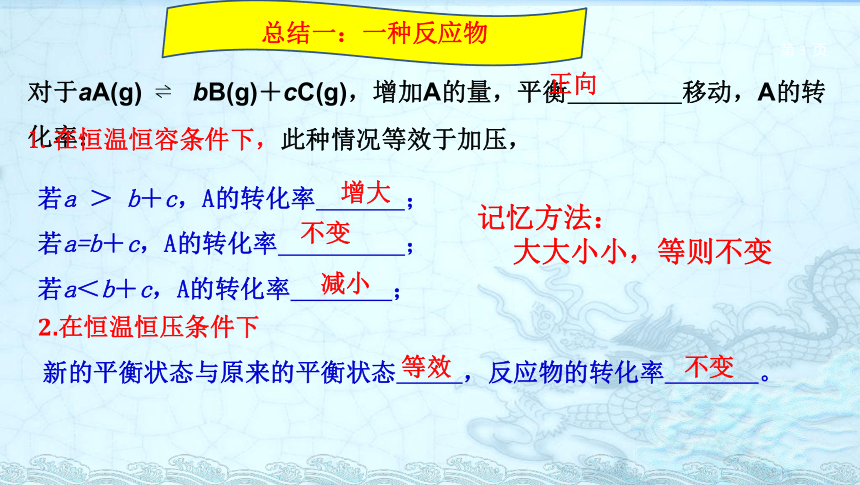
3.学会图像题的分析解答方法。一、平衡转化率某指定反应物的转化率α=Δn/n始×100%=Δc /c始 ×100%例1.恒温恒容的体系中,冲入2molN02气体,发生如下:2NO2(g) ? N2O4(g),平衡后再冲入2molN02,则平衡向 移动,N02的转化率 ,nNO2∕nN2O4的值 (变大、变小、不变);
若是恒温恒压的体系中,则平衡向 移动,N02的转化率 ,nNO2∕nN2O4的值 (变大、变小、不变)。 正向不变正向不变变大变小对于aA(g) ? bB(g)+cC(g),增加A的量,平衡 移动,A的转化率:若a > b+c,A的转化率 ;
若a=b+c,A的转化率 ;
若a<b+c,A的转化率 ;总结一:一种反应物增大不变减小记忆方法:
大大小小,等则不变1.在恒温恒容条件下,此种情况等效于加压, 2.在恒温恒压条件下新的平衡状态与原来的平衡状态 ,反应物的转化率 。 等效不变正向 例2.同温度、同容积的四个密闭容器中发生:2A(g)+B(g)?3C(g)+2D(g),起始时候四个容器中A、B的物质的量分别是:甲中2molA和1molB;乙中A和B都是1mol;丙中A、B都是2mol;丁中1molA和2molB,相同温度下建立平衡时转化率的大小关系是
A: B: 。 2A(g)+ B(g)? 3C(g)+2D(g)
甲 2mol 1molB
乙 1mol 1molB
丙 2mol 2molB
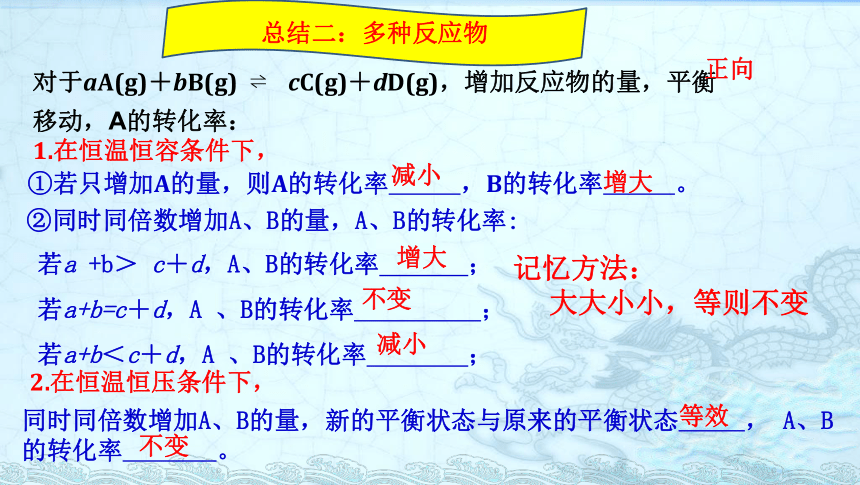
丁 1mol 2molBа(A):甲﹤丙﹤乙﹤丁а(B):丁﹤丙﹤乙﹤甲总结二:多种反应物对于aA(g)+bB(g) ? cC(g)+dD(g),增加反应物的量,平衡 移动,A的转化率:①若只增加A的量,则A的转化率 ,B的转化率 。1.在恒温恒容条件下,减小增大若a +b> c+d,A、B的转化率 ;
若a+b=c+d,A 、B的转化率 ;
若a+b<c+d,A 、B的转化率 ;增大不变减小记忆方法:
大大小小,等则不变②同时同倍数增加A、B的量,A、B的转化率:2.在恒温恒压条件下,同时同倍数增加A、B的量,新的平衡状态与原来的平衡状态 , A、B的转化率 。 等效不变正向练1.某温度下,在密闭容器中发生如下反应2M(g)+N(g)? 2E(g),若开始只通入2molE气体,达到平衡时,混合气体的压强比起始增大了20%;若开始时通入2molM和1molN的混合气体,达到平衡时M的转化率为( )
A小于60% B等于40% C等于60% D大于60% 2M(g)+ N(g)? 2E(g)
开始 0 0 2
反应 0.8 0.4 0.8
平衡 0.8 0.4 1.2 2M(g)+ N(g)? 2E(g)
开始 2 1 0
反应 1.2 0.6 1.2
平衡 0.8 0.4 1.2小结:一个完全从正反应,一个完全从逆反应方向建立的全等效平衡,反应物的转化率之和为 。 B100%二、图像问题(1)无论是反应速率图像还是平衡图像,都要清楚纵、横坐标的含义,都要与化学原理相联系,特别是与平衡移动原理相联系。
(2)三步分析法:一看反应速率是增大还是减小;二看v正、v逆的相对大小;三看化学平衡移动的方向。
(3)四要素分析法:看曲线的起点;看曲线的变化趋势;看曲线的转折点;看曲线的终点。
(4)先拐先平:可逆反应mA(g)+nB(g) ? pC(g)+qD(g),在转化率—时间曲线中,先出现拐点的曲线先达到平衡,这表示反应的温度高或压强大。
(5)定一议二:图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系。1.n(或c)—t图象分类讨论2.v — t 图象3. v — P(或T)图象4. 转化率(或m%)— P(或T)图象5.转化率(或m%)—t图象例3. 可逆反应2A(g) ? B(g) △H<0 ,从开始至平衡后改变某一外界条件使平衡发生了移动至重新平衡,该过程中各物质的浓度(用c表示)随时间变化情况如图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向:T ? ←P? →P? ←移去生成物
→例4.全程速率—时间图A→B反应速率随时间变化的原因是:B→ C反应速率随时间变化的原因是:1.对明显的放热反应,反应放热使反应速率加快2.对不是明显的放热反应,反应过程中的生成物对反应有 催化作用使反应速率加快反应物浓度减低,使反应速率减慢t1__________
t2__________
t3__________
t4__________
t5__________增大N2或H2的浓度减小NH3的浓度增大压强降低温度使用催化剂练2.对于反应N2+3H2 ? 2NH3 △H<0 ,分析下图,确定t1—t5各点所改变的条件分别是什么?例5. 下列各图是温度或压强对反应2A(s)+2B(g) ? 2C(g)+D(g) △H ﹥ 0的正逆反应速率的影响,其中正确的图象是( )ABCDV正V正V正V正V逆V逆V逆V逆ADTTPPVVVV例6、研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系P1等压线正反应吸热 m+n>p+qPT1P2T1P10tC%正反应放热 m+n>p+qt1t2t3等温线T2P2例7、研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系?正反应吸热★?正反应吸热★正反应放热★m+nA.正反应吸热,m+n>p+q
B.正反应吸热,m+n<p+q C.正反应放热,m+n>p+q D.正反应放热,m+n<p+q A练4. 对于反应mA(g)+nB(g) pC(g)+qD(g),根据图象填空:正反应为_____反应m+n___p+qm+n___p+qm+n___p+q放热><=练5.对于反应mA(g) + nB(g) pC(g) + qD(g),根据图象填空:m+n___p+qm+n___p+q正反应为_____反应正反应为_____反应><吸热放热练6.在容积一定的密闭容器中,可逆反应 A(g)+B(g) ? xC(g) △H,满足左图所示,以下关于右图说法中正确的是( )P3>P4,y轴表示A的转化率
B. P3C. P3D. P3>P4, y轴表示混合气体平均摩尔质量 AD例8.下图是在其它条件一定时,反应2NO+O2 2NO2 △H<0 中NO 的最大转化率与温度的关系曲线。图中坐标A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。ABCEDC点T转化率线为平衡点线外未平衡点 A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为:B>A>C
C.若T2>T1,则正反应一定是放热反应
D.B点时,平衡体系中A、B原子数之比接近1∶3
D斜率意义——速率练8. 根据盐酸与大理石(足量)反应, V(CO2)-t关系图曲线,以下判断正确的是( )
若温度相同,①反应的盐酸浓度大于③反应,但H+物质的量相等。
②反应时H+的物质的量浓度最大
②与①的反应速率相等
反应速率由大到小顺序为①②③④AD时间/min练9.右图为实验室制备CO2的实验记录,V(CO2)-t正确的是:( )
A、OE段反应速率最快
B、EF段表示反应速率最快,收集到的CO2最多
C、FG段表示收集的CO2最多
D、OG段表示随着时间的推移,反应速率逐渐增快斜率意义——速率V(CO2)/mLB例9.某溶液中发生反应A ? 2B+C,VA-t 的关系如图,已知溶液的体积为2L,起始时体系中只有A,请回答下列问题:
1)图中阴影部分的面积表示0—2min内的正反应_______减小值,应小于_________。
2)2min时,B物质的量浓度的取值范围为:______________。面积意义——浓度1mol/LB.反应达到平衡时外界条件对平衡影响关系如图B所示,则正反应为吸热反应
C.物质的百分含量和温度关系如图C所示,则正反应为放热反应
D.反应速率和反应条件变化关系如图D所示,则该反应的正反应为放热反应,且A、B、C、D均为气体C练12.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(下图中,p表示压强,T表示温度,n表示物质的量,t表示反应时间):根据以上规律判断(填“>”“=”或“<”):
(1)反应Ⅰ:p2________p1,ΔH________0。
(2)反应Ⅱ:T1________T2,ΔH________0。
(3)反应Ⅲ:若T2________T1,ΔH________0。
(4)反应Ⅳ:若T2________T1,ΔH________0 ><><>>或< <>>或< <
2.认识化学反应速率、化学平衡典型图像。
3.学会图像题的分析解答方法。一、平衡转化率某指定反应物的转化率α=Δn/n始×100%=Δc /c始 ×100%例1.恒温恒容的体系中,冲入2molN02气体,发生如下:2NO2(g) ? N2O4(g),平衡后再冲入2molN02,则平衡向 移动,N02的转化率 ,nNO2∕nN2O4的值 (变大、变小、不变);
若是恒温恒压的体系中,则平衡向 移动,N02的转化率 ,nNO2∕nN2O4的值 (变大、变小、不变)。 正向不变正向不变变大变小对于aA(g) ? bB(g)+cC(g),增加A的量,平衡 移动,A的转化率:若a > b+c,A的转化率 ;
若a=b+c,A的转化率 ;
若a<b+c,A的转化率 ;总结一:一种反应物增大不变减小记忆方法:
大大小小,等则不变1.在恒温恒容条件下,此种情况等效于加压, 2.在恒温恒压条件下新的平衡状态与原来的平衡状态 ,反应物的转化率 。 等效不变正向 例2.同温度、同容积的四个密闭容器中发生:2A(g)+B(g)?3C(g)+2D(g),起始时候四个容器中A、B的物质的量分别是:甲中2molA和1molB;乙中A和B都是1mol;丙中A、B都是2mol;丁中1molA和2molB,相同温度下建立平衡时转化率的大小关系是
A: B: 。 2A(g)+ B(g)? 3C(g)+2D(g)
甲 2mol 1molB
乙 1mol 1molB
丙 2mol 2molB
丁 1mol 2molBа(A):甲﹤丙﹤乙﹤丁а(B):丁﹤丙﹤乙﹤甲总结二:多种反应物对于aA(g)+bB(g) ? cC(g)+dD(g),增加反应物的量,平衡 移动,A的转化率:①若只增加A的量,则A的转化率 ,B的转化率 。1.在恒温恒容条件下,减小增大若a +b> c+d,A、B的转化率 ;
若a+b=c+d,A 、B的转化率 ;
若a+b<c+d,A 、B的转化率 ;增大不变减小记忆方法:
大大小小,等则不变②同时同倍数增加A、B的量,A、B的转化率:2.在恒温恒压条件下,同时同倍数增加A、B的量,新的平衡状态与原来的平衡状态 , A、B的转化率 。 等效不变正向练1.某温度下,在密闭容器中发生如下反应2M(g)+N(g)? 2E(g),若开始只通入2molE气体,达到平衡时,混合气体的压强比起始增大了20%;若开始时通入2molM和1molN的混合气体,达到平衡时M的转化率为( )
A小于60% B等于40% C等于60% D大于60% 2M(g)+ N(g)? 2E(g)
开始 0 0 2
反应 0.8 0.4 0.8
平衡 0.8 0.4 1.2 2M(g)+ N(g)? 2E(g)
开始 2 1 0
反应 1.2 0.6 1.2
平衡 0.8 0.4 1.2小结:一个完全从正反应,一个完全从逆反应方向建立的全等效平衡,反应物的转化率之和为 。 B100%二、图像问题(1)无论是反应速率图像还是平衡图像,都要清楚纵、横坐标的含义,都要与化学原理相联系,特别是与平衡移动原理相联系。
(2)三步分析法:一看反应速率是增大还是减小;二看v正、v逆的相对大小;三看化学平衡移动的方向。
(3)四要素分析法:看曲线的起点;看曲线的变化趋势;看曲线的转折点;看曲线的终点。
(4)先拐先平:可逆反应mA(g)+nB(g) ? pC(g)+qD(g),在转化率—时间曲线中,先出现拐点的曲线先达到平衡,这表示反应的温度高或压强大。
(5)定一议二:图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系。1.n(或c)—t图象分类讨论2.v — t 图象3. v — P(或T)图象4. 转化率(或m%)— P(或T)图象5.转化率(或m%)—t图象例3. 可逆反应2A(g) ? B(g) △H<0 ,从开始至平衡后改变某一外界条件使平衡发生了移动至重新平衡,该过程中各物质的浓度(用c表示)随时间变化情况如图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向:T ? ←P? →P? ←移去生成物
→例4.全程速率—时间图A→B反应速率随时间变化的原因是:B→ C反应速率随时间变化的原因是:1.对明显的放热反应,反应放热使反应速率加快2.对不是明显的放热反应,反应过程中的生成物对反应有 催化作用使反应速率加快反应物浓度减低,使反应速率减慢t1__________
t2__________
t3__________
t4__________
t5__________增大N2或H2的浓度减小NH3的浓度增大压强降低温度使用催化剂练2.对于反应N2+3H2 ? 2NH3 △H<0 ,分析下图,确定t1—t5各点所改变的条件分别是什么?例5. 下列各图是温度或压强对反应2A(s)+2B(g) ? 2C(g)+D(g) △H ﹥ 0的正逆反应速率的影响,其中正确的图象是( )ABCDV正V正V正V正V逆V逆V逆V逆ADTTPPVVVV例6、研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系P1等压线正反应吸热 m+n>p+qPT1P2T1P10tC%正反应放热 m+n>p+qt1t2t3等温线T2P2例7、研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系?正反应吸热★?正反应吸热★正反应放热★m+n
B.正反应吸热,m+n<p+q C.正反应放热,m+n>p+q D.正反应放热,m+n<p+q A练4. 对于反应mA(g)+nB(g) pC(g)+qD(g),根据图象填空:正反应为_____反应m+n___p+qm+n___p+qm+n___p+q放热><=练5.对于反应mA(g) + nB(g) pC(g) + qD(g),根据图象填空:m+n___p+qm+n___p+q正反应为_____反应正反应为_____反应><吸热放热练6.在容积一定的密闭容器中,可逆反应 A(g)+B(g) ? xC(g) △H,满足左图所示,以下关于右图说法中正确的是( )P3>P4,y轴表示A的转化率
B. P3
B.达到平衡时A2的转化率大小为:B>A>C
C.若T2>T1,则正反应一定是放热反应
D.B点时,平衡体系中A、B原子数之比接近1∶3
D斜率意义——速率练8. 根据盐酸与大理石(足量)反应, V(CO2)-t关系图曲线,以下判断正确的是( )
若温度相同,①反应的盐酸浓度大于③反应,但H+物质的量相等。
②反应时H+的物质的量浓度最大
②与①的反应速率相等
反应速率由大到小顺序为①②③④AD时间/min练9.右图为实验室制备CO2的实验记录,V(CO2)-t正确的是:( )
A、OE段反应速率最快
B、EF段表示反应速率最快,收集到的CO2最多
C、FG段表示收集的CO2最多
D、OG段表示随着时间的推移,反应速率逐渐增快斜率意义——速率V(CO2)/mLB例9.某溶液中发生反应A ? 2B+C,VA-t 的关系如图,已知溶液的体积为2L,起始时体系中只有A,请回答下列问题:
1)图中阴影部分的面积表示0—2min内的正反应_______减小值,应小于_________。
2)2min时,B物质的量浓度的取值范围为:______________。面积意义——浓度1mol/L
C.物质的百分含量和温度关系如图C所示,则正反应为放热反应
D.反应速率和反应条件变化关系如图D所示,则该反应的正反应为放热反应,且A、B、C、D均为气体C练12.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(下图中,p表示压强,T表示温度,n表示物质的量,t表示反应时间):根据以上规律判断(填“>”“=”或“<”):
(1)反应Ⅰ:p2________p1,ΔH________0。
(2)反应Ⅱ:T1________T2,ΔH________0。
(3)反应Ⅲ:若T2________T1,ΔH________0。
(4)反应Ⅳ:若T2________T1,ΔH________0 ><><>>或< <>>或< <
