2019-2020学年第二学期人教版高二化学选修4课时突破:1.1 第一课时 焓变 反应热【要点透析、提升训练】
文档属性
| 名称 | 2019-2020学年第二学期人教版高二化学选修4课时突破:1.1 第一课时 焓变 反应热【要点透析、提升训练】 |

|
|
| 格式 | zip | ||
| 文件大小 | 373.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-08 00:00:00 | ||
图片预览




文档简介
选修4课时突破:
——焓变 反应热
【要点导学】
一、
1.焓变与反应热
(1)焓变
①焓(H):与内能有关的物理量。
②焓变(ΔH):生成物与反应物的焓值差,决定了某一化学反应是吸热反应还是放热反应。
(2)反应热
①概念:化学反应过程中所放出或吸收的能量。
②与焓变的关系:恒压条件下的反应热等于焓变,单位是kJ·mol-1。
(3)ΔH与吸热反应、放热反应的关系
②实例:
1 mol H2与0.5 mol O2完全反应生成1 mol液态水时放出285.8 kJ热量,则该反应的焓变ΔH=-285.8_kJ·mol-1。
2.化学反应中能量变化的原因
(1)微观角度
①化学反应的本质:
②化学键变化与反应热的关系:
若E1>E2,反应吸收能量,ΔH>0,为吸热反应;
若E1<E2,反应放出能量,ΔH<0,为放热反应。
(2)宏观角度
①内能与反应吸、放热
从物质内能上分析,如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时放出能量,这就是放热反应。反之,则为吸热反应。
②图示:
已知H2和Cl2在点燃的条件下生成HCl。下面是反应H2(g)+Cl2(g)===2HCl(g)的能量变化示意图。
[问题思考]
1.断裂1 mol H—H键、1 mol Cl—Cl键吸收的总能量是多少?形成2 mol H—Cl键放出的能量是多少?由此判断该反应的ΔH是多少?
提示:断键吸收的总能量为436 kJ+243 kJ=679 kJ。形成化学键放出的总能量为431 kJ×2=862 kJ。故H2(g)+Cl2(g)===2HCl(g)反应放出热量862 kJ-679 kJ=183 kJ,即反应的 ΔH=-183 kJ·mol-1。
2.根据图示中数据判断2HCl(g)===H2(g)+Cl2(g)的焓变ΔH是多少?与问题1中的ΔH相比,得出的结论是什么?
提示:ΔH=断裂化学键吸收的总能量-形成化学键放出的总能量=(431 kJ·mol-1×2)-(436 kJ·mol-1+243 kJ·mol-1)=+183 kJ·mol-1。正、逆反应的焓变(ΔH)数值相等,符号相反。
3.H2(g)和Cl2(g)在光照条件下也可以发生上述反应,那么该反应的ΔH是否发生变化?
提示:焓变不发生变化,ΔH仍为-183 kJ·mol-1;因为化学反应的焓变与反应条件无关。
1.焓变与反应热
项目 内容
概念 在恒压条件下,化学反应过程中所释放或吸收的能量,都可以用热量来表示,叫做反应热,又称焓变
符号 ΔH
单位 kJ·mol-1或kJ/mol
意义 ΔH<0表示该反应为放热反应ΔH>0表示该反应为吸热反应
注意事项 ①任何化学反应都有反应热,即焓变ΔH≠0②ΔH的大小与反应条件无关
2.ΔH的计算方法
(1)ΔH=反应物断键吸收的总能量-生成物成键释放的总能量。
(2)ΔH=生成物所具有的总能量-反应物所具有的总能量。
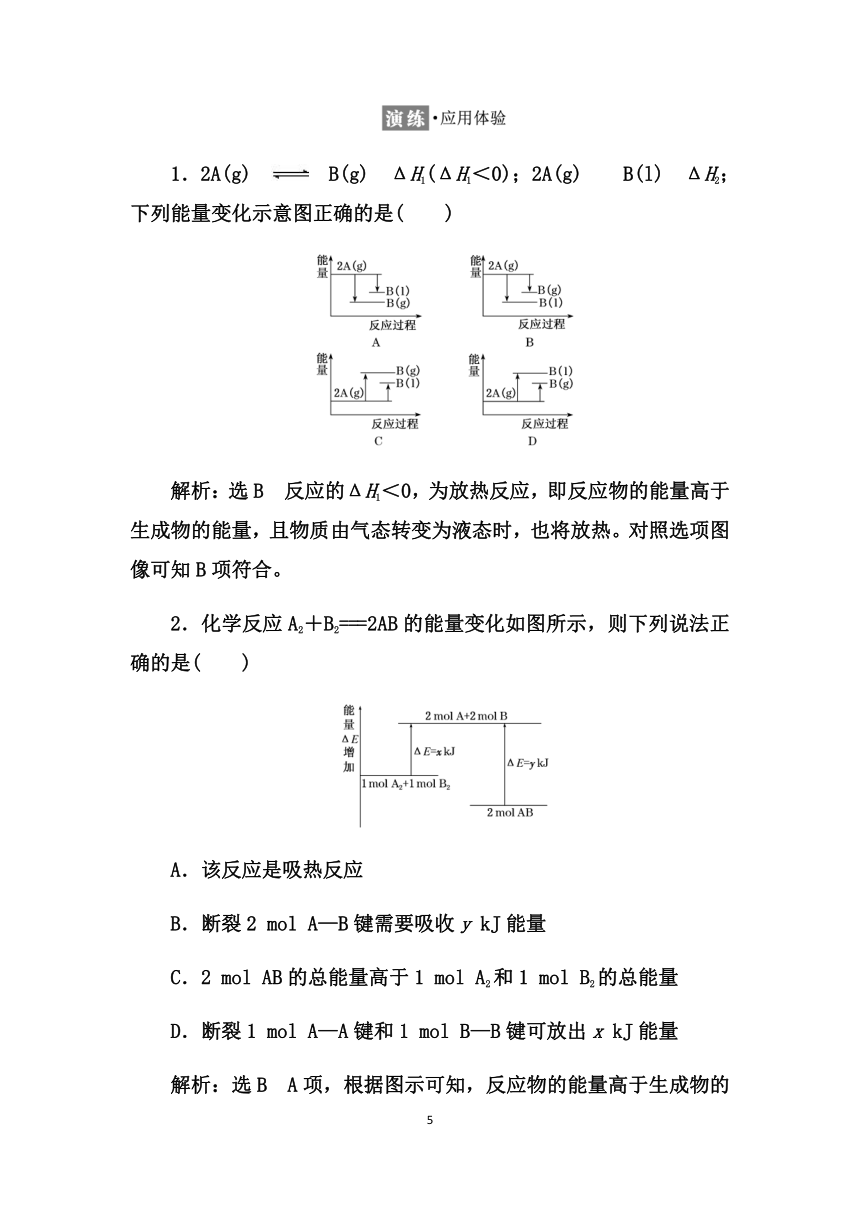
1.2A(g)??B(g) ΔH1(ΔH1<0);2A(g)??B(l) ΔH2;下列能量变化示意图正确的是( )
解析:选B 反应的ΔH1<0,为放热反应,即反应物的能量高于生成物的能量,且物质由气态转变为液态时,也将放热。对照选项图像可知B项符合。
2.化学反应A2+B2===2AB的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.断裂2 mol A—B键需要吸收y kJ能量
C.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
D.断裂1 mol A—A键和1 mol B—B键可放出x kJ能量
解析:选B A项,根据图示可知,反应物的能量高于生成物的能量,因此该反应是放热反应,错误;B项,根据图示可知,断裂2 mol A—B键需要吸收y kJ能量,正确;C项,由图可知,1 mol A2和1 mol B2的总能量高于2 mol AB的总能量,错误;D项,断裂1 mol A—A键和1 mol B—B键吸收x kJ能量,错误。
3.键能是两原子间形成1 mol新键(或其逆过程)时释放(或吸收)的能量。已知下列物质的键能:
化学键 H—H N N N—H
键能/(kJ·mol-1) 436 946 391
则反应:N2(g)+3H2(g)===2NH3(g)的ΔH=________________。
解析:ΔH=反应物断键吸收的总能量-生成物成键释放的总能量=946 kJ·mol-1+3×436 kJ·mol-1-6×391 kJ·mol-1=(2 254 kJ·mol-1-2 346 kJ·mol-1)=-92 kJ·mol-1。
答案:-92 kJ·mol-1
二、
1.放热反应和吸热反应的比较
项目 放热反应 吸热反应
定义 放出热量的化学反应 吸收热量的化学反应
表示方法 ΔH<0 ΔH>0
从化学键的角度分析 断裂旧化学键吸收的能量小于形成新化学键放出的能量 断裂旧化学键吸收的能量大于形成新化学键放出的能量
从物质能量的角度分析
2.判断吸热反应、放热反应的依据与误区
(1)吸热反应、放热反应判断的“两大依据”
理论依据:反应物与生成物总能量的相对大小。
计算依据:断裂化学键吸收总能量与形成化学键放出总能量的相对大小。
(2)吸热反应、放热反应判断的“两大误区”
误区一:与反应条件有关。
误区二:只要吸热就是吸热反应,只要放热就是放热反应。如水蒸气液化放出热量,但该过程不是放热反应。
1.下列说法正确的是( )
A.反应热就是反应中放出的热量
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+”
解析:选C 反应热也包括反应中吸收的热量,A错误;反应放热ΔH<0,反应吸热ΔH>0,B错误;在反应中生成物比反应物所具有的总能量小,反应就放热,反之就吸热,C正确;化学反应的实质是旧化学键的断裂,新化学键的形成,断键时吸收能量即反应物键能,成键时放热即生成物键能,后者大,则反应为放热反应,ΔH为“-”,D错误。
2.化学反应过程中的能量变化如图所示,判断以下说法正确的是( )
A.图甲表示的是吸热反应
B.图乙表示的是放热反应
C.图甲中ΔH>0
D.图乙中ΔH>0
解析:选D 由图像分析可知甲:E反应物>E生成物,反应放热,ΔH<0;乙:E反应物0。
3.下列变化中,属于吸热反应的是( )
①液态水汽化
②将胆矾加热变为白色粉末
③浓H2SO4稀释
④KClO3分解制O2
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解
⑦CO2+C2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C+H2O(g)CO+H2
⑩Al与盐酸反应
A.①②④⑥⑦⑧⑨ B.②④⑥⑦⑧⑨
C.①③④⑤⑥⑧⑩ D.①②④⑧⑨
解析:选B ①③属于物理变化,不属于化学反应。⑤是化合反应,CaO与水反应生成Ca(OH)2,产生大量热,属于放热反应。⑩金属与酸的反应一般为放热反应。
4.根据如图提供的信息,下列所得结论不正确的是( )
A.该反应为吸热反应
B.该反应一定有能量转化成了化学能
C.反应物比反应产物稳定
D.因为反应物的总能量低于反应产物的总能量,所以该反应需要加热才能发生
解析:选D 由图示可知反应物的总能量小于反应产物的总能量,反应过程中有能量转化成了化学能,为吸热反应;能量越低物质越稳定,所以反应物比反应产物稳定;部分吸热反应不需加热也能发生。
5.下列变化一定为放热的化学反应的是( )
A.H2O(g)===H2O(l)放出44 kJ热量
B.ΔH>0的化学反应
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应
解析:选D H2O(g)===H2O(l)为物理变化,A项错误;ΔH>0,反应吸收热量,B项错误;不知道断裂化学键时吸收能量的情况,无法确定反应是放热还是吸热,C项错误;由题图可知H(生成物)6.已知:
①4NH3(g)+3O2(g)===2N2(g)+6H2O(g)ΔH=-1 269 kJ·mol-1
下列说法正确的是( )
A.断开1 mol O—O键比断开1 mol N—N键所需能量少448 kJ
B.断开1 mol H—O键与断开1 mol H—N键所需能量相差约72.6 kJ
C.由以上键能的信息可知H2O的沸点比NH3高
D.由元素非金属性的强弱可知H—O键的稳定性比H—N键弱
解析:选B 根据②可知断开1 mol O===O键比断开1 mol NN键所需能量少448 kJ,A项错误;由已知得12E(H—N)+3×498 kJ·mol-1-2×946 kJ·mol-1-12E(H—O)=-1 269 kJ·mol-1,即E(H—O)-E(H—N)≈72.6 kJ·mol-1,所以断开1 mol H—O键与断开1 mol H—N键所需能量相差约72.6 kJ,B项正确;物质的沸点与键能大小无关,沸点与分子间作用力有关,C项错误;元素的非金属性越强,与H元素形成的化学键越稳定,由于非金属性:O>N,则H—O键比H—N键的稳定性强,D项错误。
7.我国自主研制的“天宫二号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2Si3N4+CO
该反应变化过程中的能量变化如图所示。回答以下问题。
(1)上述反应中的还原剂是________,其还原产物是________。
(2)该反应________(填“吸热”或“放热”),反应热ΔH________(填“>”“<”或“=”)0。
解析:(1)SiO2+C+N2Si3N4+CO,反应中碳元素的化合价由0升高到+2,氮元素的化合价由0降低到-3。故反应中的还原剂是C,还原产物为Si3N4。
(2)该反应过程中,反应物的总能量大于生成物的总能量,为放热反应,ΔH<0。
答案:(1)C Si3N4 (2)放热 <
——焓变 反应热
【要点导学】
一、
1.焓变与反应热
(1)焓变
①焓(H):与内能有关的物理量。
②焓变(ΔH):生成物与反应物的焓值差,决定了某一化学反应是吸热反应还是放热反应。
(2)反应热
①概念:化学反应过程中所放出或吸收的能量。
②与焓变的关系:恒压条件下的反应热等于焓变,单位是kJ·mol-1。
(3)ΔH与吸热反应、放热反应的关系
②实例:
1 mol H2与0.5 mol O2完全反应生成1 mol液态水时放出285.8 kJ热量,则该反应的焓变ΔH=-285.8_kJ·mol-1。
2.化学反应中能量变化的原因
(1)微观角度
①化学反应的本质:
②化学键变化与反应热的关系:
若E1>E2,反应吸收能量,ΔH>0,为吸热反应;
若E1<E2,反应放出能量,ΔH<0,为放热反应。
(2)宏观角度
①内能与反应吸、放热
从物质内能上分析,如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时放出能量,这就是放热反应。反之,则为吸热反应。
②图示:
已知H2和Cl2在点燃的条件下生成HCl。下面是反应H2(g)+Cl2(g)===2HCl(g)的能量变化示意图。
[问题思考]
1.断裂1 mol H—H键、1 mol Cl—Cl键吸收的总能量是多少?形成2 mol H—Cl键放出的能量是多少?由此判断该反应的ΔH是多少?
提示:断键吸收的总能量为436 kJ+243 kJ=679 kJ。形成化学键放出的总能量为431 kJ×2=862 kJ。故H2(g)+Cl2(g)===2HCl(g)反应放出热量862 kJ-679 kJ=183 kJ,即反应的 ΔH=-183 kJ·mol-1。
2.根据图示中数据判断2HCl(g)===H2(g)+Cl2(g)的焓变ΔH是多少?与问题1中的ΔH相比,得出的结论是什么?
提示:ΔH=断裂化学键吸收的总能量-形成化学键放出的总能量=(431 kJ·mol-1×2)-(436 kJ·mol-1+243 kJ·mol-1)=+183 kJ·mol-1。正、逆反应的焓变(ΔH)数值相等,符号相反。
3.H2(g)和Cl2(g)在光照条件下也可以发生上述反应,那么该反应的ΔH是否发生变化?
提示:焓变不发生变化,ΔH仍为-183 kJ·mol-1;因为化学反应的焓变与反应条件无关。
1.焓变与反应热
项目 内容
概念 在恒压条件下,化学反应过程中所释放或吸收的能量,都可以用热量来表示,叫做反应热,又称焓变
符号 ΔH
单位 kJ·mol-1或kJ/mol
意义 ΔH<0表示该反应为放热反应ΔH>0表示该反应为吸热反应
注意事项 ①任何化学反应都有反应热,即焓变ΔH≠0②ΔH的大小与反应条件无关
2.ΔH的计算方法
(1)ΔH=反应物断键吸收的总能量-生成物成键释放的总能量。
(2)ΔH=生成物所具有的总能量-反应物所具有的总能量。
1.2A(g)??B(g) ΔH1(ΔH1<0);2A(g)??B(l) ΔH2;下列能量变化示意图正确的是( )
解析:选B 反应的ΔH1<0,为放热反应,即反应物的能量高于生成物的能量,且物质由气态转变为液态时,也将放热。对照选项图像可知B项符合。
2.化学反应A2+B2===2AB的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.断裂2 mol A—B键需要吸收y kJ能量
C.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
D.断裂1 mol A—A键和1 mol B—B键可放出x kJ能量
解析:选B A项,根据图示可知,反应物的能量高于生成物的能量,因此该反应是放热反应,错误;B项,根据图示可知,断裂2 mol A—B键需要吸收y kJ能量,正确;C项,由图可知,1 mol A2和1 mol B2的总能量高于2 mol AB的总能量,错误;D项,断裂1 mol A—A键和1 mol B—B键吸收x kJ能量,错误。
3.键能是两原子间形成1 mol新键(或其逆过程)时释放(或吸收)的能量。已知下列物质的键能:
化学键 H—H N N N—H
键能/(kJ·mol-1) 436 946 391
则反应:N2(g)+3H2(g)===2NH3(g)的ΔH=________________。
解析:ΔH=反应物断键吸收的总能量-生成物成键释放的总能量=946 kJ·mol-1+3×436 kJ·mol-1-6×391 kJ·mol-1=(2 254 kJ·mol-1-2 346 kJ·mol-1)=-92 kJ·mol-1。
答案:-92 kJ·mol-1
二、
1.放热反应和吸热反应的比较
项目 放热反应 吸热反应
定义 放出热量的化学反应 吸收热量的化学反应
表示方法 ΔH<0 ΔH>0
从化学键的角度分析 断裂旧化学键吸收的能量小于形成新化学键放出的能量 断裂旧化学键吸收的能量大于形成新化学键放出的能量
从物质能量的角度分析
2.判断吸热反应、放热反应的依据与误区
(1)吸热反应、放热反应判断的“两大依据”
理论依据:反应物与生成物总能量的相对大小。
计算依据:断裂化学键吸收总能量与形成化学键放出总能量的相对大小。
(2)吸热反应、放热反应判断的“两大误区”
误区一:与反应条件有关。
误区二:只要吸热就是吸热反应,只要放热就是放热反应。如水蒸气液化放出热量,但该过程不是放热反应。
1.下列说法正确的是( )
A.反应热就是反应中放出的热量
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+”
解析:选C 反应热也包括反应中吸收的热量,A错误;反应放热ΔH<0,反应吸热ΔH>0,B错误;在反应中生成物比反应物所具有的总能量小,反应就放热,反之就吸热,C正确;化学反应的实质是旧化学键的断裂,新化学键的形成,断键时吸收能量即反应物键能,成键时放热即生成物键能,后者大,则反应为放热反应,ΔH为“-”,D错误。
2.化学反应过程中的能量变化如图所示,判断以下说法正确的是( )
A.图甲表示的是吸热反应
B.图乙表示的是放热反应
C.图甲中ΔH>0
D.图乙中ΔH>0
解析:选D 由图像分析可知甲:E反应物>E生成物,反应放热,ΔH<0;乙:E反应物
3.下列变化中,属于吸热反应的是( )
①液态水汽化
②将胆矾加热变为白色粉末
③浓H2SO4稀释
④KClO3分解制O2
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解
⑦CO2+C2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C+H2O(g)CO+H2
⑩Al与盐酸反应
A.①②④⑥⑦⑧⑨ B.②④⑥⑦⑧⑨
C.①③④⑤⑥⑧⑩ D.①②④⑧⑨
解析:选B ①③属于物理变化,不属于化学反应。⑤是化合反应,CaO与水反应生成Ca(OH)2,产生大量热,属于放热反应。⑩金属与酸的反应一般为放热反应。
4.根据如图提供的信息,下列所得结论不正确的是( )
A.该反应为吸热反应
B.该反应一定有能量转化成了化学能
C.反应物比反应产物稳定
D.因为反应物的总能量低于反应产物的总能量,所以该反应需要加热才能发生
解析:选D 由图示可知反应物的总能量小于反应产物的总能量,反应过程中有能量转化成了化学能,为吸热反应;能量越低物质越稳定,所以反应物比反应产物稳定;部分吸热反应不需加热也能发生。
5.下列变化一定为放热的化学反应的是( )
A.H2O(g)===H2O(l)放出44 kJ热量
B.ΔH>0的化学反应
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应
解析:选D H2O(g)===H2O(l)为物理变化,A项错误;ΔH>0,反应吸收热量,B项错误;不知道断裂化学键时吸收能量的情况,无法确定反应是放热还是吸热,C项错误;由题图可知H(生成物)
①4NH3(g)+3O2(g)===2N2(g)+6H2O(g)ΔH=-1 269 kJ·mol-1
下列说法正确的是( )
A.断开1 mol O—O键比断开1 mol N—N键所需能量少448 kJ
B.断开1 mol H—O键与断开1 mol H—N键所需能量相差约72.6 kJ
C.由以上键能的信息可知H2O的沸点比NH3高
D.由元素非金属性的强弱可知H—O键的稳定性比H—N键弱
解析:选B 根据②可知断开1 mol O===O键比断开1 mol NN键所需能量少448 kJ,A项错误;由已知得12E(H—N)+3×498 kJ·mol-1-2×946 kJ·mol-1-12E(H—O)=-1 269 kJ·mol-1,即E(H—O)-E(H—N)≈72.6 kJ·mol-1,所以断开1 mol H—O键与断开1 mol H—N键所需能量相差约72.6 kJ,B项正确;物质的沸点与键能大小无关,沸点与分子间作用力有关,C项错误;元素的非金属性越强,与H元素形成的化学键越稳定,由于非金属性:O>N,则H—O键比H—N键的稳定性强,D项错误。
7.我国自主研制的“天宫二号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2Si3N4+CO
该反应变化过程中的能量变化如图所示。回答以下问题。
(1)上述反应中的还原剂是________,其还原产物是________。
(2)该反应________(填“吸热”或“放热”),反应热ΔH________(填“>”“<”或“=”)0。
解析:(1)SiO2+C+N2Si3N4+CO,反应中碳元素的化合价由0升高到+2,氮元素的化合价由0降低到-3。故反应中的还原剂是C,还原产物为Si3N4。
(2)该反应过程中,反应物的总能量大于生成物的总能量,为放热反应,ΔH<0。
答案:(1)C Si3N4 (2)放热 <
