新人教版高中化学必修二2-1 化学能与热能(41张幻灯片)
文档属性
| 名称 | 新人教版高中化学必修二2-1 化学能与热能(41张幻灯片) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-08 00:00:00 | ||
图片预览







文档简介
(共41张PPT)
★ 能源、材料和信息技术被称为现代社会发展的三大支柱。
材料为人类的社会发展、科技进步、生产、生活、学习、研究……提供了物质基础,材料是社会发展和人类进步的一种标志。
开拓视野
由于信息技术在资料生产、科研教育、医疗保障、企业和政府管理以及家庭中的广泛应用,从而对经济和社会发展产生了巨大而深刻的影响,从根本上改变了人们的生活方式、行为方式和价值观念。以计算机、微电子、通信技术为主的信息技术革命是社会信息化的动力源泉。
人类从蛮荒、野蛮时代进入文明时代从发现用火开始,发现用火使人类改变了生食的习惯,从生食到熟食是人类发展史上一个重要的里程碑。能源为我们的生产、生活、学习、研究……提供了动力,可以说现代社会的一切活动都离不开能源,能源是人类赖以生存和发展的物质基础。
开拓视野
★ 人口激增、环境污染、能源短缺是现代社会面临的三大世界性难题。提高能源的利用率和开发新能源是解决能源短缺的两条有效途径,在这个过程中,化学起着其他自然科学不可替代 的作用。
引言
化学反应过程中伴随着能量的变化
◆提问
从化学键的角度来看,化学反应的实质是什么?
一个化学反应的的过程,本质上就是:
猜想与探究
一、化学反应中能量的变化
⒈化学键与化学反应中能量变化的关系(微观)
反应物分子内旧化学键断裂
产物分子中新化学键形成
的过程。
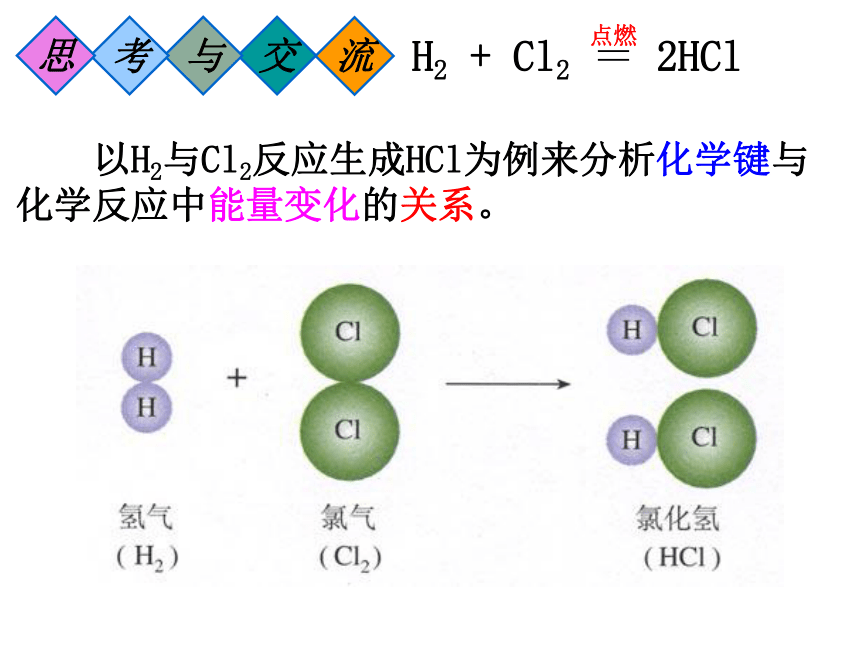
以H2与Cl2反应生成HCl为例来分析化学键与化学反应中能量变化的关系。
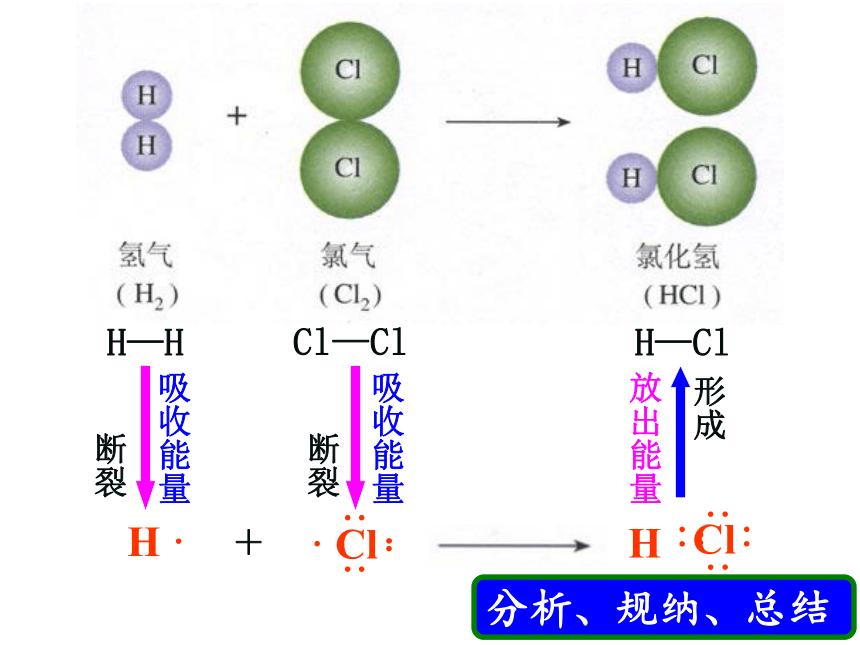
断裂
断裂
形成
吸收能量
吸收能量
+
放出能量
H ·
分析、规纳、总结
H—H
Cl—Cl
H—Cl
H
H
H
H
+
化学键断裂——吸收能量
H
H
+
H
H
化学键形成——放出能量
键能:
形成(或断裂)1mol化学键时释放(或吸收)的能量,称之为键能。
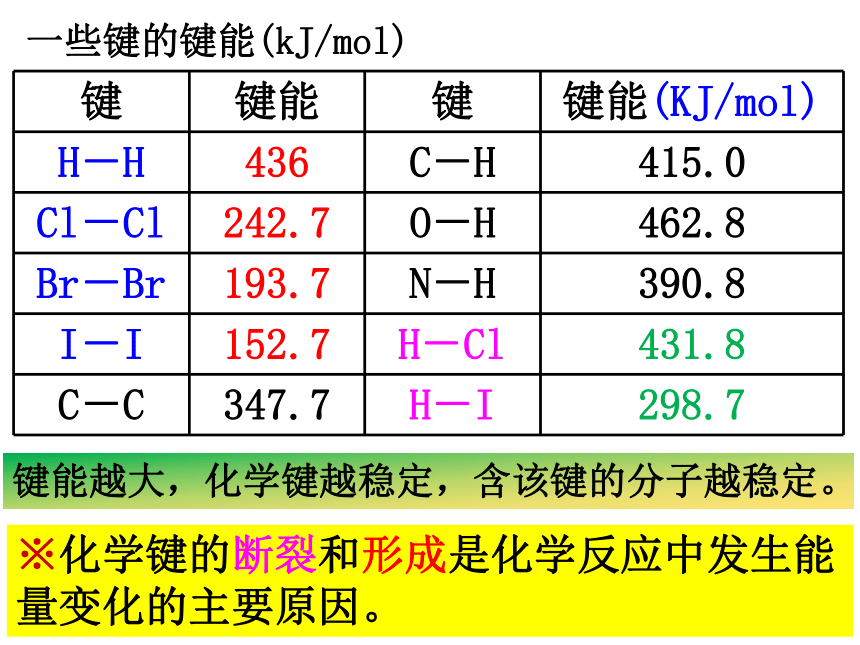
一些键的键能(kJ/mol)
键能越大,化学键越稳定,含该键的分子越稳定。
※化学键的断裂和形成是化学反应中发生能量变化的主要原因。
键 键能 键 键能(KJ/mol)
H-H 436 C-H 415.0
Cl-Cl 242.7 O-H 462.8
Br-Br 193.7 N-H 390.8
I-I 152.7 H-Cl 431.8
C-C 347.7 H-I 298.7
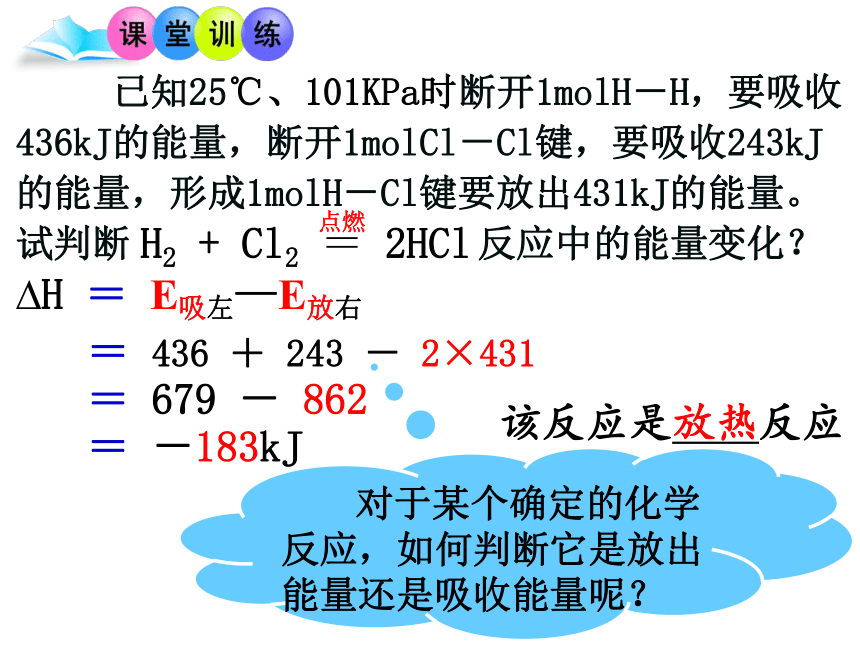
已知25℃、101KPa时断开1molH-H,要吸收436kJ的能量,断开1molCl-Cl键,要吸收243kJ的能量,形成1molH-Cl键要放出431kJ的能量。试判断 反应中的能量变化?
对于某个确定的化学反应,如何判断它是放出能量还是吸收能量呢?
= -183kJ
= 679 - 862
该反应是 反应
放热
?H = E吸左—E放右
= 436 + 243 - 2×431
E吸 > E放 化学反应吸收能量
E吸 < E放 化学反应放出能量
结论:
由上面的计算可知:
对于某个确定的化学反应,化学反应中能量的变化取决于旧键断裂时吸收的总能量E吸与新键形成时放出的总能量E放的相对大小。
?H = E吸左—E放右
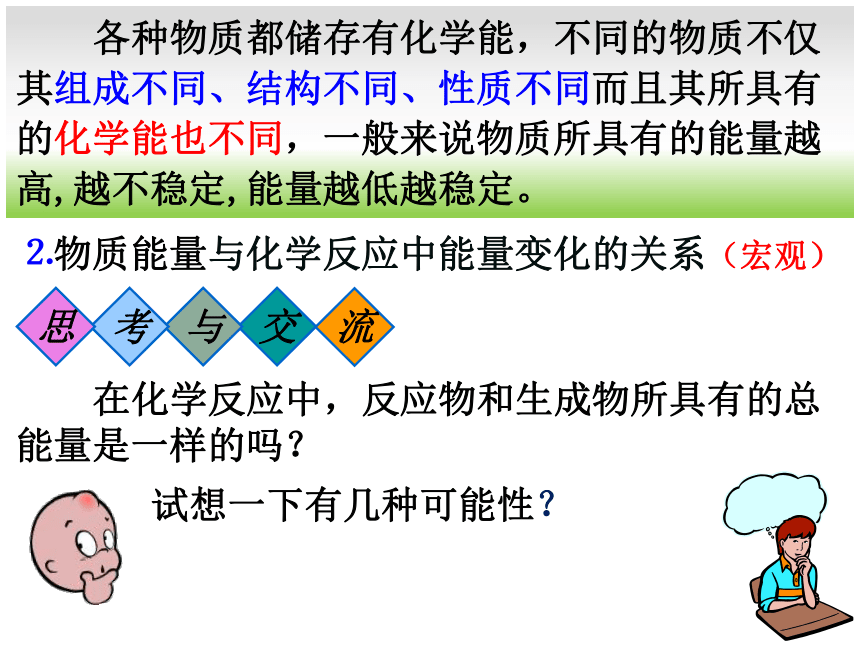
各种物质都储存有化学能,不同的物质不仅其组成不同、结构不同、性质不同而且其所具有的化学能也不同,一般来说物质所具有的能量越高,越不稳定,能量越低越稳定。
低
试想一下有几种可能性?
⒉物质能量与化学反应中能量变化的关系(宏观)
在化学反应中,反应物和生成物所具有的总能量是一样的吗?
从物质总能量的角度分析(宏观)
迁移、联想、结论
放出能量
化学反应放出能量
水由高处向低处流要释放能量(势能转化成动能)
从物质总能量的角度分析(宏观)
迁移、联想、结论
吸收能量
化学反应吸收能量
将水抽到高处需要提供能量(电能转化成机械能、再转化成势能)
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。 (宏观)
E总反应物>E总生成物 化学反应放出能量
E总反应物<E总生成物 化学反应吸收能量
结论:
物质发生化学反应时,除了有新物质生成(质的变化),同时还伴随着能量的变化(量的变化)。
物质发生化学反应时要遵守质量守恒定律。
能 量 的 转 化 形 式
能 量 的 转 化 遵 守 能 量 守 恒 定 律
能 量 的 转 化 遵 守 能 量 守 恒 定 律
能 量 的 转 化 遵 守 能 量 守 恒 定 律
物质发生化学反应,除了要遵守质量守恒定律(质的变化),同时还要遵守能量守恒定律(量的变化)。(两条基本定律)
化学反应中的能量变化,通常主要表现为热量的变化---吸热或者放热。
二、化学能与热能的相互转化
⑴ 放热反应:放出能(热)量的化学反应。
⑵ 吸热反应:吸收能(热)量的化学反应。
放热反应和吸热反应
在一支试管中加入2~3mL 6mol/L的盐酸,再插入用砂纸打磨光的铝条。
金属与酸反应是放热反应
Al与稀盐酸反应
⒈体验化学能与热能的相互转化
实验2-1
现象 结论
有大量气体放出,温度升高 该反应为放热反应 2Al+6HCl==2AlCl3+3H2↑
Ba(OH)2·8H2O与NH4Cl的反应
实验2-2
将约20gBa(OH)2·8H2O晶体研细后与约10gNH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的玻璃片上,用玻璃棒快速搅拌,闻气味,用手触摸烧杯壁下部,试着用手拿起烧杯,观察现象。
现象 结论
有刺激性气味的气体产生;玻璃片与烧杯底粘在了一起;用手触摸杯壁下部,有凉的感觉。混合物成糊状 该反应为吸热反应
结论:中和反应是放热反应。
实质:H+ + OH- = H2O
实验2-3
盐酸与氢氧化钠反应
该反应是放热反应
盐酸温度/℃ NaOH溶液温度/ ℃ 中和反应后温度/ ℃
室温 室温 反应后温度升高
强酸与强碱发生中和反应生成1molH2O时所释放的热量称为中和热。稀溶液中,强酸与强碱的中和热为定值:57.3 kJ/mol。
如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?应该如何设计并进行实验?
设计实验装置和操作时应从两个方面考虑:
一是注重“量”的问题。 二是尽量减小实验误差。
一是注重“量”的问题
⒈用稀溶液进行中和反应,减小溶解热的干扰。
⒉用强酸和强碱溶液反应,减少电离热效应的干扰;
⒊每次取等量的酸碱进行反应。
⒋做平行实验取平均值
二是尽量减小实验误差
⒈增强保温隔热措施,保温隔热的效果一定要好。⒉实验操作时动作要快,以尽量减少实验中热量的损失
⒊不断搅拌,使热量分散均匀。
⒋温度计的精确度要高。
如图所示: 在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,该实验也可在保温杯中进行。
中和热的测定 装置
探索与总结
常见的放热反应和吸热反应
放热反应
燃料的燃烧
中 和 反 应
活泼金属与水或酸的反应
大部分化合反应 (生石灰和水)
物质的缓慢氧化
吸热反应
C+CO2
H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
CaCO3高温分解
大部分分解反应
人类不但利用化学能转化为热能的原理来获取所需的热量进行生活、生产和科研。
⒉化学能的实际应用:
化学反应伴随着能量变化是化学反应的基本特征之一。化学物质中的化学能通过化学反应转化成热能,提供了人类生存和发展所需要的能量和动力;而热能转化为化学能又是人们进行化工生产、化学科学研究、研制新物质不可缺少的条件和途径。
⒊研究化学能与热能转化的意义:
化学家们也常常利用热能使很多化学反应得以发生,从而探索物质的组成、性质或制备所需的物质。
科学视野
生物体中的能量转化
人体内发生的氧化还原反应与体外的燃烧本质相同,最终产物一样(都是二氧化碳和水),都是放热反应,所放出的能量也相等。只是二者反应条件不同。
启示:
⒈通过生物体的作用可以实现各种能量的相互转化;
⒉通过生物体的作用实现各种能量的相互转化和利用更为合理、有效;
人对科学知识的掌握越多,对能源的利用(人均耗能)越多;
但是,人类在利用能源造福人类的同时,也造成了环境的污染。
能源的利用反映着人类进步,也促进人类的发展。
⒉人类利用能源的三个阶段
柴草时期
以树枝杂草为主要能源
中国古代制陶图
化石能源时期
以煤、石油、天然气为主要能源
汽车发动机汽缸中燃料燃烧
可再生能源、清洁能源
多能源结构时期
福 岛 核 电 站
常见的能源主要有以下十种:
太阳能、化石能源、水能、 风能、潮汐能、地热能、生物质能、核能以 及氢能。
为了保护我们的地球,应该减少化石燃料的使用,开发新技术,使燃料充分燃烧;努力开发无污染、可再生的洁净能源。
化学与社会发展和能源利用的关系
在过去,化学反应将能源转化为人类所需能量的过程中起着关键作用
化学在过去、现在和未来人类的能源利用和开发中始终都扮演着重要的角色
在未来多能源时期,氢能等、生物质能等的核心依旧是化学反应
核能、太阳能等的利用主要依靠化学所研制的新型材料
能量
反应进程
在25℃、101kPa条件下 H2 + Cl2 ═ 2HCl 反应为例
断开1molH-H键和1molCl-Cl键吸收的总能量为(436+243)kJ =679kJ
形成2mol H-Cl化学键放出的总能量为862kJ
1mol H2和1molCl2反应放出能量(862-679)kJ=183kJ
放出能量183kJ
点燃
1.微观:化学反应中能量变化的原因
——化学键的断裂和形成
放热反应:断开化学键吸收的总能量 形成化学键释放出的总能量。
小于
音乐喷泉
H
Cl
Cl
H
②断开化学键吸收的总能量 形成化学键释放出的总能量,反应吸收能量。
能量
反应进程
大于
1.化学键的断裂和形成是化学反应中能量变化的主要原因。
2.化学反应中的能量变化决定于反应物的总能量与生成物的总能量的相对大小。
E总反应物>E总生成物 化学反应放出能量
E总反应物<E总生成物 化学反应吸收能量
E总断裂>E总形成 化学反应吸收能量
E总断裂<E总形成 化学反应放出能量
★ 能源、材料和信息技术被称为现代社会发展的三大支柱。
材料为人类的社会发展、科技进步、生产、生活、学习、研究……提供了物质基础,材料是社会发展和人类进步的一种标志。
开拓视野
由于信息技术在资料生产、科研教育、医疗保障、企业和政府管理以及家庭中的广泛应用,从而对经济和社会发展产生了巨大而深刻的影响,从根本上改变了人们的生活方式、行为方式和价值观念。以计算机、微电子、通信技术为主的信息技术革命是社会信息化的动力源泉。
人类从蛮荒、野蛮时代进入文明时代从发现用火开始,发现用火使人类改变了生食的习惯,从生食到熟食是人类发展史上一个重要的里程碑。能源为我们的生产、生活、学习、研究……提供了动力,可以说现代社会的一切活动都离不开能源,能源是人类赖以生存和发展的物质基础。
开拓视野
★ 人口激增、环境污染、能源短缺是现代社会面临的三大世界性难题。提高能源的利用率和开发新能源是解决能源短缺的两条有效途径,在这个过程中,化学起着其他自然科学不可替代 的作用。
引言
化学反应过程中伴随着能量的变化
◆提问
从化学键的角度来看,化学反应的实质是什么?
一个化学反应的的过程,本质上就是:
猜想与探究
一、化学反应中能量的变化
⒈化学键与化学反应中能量变化的关系(微观)
反应物分子内旧化学键断裂
产物分子中新化学键形成
的过程。
以H2与Cl2反应生成HCl为例来分析化学键与化学反应中能量变化的关系。
断裂
断裂
形成
吸收能量
吸收能量
+
放出能量
H ·
分析、规纳、总结
H—H
Cl—Cl
H—Cl
H
H
H
H
+
化学键断裂——吸收能量
H
H
+
H
H
化学键形成——放出能量
键能:
形成(或断裂)1mol化学键时释放(或吸收)的能量,称之为键能。
一些键的键能(kJ/mol)
键能越大,化学键越稳定,含该键的分子越稳定。
※化学键的断裂和形成是化学反应中发生能量变化的主要原因。
键 键能 键 键能(KJ/mol)
H-H 436 C-H 415.0
Cl-Cl 242.7 O-H 462.8
Br-Br 193.7 N-H 390.8
I-I 152.7 H-Cl 431.8
C-C 347.7 H-I 298.7
已知25℃、101KPa时断开1molH-H,要吸收436kJ的能量,断开1molCl-Cl键,要吸收243kJ的能量,形成1molH-Cl键要放出431kJ的能量。试判断 反应中的能量变化?
对于某个确定的化学反应,如何判断它是放出能量还是吸收能量呢?
= -183kJ
= 679 - 862
该反应是 反应
放热
?H = E吸左—E放右
= 436 + 243 - 2×431
E吸 > E放 化学反应吸收能量
E吸 < E放 化学反应放出能量
结论:
由上面的计算可知:
对于某个确定的化学反应,化学反应中能量的变化取决于旧键断裂时吸收的总能量E吸与新键形成时放出的总能量E放的相对大小。
?H = E吸左—E放右
各种物质都储存有化学能,不同的物质不仅其组成不同、结构不同、性质不同而且其所具有的化学能也不同,一般来说物质所具有的能量越高,越不稳定,能量越低越稳定。
低
试想一下有几种可能性?
⒉物质能量与化学反应中能量变化的关系(宏观)
在化学反应中,反应物和生成物所具有的总能量是一样的吗?
从物质总能量的角度分析(宏观)
迁移、联想、结论
放出能量
化学反应放出能量
水由高处向低处流要释放能量(势能转化成动能)
从物质总能量的角度分析(宏观)
迁移、联想、结论
吸收能量
化学反应吸收能量
将水抽到高处需要提供能量(电能转化成机械能、再转化成势能)
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。 (宏观)
E总反应物>E总生成物 化学反应放出能量
E总反应物<E总生成物 化学反应吸收能量
结论:
物质发生化学反应时,除了有新物质生成(质的变化),同时还伴随着能量的变化(量的变化)。
物质发生化学反应时要遵守质量守恒定律。
能 量 的 转 化 形 式
能 量 的 转 化 遵 守 能 量 守 恒 定 律
能 量 的 转 化 遵 守 能 量 守 恒 定 律
能 量 的 转 化 遵 守 能 量 守 恒 定 律
物质发生化学反应,除了要遵守质量守恒定律(质的变化),同时还要遵守能量守恒定律(量的变化)。(两条基本定律)
化学反应中的能量变化,通常主要表现为热量的变化---吸热或者放热。
二、化学能与热能的相互转化
⑴ 放热反应:放出能(热)量的化学反应。
⑵ 吸热反应:吸收能(热)量的化学反应。
放热反应和吸热反应
在一支试管中加入2~3mL 6mol/L的盐酸,再插入用砂纸打磨光的铝条。
金属与酸反应是放热反应
Al与稀盐酸反应
⒈体验化学能与热能的相互转化
实验2-1
现象 结论
有大量气体放出,温度升高 该反应为放热反应 2Al+6HCl==2AlCl3+3H2↑
Ba(OH)2·8H2O与NH4Cl的反应
实验2-2
将约20gBa(OH)2·8H2O晶体研细后与约10gNH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的玻璃片上,用玻璃棒快速搅拌,闻气味,用手触摸烧杯壁下部,试着用手拿起烧杯,观察现象。
现象 结论
有刺激性气味的气体产生;玻璃片与烧杯底粘在了一起;用手触摸杯壁下部,有凉的感觉。混合物成糊状 该反应为吸热反应
结论:中和反应是放热反应。
实质:H+ + OH- = H2O
实验2-3
盐酸与氢氧化钠反应
该反应是放热反应
盐酸温度/℃ NaOH溶液温度/ ℃ 中和反应后温度/ ℃
室温 室温 反应后温度升高
强酸与强碱发生中和反应生成1molH2O时所释放的热量称为中和热。稀溶液中,强酸与强碱的中和热为定值:57.3 kJ/mol。
如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?应该如何设计并进行实验?
设计实验装置和操作时应从两个方面考虑:
一是注重“量”的问题。 二是尽量减小实验误差。
一是注重“量”的问题
⒈用稀溶液进行中和反应,减小溶解热的干扰。
⒉用强酸和强碱溶液反应,减少电离热效应的干扰;
⒊每次取等量的酸碱进行反应。
⒋做平行实验取平均值
二是尽量减小实验误差
⒈增强保温隔热措施,保温隔热的效果一定要好。⒉实验操作时动作要快,以尽量减少实验中热量的损失
⒊不断搅拌,使热量分散均匀。
⒋温度计的精确度要高。
如图所示: 在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,该实验也可在保温杯中进行。
中和热的测定 装置
探索与总结
常见的放热反应和吸热反应
放热反应
燃料的燃烧
中 和 反 应
活泼金属与水或酸的反应
大部分化合反应 (生石灰和水)
物质的缓慢氧化
吸热反应
C+CO2
H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
CaCO3高温分解
大部分分解反应
人类不但利用化学能转化为热能的原理来获取所需的热量进行生活、生产和科研。
⒉化学能的实际应用:
化学反应伴随着能量变化是化学反应的基本特征之一。化学物质中的化学能通过化学反应转化成热能,提供了人类生存和发展所需要的能量和动力;而热能转化为化学能又是人们进行化工生产、化学科学研究、研制新物质不可缺少的条件和途径。
⒊研究化学能与热能转化的意义:
化学家们也常常利用热能使很多化学反应得以发生,从而探索物质的组成、性质或制备所需的物质。
科学视野
生物体中的能量转化
人体内发生的氧化还原反应与体外的燃烧本质相同,最终产物一样(都是二氧化碳和水),都是放热反应,所放出的能量也相等。只是二者反应条件不同。
启示:
⒈通过生物体的作用可以实现各种能量的相互转化;
⒉通过生物体的作用实现各种能量的相互转化和利用更为合理、有效;
人对科学知识的掌握越多,对能源的利用(人均耗能)越多;
但是,人类在利用能源造福人类的同时,也造成了环境的污染。
能源的利用反映着人类进步,也促进人类的发展。
⒉人类利用能源的三个阶段
柴草时期
以树枝杂草为主要能源
中国古代制陶图
化石能源时期
以煤、石油、天然气为主要能源
汽车发动机汽缸中燃料燃烧
可再生能源、清洁能源
多能源结构时期
福 岛 核 电 站
常见的能源主要有以下十种:
太阳能、化石能源、水能、 风能、潮汐能、地热能、生物质能、核能以 及氢能。
为了保护我们的地球,应该减少化石燃料的使用,开发新技术,使燃料充分燃烧;努力开发无污染、可再生的洁净能源。
化学与社会发展和能源利用的关系
在过去,化学反应将能源转化为人类所需能量的过程中起着关键作用
化学在过去、现在和未来人类的能源利用和开发中始终都扮演着重要的角色
在未来多能源时期,氢能等、生物质能等的核心依旧是化学反应
核能、太阳能等的利用主要依靠化学所研制的新型材料
能量
反应进程
在25℃、101kPa条件下 H2 + Cl2 ═ 2HCl 反应为例
断开1molH-H键和1molCl-Cl键吸收的总能量为(436+243)kJ =679kJ
形成2mol H-Cl化学键放出的总能量为862kJ
1mol H2和1molCl2反应放出能量(862-679)kJ=183kJ
放出能量183kJ
点燃
1.微观:化学反应中能量变化的原因
——化学键的断裂和形成
放热反应:断开化学键吸收的总能量 形成化学键释放出的总能量。
小于
音乐喷泉
H
Cl
Cl
H
②断开化学键吸收的总能量 形成化学键释放出的总能量,反应吸收能量。
能量
反应进程
大于
1.化学键的断裂和形成是化学反应中能量变化的主要原因。
2.化学反应中的能量变化决定于反应物的总能量与生成物的总能量的相对大小。
E总反应物>E总生成物 化学反应放出能量
E总反应物<E总生成物 化学反应吸收能量
E总断裂>E总形成 化学反应吸收能量
E总断裂<E总形成 化学反应放出能量
