鲁教版初中化学九年级下册第八单元《海水中的化学》测试题(含答案)
文档属性
| 名称 | 鲁教版初中化学九年级下册第八单元《海水中的化学》测试题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 232.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-08 09:39:34 | ||
图片预览




文档简介
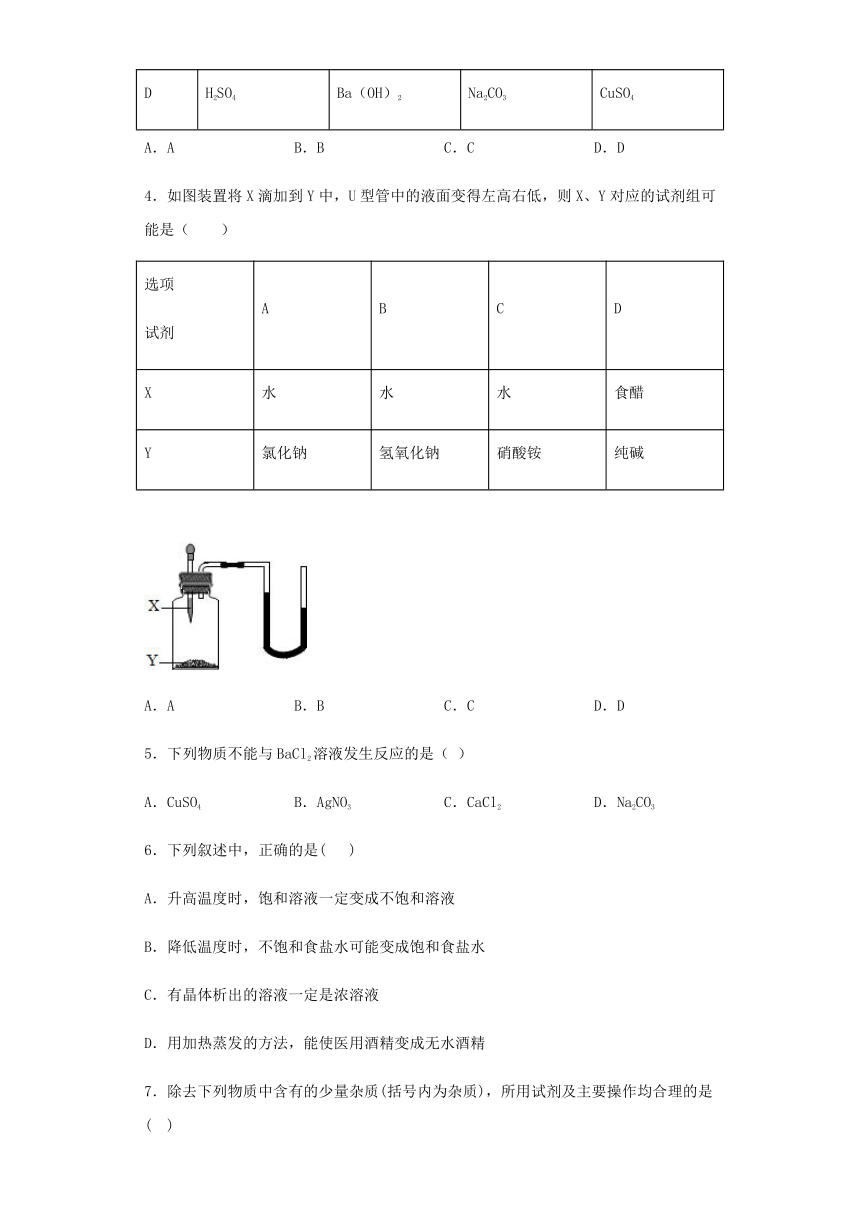
第八单元《海水中的化学》测试题
一、单选题(每小题只有一个正确答案)
1.下列各组离子在pH=13的无色溶液中能大量共存的是( )
A.K+、MnO4﹣、CO32﹣ B.Ba2+、K+、NO3﹣
C.NH4+、Na+、SO42﹣ D.Ag+、Cl﹣、NO3﹣
2.下列实验方案不正确的是
A.从海水中获得少量饮用水,可采用蒸馏的方法
B.从氯化钠溶液中获得氯化钠晶体,可采用直接过滤的方法
C.除去氯化钠溶液中的少量碳酸钠,可加入适量稀盐酸
D.检验某井水是否为硬水,可使用肥皂水
3.下图表示相连线的酸、碱、盐之间可以发生复分解反应,下表提供的四组物质符合下图要求的是( )
物质组别 酸 碱 盐1 盐2
A H2SO4 Ca(OH)2 BaCl2 Na2CO3
B H2SO4 Ca(OH)2 Na2CO3 BaCl2
C HCl NaOH Na2CO3 BaCl2
D H2SO4 Ba(OH)2 Na2CO3 CuSO4
A.A B.B C.C D.D
4.如图装置将X滴加到Y中,U型管中的液面变得左高右低,则X、Y对应的试剂组可能是( )
选项试剂 A B C D
X 水 水 水 食醋
Y 氯化钠 氢氧化钠 硝酸铵 纯碱
A.A B.B C.C D.D
5.下列物质不能与BaCl2溶液发生反应的是( )
A.CuSO4 B.AgNO3 C.CaCl2 D.Na2CO3
6.下列叙述中,正确的是(? )
A.升高温度时,饱和溶液一定变成不饱和溶液
B.降低温度时,不饱和食盐水可能变成饱和食盐水
C.有晶体析出的溶液一定是浓溶液
D.用加热蒸发的方法,能使医用酒精变成无水酒精
7.除去下列物质中含有的少量杂质(括号内为杂质),所用试剂及主要操作均合理的是( )
A.CO2(HCl)将混合气体通过NaOH溶液,干燥
B.Cu(CuO)加入适量的稀硫酸,过滤
C.NaNO3溶液(Na2SO4)加入过量的Ba(NO3)2溶液,过滤
D.NaOH溶液(Na2CO3):加入适量的CaCl2溶液,过滤
8.除去下列物质中的少量杂质,所选用的试剂或操作方法合理的是( )
选项 物质 杂质 试剂 操作方法
A 铁粉 铜粉 足量的稀硫酸 过滤
B 氯化亚铁溶液 氯化铜 过量的锌粉 过滤
C 氮气 水蒸气 足量生石灰 通过盛生石灰的干燥管
D 氯化钠溶液 氯化钙 过量碳酸钠溶液 过滤
A.A B.B C.C D.D
9.下列各组括号内除杂质的方法或试剂错误的是( ? ?)
A.盐酸中混有硫酸(氯化钡溶液) B.CO中混有CO2(NaOH溶液)
C.CaO中混有CaCO3(稀盐酸) D.氯化钙中混有稀盐酸(碳酸钙)
10.下列酸碱盐之间的转化不能一步完成的是
A.Fe(OH)3→Fe2(SO4)3 B.H2SO4→CuSO4 C.Na2CO3→NaOH D.BaSO4→Ba(NO3)2
11.除去下列物质中含有的少量杂质,所用试剂和方法都正确的是( )
选项 物质(括号内为杂质) 试 剂 操作方法
A CaO(K2CO3粉末) 加足量的水 搅拌、过滤
B CO2气体(HCl气体) 硝酸银水溶液 通过洗气瓶
C Zn粉末(FeCl2粉末) 加足量的水 溶解、过滤
D CuSO4溶液(稀H2SO4) 过量氧化铜 过滤
A.A B.B C.C D.D
12.如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
A.t1℃时,甲、乙两种物质的溶液中溶质的质量分数相等
B.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多
C.t2℃时,将40g甲物质加入50g水中.充分溶解后溶液的质量为90g
D.甲物质中含有少量的乙杂质,要提纯甲物质可以采用降温结晶
13.除去下列各组物质中的杂质,所用的试剂和方法均正确的是
物质 杂质 除杂所用的试剂和方法
A CO2 HCl气体 先通过足量NaOH溶液,再通过浓硫酸
B NaNO3溶液 Na2SO4 加过量Ba(NO3) 2溶液,过滤
C CO2气体 CO气体 点燃
D KCl固体 CaCO3固体 加水溶解、过滤、蒸发结晶
A.A B.B C.C D.D
14.某公司生产的融雪剂由NaCl、NaNO3、MgCl2、CuSO4中的两种物质组成。小明为探究其成分设计并完成下列实验,判断错误的是
A.一定含有NaCl B.一定含有MgCl2
C.可能含有NaNO3 D.一定不含有CuSO4
15.下列物质的溶液,不另加试剂就不能鉴别出来的一组是
A.CuSO4、BaCl2、H2SO4 B.Na2CO3、Ca(NO3)2、HCl
C.Na2SO4、KNO3、HCl D.FeCl3、NaOH、 KMnO4
二、填空题
16.下表是氯化钾和硝酸钾在不同温度下的溶解度。根据表中数据,请回答下列问题:
温度/°C 0 20 40 60 80 100
溶解度/g KNO3 13.3 31.6 63.9 110 169 246
KCl 27.6 34.0 40.0 45.5 51.1 56.7
(1)在所示的坐标纸上绘制出氯化钾的溶解度曲线______________。
(2)比较两种物质的溶解度曲线,溶解度受温度影响变化较小的是______________,温度大约在___________°C时,两种物质的溶解度大小相等。
(3)60°C时,105g的KNO3饱和溶液中含有的溶质的质量为____________。
(4)40°C时,向烧杯中加入50g水和25gKCl固体,充分溶解后得到的溶液是_____________(填“饱和”或“不饱和”)溶液,其溶质质量分数为_____________(精确到0.1% )。
(5)若KNO3中混有少量的KCl ,提纯KNO3的方法是_____________。
17.(1)在初中化学学习中,我们亲身经历了很多的科学探究活动。若按照是否“用数量表示资料或信息”可将实验分为:定性实验和定量实验。据此可将下列探究活动中的_________(填字母)归为一类,你的依据是__________。
A比较合金和纯金属的硬度 B 6B铅笔芯连入电路,接通电源 C用pH试纸测定雨水的pH D测定空气中氧气含量
(2)酸碱盐之间发生复分解反应的条件是生成物中有沉淀或气体或水生成。
根据下列复分解反应的微观实质:
反应的微观离子方程式:H++OH-=H2O
反应的微观离子方程式:CO32-+Ba2+=BaCO3↓
请你写出氯化铵和氢氧化钙反应的方程式:______。反应的微观离子方程式:______。
18.既能加快固体在水中溶解,又能改变固体的溶解度的操作措施是_____.
19.分类、类比是初中化学常用的学习方法,分析和处理信息的能力也是学生必备的.
(1)不同物质根据不同标准,可以有不同的分类,如根据用途、状态、性质、组成、构成等,对物质进行分类.根据所学知识,自拟分类标准,对以下物质进行分类①氯化钠 ②碳酸钠 ③氧化铁 ④氧化镁 ⑤氧化铜 ⑥硫酸钠 分类标准:分类标准为_____,共包括三种物质为_____(填序号).
(2)酸碱盐之间可以发生复分解反应,酸可以与盐发生复分解反应,如硝酸银和盐酸发生反应的化学方程式:AgNO3+HCl=AgCl↓+HNO3.根据上述规律,写出氢硫酸(H2S)与硫酸铜溶液反应的化学方程式_____ ,反应前前硫元素的化合价分别是_____.
20.甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:
(1)三种物质中_____的溶解度随温度变化趋势与气体溶解度的变化相似(填“甲”或“乙”或“丙”)
(2)将t2℃时甲,乙两物质饱和溶液分别蒸发等质量的水,析出固体的质量甲____乙(填“>”或“<”或“=”)
(3)当甲中混有少量乙时,可采用______的方法提纯甲
(4)将t2℃时等质量的甲、乙、丙三种物质的饱和溶液同时降温至t1℃,所得溶液中溶剂质量由小到大的顺序为_______。
三、推断题
21.工业上分别以大理石和赤铁矿为主要原料制取B和G,其转化关系如下图所示,已知D、G为单质。
回答下列问题:
(1)B、D、G的化学式,分别是:B____,D____,G____.
(2)写出反应③的化学方程式:________________________
22.如图是一些常见物质间相互转化的关系图,“→”指向生成物(部分反应条件略去).图中A、B均为无色气体,X是有毒的气体,Y是导致温室效应的主要气体,C是常见的红色金属单质.
(1)根据上述判断A的化学式是________.
(2)写出黑色固体D与稀硫酸反应的化学反应方程式________________.
(3)上述反应中涉及到的基本反应类型有________种.
四、实验题
23.某班分组进行粗盐提纯实验,步骤见下图,请回答:
(1)实验室称量固体的仪器常用电子天平,若需直接显示所称固体的质量,在放称量纸或烧杯后,需要进行____________操作(填“校正”“归零”“去皮”)。
(2)操作ⅢI、V、V中都用到的玻璃仪器是 ____________,该仪器在操作IV中的作用是_________.
(3)粗盐提纯实验步骤较多、操作烦琐,可以缩短粗盐提纯实验时间的操作的是________
A 研碎粗盐 B 溶解时多加一倍的水
(4)操作V蒸发,为防止蒸发皿中的液滴飞溅,应采取的措施是___________;当蒸发皿中出现大量晶体时,应___________,利用________将水分蒸干。
(5)某同学过滤完后发现滤液依然浑浊,除了滤纸可能破损以外,请你再写出一种造成滤液浑浊的原因________
(6)以下混合物能用“溶解-过滤”操作进行分离的是_______
A 食盐和白糖 B 食盐和细沙 C 食盐和味精 D 豆油和水
(7)各小组的产率及评价如下:
组别 1 2 3 4
产率 75% 83% 88% 72%
教师对产率的评价 偏低 偏高 偏高 偏低
下列各组同学对造成产率偏高或偏低的原因分析,正确的是__________(填编号).
A.第1组:烧杯里的食盐未溶解完就开始过滤
B.第2组:蒸发时,有固体物质飞溅
C.第3组:滤液浑浊就开始蒸发
D.第4组:蒸发后,精盐中还有水分
24.同学们在学习溶液时,老师用固体M做了如下实验,图一中甲、乙、丙、丁是充分搅拌后静置后的现象,请回答相关问题(忽略水的挥发):
(1)上述烧杯中,溶液质量最大的是_____(填序号);
(2)根据上述实验,可以判断物质M的溶解度曲线是图二对应的_____(填序号);
(3)据图二分析,要使30℃A、B、C三种物质的饱和溶液降温到10℃,所得溶液中溶质的质量分数由大到小的顺序为_____。
五、计算题
25.实验室有一包白色粉末,设计实验初步证明白色粉末A的成分都是碳酸钠和氯化钠的混合物。有关数据如图所示:
(1)写出题中发生反应的化学方程式_____;
(2)反应生成气体的质量_____;
(3)根据已知条件列出A中参加反应的固体质量(x)的比例式_____;
(4)A固体中两种成分质量比为_____;
(5)溶液B中碳酸钠溶质的质量分数为_____;
(6)若需质量分数为10%的C溶液,则需蒸发水_____。
26.某同学用自制电解器电解水,为了加快电解速率,可在水中加少许硫酸钠增强其导电性,当他在93.6g质量分数为5%的硫酸钠溶液中通电一段时间后,正极上产生3.2g氧气,请计算:
(1)水中氢元素与氧元素的质量比是_____________________________;通电电解水反应前,原硫酸钠溶液中溶质的质量为______________________________g。
(2)求通电电解水反应后溶液中硫酸钠的质量分数____________________________ (写出计算过程)
参考答案
1.B 2.B 3.D 4.C 5.C 6.B 7.B 8.C 9.C 10.D 11.D 12.D 13.D 14.A 15.C 16. 氯化钾 22(其他合理答案均可) 55 g 饱和 28.6% 降温结晶(或冷却热饱和溶液)
17.AB(或CD) 都是定性实验(或都是定量实验)
18.加热
19.氧化物 ③④⑤ H2S+CuSO4=CuS↓+H2SO4 -2价和+6价
20.丙 大于 降温结晶 (冷却热饱和溶液) 甲乙丙
21.(1)CaO C Fe;(2)3CO+ Fe2O3高温2Fe + 3CO2
22.H2 CuO+H2SO4=CuSO4+H2O 3
23.去皮 玻璃棒 引流 A 用玻璃棒搅拌,使受热均匀,防止液滴飞溅 停止加热 余热 待滤液液面高度高于滤纸边缘(其他答案合理均可) B AC
24.丁 A B>A>C
25.Na2CO3+2HCl═2NaCl+H2O+CO2↑ 4.4g 53:22 10% 40.6
26.1:8 4.68g 5.2%
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
