人教版高一化学必修2第一章第一节《元素周期表》碱金属 卤素(28张ppt)
文档属性
| 名称 | 人教版高一化学必修2第一章第一节《元素周期表》碱金属 卤素(28张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 579.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-08 00:00:00 | ||
图片预览








文档简介
(共28张PPT)
第一节 元素周期表
第二课时:元素的性质与原子结构
第一章 物质结构 元素周期律
学习目标
1.了解碱金属、卤素在周期表中的位置。
2.了解碱金属、卤素原子结构特点,了解原子结构与元素性质的关系。
3.了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理论解释。
H ⅢA ⅣA ⅤA ⅥA ⅦA
Li Be B C N O F
Na Mg Al Si P S Cl
K Ca Ga Ge As Se Br
Rb Sr In Sn Sb Te I
Cs Ba Tl Pb Bi Po At
Fr Ra
ⅠA
ⅡA
1
2
3
4
5
6
7
主族元素表
科学探究:完成课本第5页的表.
我们把第ⅠA 族称为碱金属族,为什么要把它们编在一个族呢?请同学们画出碱金属的原子结构示意图,比较碱金属原子结构的共同之处 。
思考与交流
1、碱金属元素的原子结构
元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数
碱金属 锂
钠
钾
铷
铯
2
1
Li
3
1
3
Na
11
1
4
K
19
1
5
Rb
37
1
6
Cs
55
它们的原子结构的相似和不同?
相同点: 最外层电子数均为1,
易失电子,有金属性
第ⅠA族金属元素
55Cs
3Li
11Na
19K
37Rb
不同点:电子层数递增,
原子半径逐渐增大
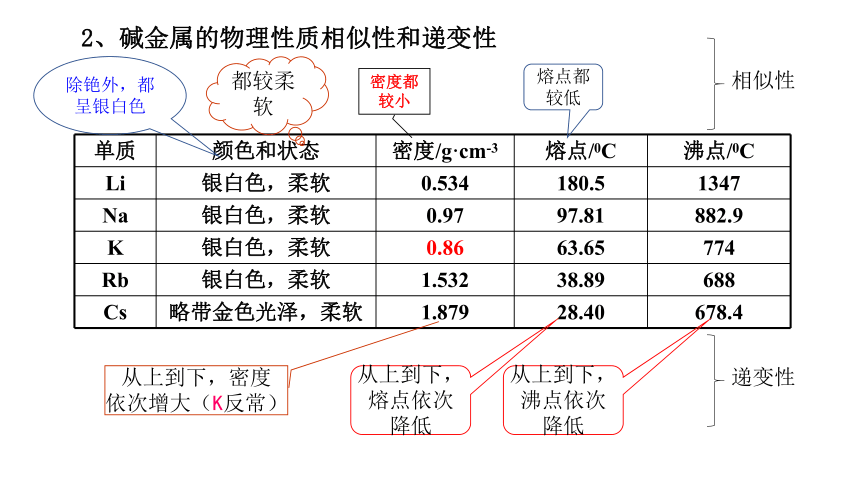
2、碱金属的物理性质相似性和递变性
单质 颜色和状态 密度/g·cm-3 熔点/0C 沸点/0C
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金色光泽,柔软 1.879 28.40 678.4
除铯外,都呈银白色
都较柔软
密度都较小
熔点都较低
相似性
从上到下,密度依次增大(K反常)
从上到下,熔点依次降低
从上到下,沸点依次降低
递变性
K + O2 === KO2 (超氧化钾)
点燃
Rb、Cs与O2反应更剧烈,产物更复杂。
(1)与 O2反应
点燃
4Li + O2 === 2Li2O
点燃
2Na + O2 === Na2O2
( ★ Li的燃烧产物只有一种)
3、碱金属的化学性质的比较
科学探究P教6
元素 条件 现象 产物 结论
Li
Na 加热 先熔化成小球,后燃烧,火焰呈黄色,生成淡黄色固体。 Na2O2
K 稍加热 先熔化成小球,后燃烧,反应比钠剧烈,产生紫色火焰。 更复杂的氧化物KO2
Rb
Cs
与非金属的反应(以O2为例)
从Li—Cs,随电子层数的递增,还原性(金属性)逐渐增强。
加热
燃烧,较不剧烈
只生成Li2O
接触空气不加热
剧烈
更复杂的氧化物
接触空气不加热
剧烈
更复杂的氧化物
产物碱性:
LiOH <NaOH <KOH < RbOH < CsOH
逐渐剧烈
(2)与H2O反应
2Li + 2H2O = 2LiOH + H2 ↑(较慢)
2Na + 2H2O = 2NaOH + H2 ↑(剧烈)
2K + 2H2O = 2KOH + H2 ↑(更剧烈)
通式: 2M + 2H2O = 2MOH + H2 ↑
[特别提醒]实验室里钠、钾保存在煤油中,而锂保存在石蜡中。
元素 现象 产物 结论
Li
Na
K
Rb
Cs
从Li—Cs,随电子层数的递增,还原性(金属性)逐渐增强。
会反应,比Na缓慢
遇水燃烧,甚至爆炸
对应的碱和氢气
剧烈反应,有“浮、熔、游、嘶、红”现象
更剧烈,气体会燃烧,轻微爆炸声
与水的反应
[特别提醒]实验室里钠、钾保存在煤油中,而锂保存在石蜡中。
(2)递变性
具体表现如下(按从Li→Cs的顺序)
①与O2的反应越来越剧烈,产物越来越复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成Na2O2,而K与O2反应能够生成KO2等。
②与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
③最高价氧化物对应水化物的碱性逐渐增强。
即碱性:LiOH Li Na K Rb Cs
1.相似性:
都易失电子表现强还原性
化合物中均为+1价
总结: 碱金属的原子结构
2.递变性:
核电荷数
电子层数
失电子能力
还原性
金属性
原子半径
化学性质相似
最外层上都
只有一个电子
核对最外层电子的引力
二、卤族元素
氟(F)
氯(Cl)
溴(Br)
碘(I)
砹(At)
Cl
1、原子结构特点
相同点: 最外层电子数均为7,
易得电子,有非金属性
不同点:电子层数递增,
原子半径逐渐增大
2、卤素单质的物理性质P教8
单质 颜色和状态 密度 熔点 ℃ 沸点 ℃ 溶解度(100g水)
F2 淡黄绿色气体 1.69g/L -219.6 -188.1 与水反应
Cl2 黄绿色气体 3. 214 g/L -101 -34.6 226cm3
Br2 深红棕色液体 3.119 g/cm3 7.2 58.78 4.16g
I2 紫黑色固体 4.93g/cm3 113.5 184.4 0.029g
都是有色单质
熔、沸点较低
相似性
单质颜色逐渐加深,状态由气态到液态到固态
单质密度逐渐增大
从上到下,熔、沸点逐渐升高
递变性
:氯易液化、溴易挥发、碘易升华。
特性
相同点:
最外层7个电子
易得一个电子,
不同点:
核电荷数递增
电子层数递增
原子半径依次增大
得到电子能力逐渐减弱,
具有氧化性
单质的氧化性逐渐减弱
原子结构
化学性质
3、卤素的化学性质 P8
3 X2 + 2Fe == 2FeX3
△
△
△
I2 + Fe == FeI2
(X=F、Cl、Br 但≠I 除外)
Cl2+2Na=2NaCl
(1)卤素与金属的反应
3、卤素单质的化学性质
3 Cl2 + 2Fe == 2FeCl3
(2)卤素单质与氢气反应
H2+F2=2HF
暗处反应爆炸;HF很稳定
H2+Cl2=2HCl
H2+Br2=2HBr
光照或点燃;HCl较稳定
加热500℃ ,HBr不稳定
需不断加热,HI同时分解
H2+I2 2HI
结论:从F2到I2,单质氧化性越来越弱,与H2反应越来越难,生成的氢化物的稳定性越来越弱。
(3)卤素单质间的反应
实验1-1
实验 现象 化学方程式及实验结论
①饱和氯水与NaBr溶液
②饱和氯水与KI溶液
③溴水与KI溶液
溶液由无色,变为橙黄色,滴加CCl4振荡后,液体分为两层,上层接近无色,下层为橙红色
溶液由无色变为棕黄色,滴加CCl4振荡后,液体分为两层,上层接近无色,下层为紫红色
Cl2 + 2NaBr =2NaCl +Br2
Cl2 + 2 KI = 2KCl + I2
Br2 + 2KI =2KBr +I2
氯水:浅黄绿色 溴水:橙黄色 碘水:棕黄色(褐色)
溴的有机溶液为橙红色;碘的有机溶液为紫红色。
溶液由无色变为棕黄色,滴加CCl4振荡后,液体分为两层,上层接近无色,下层为紫红色
说明Cl2 的氧化性比Br2强
说明Cl2 的氧化性比I2强
说明Br2 的氧化性比I2强
思考:根据上述反应,比较Cl2、Br2、I2的氧化性强弱
结论:氧化性:F2 > Cl2>Br2>I2
(4)特性:
②、Br2是易挥发的深红棕色液体,是中学阶段唯一一种液态非金属单质,其保存通常加入少量的水,即“液封”;
①I2遇淀粉变蓝色。
2F2 + 2H2O = 4HF + O2 (爆炸)
(能反应)
(很弱)
(极弱)
与水反应的剧烈程度逐渐减弱
(5)卤素与水反应
F2的特殊性
Cl2 + H2O HCl + HClO
Br2 + H2O HBr + HBrO
I2 + H2O HI + HIO
X2 + H2O HX+ HXO(F除外)
(6)卤素单质与碱反应
X2+ 2NaOH = NaX+ NaXO+H2O (F除外)
卤族
元素 核电
荷数 原子
半径 得电
子能
力 非金
属性 单质与氢气化合的难易 气态氢化物的稳定性
F
Cl
Br
I
依次增大
逐渐增大
逐渐减弱
逐渐减弱
越来越难
逐渐减弱
【总结】卤族元素元素性质的递变
具体表现如下:
①与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,其水溶液的酸性逐渐增强,即:
稳定性:HF>HCl>HBr>HI;
还原性:HF酸性:HF(2)递变性
②最高价氧化物对应水化物的酸性逐渐减弱,即HClO4>HBrO4>HIO4。
2.从原子结构角度认识卤族元素性质的递变规律
Be
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
1
2
3
4
5
6
7
B
Al
Si
Ge
As
Sb
Te
Po
At
非金属区
金属区
主族元素金属性、非金属性的递变规律
第一节 元素周期表
第二课时:元素的性质与原子结构
第一章 物质结构 元素周期律
学习目标
1.了解碱金属、卤素在周期表中的位置。
2.了解碱金属、卤素原子结构特点,了解原子结构与元素性质的关系。
3.了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理论解释。
H ⅢA ⅣA ⅤA ⅥA ⅦA
Li Be B C N O F
Na Mg Al Si P S Cl
K Ca Ga Ge As Se Br
Rb Sr In Sn Sb Te I
Cs Ba Tl Pb Bi Po At
Fr Ra
ⅠA
ⅡA
1
2
3
4
5
6
7
主族元素表
科学探究:完成课本第5页的表.
我们把第ⅠA 族称为碱金属族,为什么要把它们编在一个族呢?请同学们画出碱金属的原子结构示意图,比较碱金属原子结构的共同之处 。
思考与交流
1、碱金属元素的原子结构
元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数
碱金属 锂
钠
钾
铷
铯
2
1
Li
3
1
3
Na
11
1
4
K
19
1
5
Rb
37
1
6
Cs
55
它们的原子结构的相似和不同?
相同点: 最外层电子数均为1,
易失电子,有金属性
第ⅠA族金属元素
55Cs
3Li
11Na
19K
37Rb
不同点:电子层数递增,
原子半径逐渐增大
2、碱金属的物理性质相似性和递变性
单质 颜色和状态 密度/g·cm-3 熔点/0C 沸点/0C
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金色光泽,柔软 1.879 28.40 678.4
除铯外,都呈银白色
都较柔软
密度都较小
熔点都较低
相似性
从上到下,密度依次增大(K反常)
从上到下,熔点依次降低
从上到下,沸点依次降低
递变性
K + O2 === KO2 (超氧化钾)
点燃
Rb、Cs与O2反应更剧烈,产物更复杂。
(1)与 O2反应
点燃
4Li + O2 === 2Li2O
点燃
2Na + O2 === Na2O2
( ★ Li的燃烧产物只有一种)
3、碱金属的化学性质的比较
科学探究P教6
元素 条件 现象 产物 结论
Li
Na 加热 先熔化成小球,后燃烧,火焰呈黄色,生成淡黄色固体。 Na2O2
K 稍加热 先熔化成小球,后燃烧,反应比钠剧烈,产生紫色火焰。 更复杂的氧化物KO2
Rb
Cs
与非金属的反应(以O2为例)
从Li—Cs,随电子层数的递增,还原性(金属性)逐渐增强。
加热
燃烧,较不剧烈
只生成Li2O
接触空气不加热
剧烈
更复杂的氧化物
接触空气不加热
剧烈
更复杂的氧化物
产物碱性:
LiOH <NaOH <KOH < RbOH < CsOH
逐渐剧烈
(2)与H2O反应
2Li + 2H2O = 2LiOH + H2 ↑(较慢)
2Na + 2H2O = 2NaOH + H2 ↑(剧烈)
2K + 2H2O = 2KOH + H2 ↑(更剧烈)
通式: 2M + 2H2O = 2MOH + H2 ↑
[特别提醒]实验室里钠、钾保存在煤油中,而锂保存在石蜡中。
元素 现象 产物 结论
Li
Na
K
Rb
Cs
从Li—Cs,随电子层数的递增,还原性(金属性)逐渐增强。
会反应,比Na缓慢
遇水燃烧,甚至爆炸
对应的碱和氢气
剧烈反应,有“浮、熔、游、嘶、红”现象
更剧烈,气体会燃烧,轻微爆炸声
与水的反应
[特别提醒]实验室里钠、钾保存在煤油中,而锂保存在石蜡中。
(2)递变性
具体表现如下(按从Li→Cs的顺序)
①与O2的反应越来越剧烈,产物越来越复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成Na2O2,而K与O2反应能够生成KO2等。
②与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
③最高价氧化物对应水化物的碱性逐渐增强。
即碱性:LiOH
1.相似性:
都易失电子表现强还原性
化合物中均为+1价
总结: 碱金属的原子结构
2.递变性:
核电荷数
电子层数
失电子能力
还原性
金属性
原子半径
化学性质相似
最外层上都
只有一个电子
核对最外层电子的引力
二、卤族元素
氟(F)
氯(Cl)
溴(Br)
碘(I)
砹(At)
Cl
1、原子结构特点
相同点: 最外层电子数均为7,
易得电子,有非金属性
不同点:电子层数递增,
原子半径逐渐增大
2、卤素单质的物理性质P教8
单质 颜色和状态 密度 熔点 ℃ 沸点 ℃ 溶解度(100g水)
F2 淡黄绿色气体 1.69g/L -219.6 -188.1 与水反应
Cl2 黄绿色气体 3. 214 g/L -101 -34.6 226cm3
Br2 深红棕色液体 3.119 g/cm3 7.2 58.78 4.16g
I2 紫黑色固体 4.93g/cm3 113.5 184.4 0.029g
都是有色单质
熔、沸点较低
相似性
单质颜色逐渐加深,状态由气态到液态到固态
单质密度逐渐增大
从上到下,熔、沸点逐渐升高
递变性
:氯易液化、溴易挥发、碘易升华。
特性
相同点:
最外层7个电子
易得一个电子,
不同点:
核电荷数递增
电子层数递增
原子半径依次增大
得到电子能力逐渐减弱,
具有氧化性
单质的氧化性逐渐减弱
原子结构
化学性质
3、卤素的化学性质 P8
3 X2 + 2Fe == 2FeX3
△
△
△
I2 + Fe == FeI2
(X=F、Cl、Br 但≠I 除外)
Cl2+2Na=2NaCl
(1)卤素与金属的反应
3、卤素单质的化学性质
3 Cl2 + 2Fe == 2FeCl3
(2)卤素单质与氢气反应
H2+F2=2HF
暗处反应爆炸;HF很稳定
H2+Cl2=2HCl
H2+Br2=2HBr
光照或点燃;HCl较稳定
加热500℃ ,HBr不稳定
需不断加热,HI同时分解
H2+I2 2HI
结论:从F2到I2,单质氧化性越来越弱,与H2反应越来越难,生成的氢化物的稳定性越来越弱。
(3)卤素单质间的反应
实验1-1
实验 现象 化学方程式及实验结论
①饱和氯水与NaBr溶液
②饱和氯水与KI溶液
③溴水与KI溶液
溶液由无色,变为橙黄色,滴加CCl4振荡后,液体分为两层,上层接近无色,下层为橙红色
溶液由无色变为棕黄色,滴加CCl4振荡后,液体分为两层,上层接近无色,下层为紫红色
Cl2 + 2NaBr =2NaCl +Br2
Cl2 + 2 KI = 2KCl + I2
Br2 + 2KI =2KBr +I2
氯水:浅黄绿色 溴水:橙黄色 碘水:棕黄色(褐色)
溴的有机溶液为橙红色;碘的有机溶液为紫红色。
溶液由无色变为棕黄色,滴加CCl4振荡后,液体分为两层,上层接近无色,下层为紫红色
说明Cl2 的氧化性比Br2强
说明Cl2 的氧化性比I2强
说明Br2 的氧化性比I2强
思考:根据上述反应,比较Cl2、Br2、I2的氧化性强弱
结论:氧化性:F2 > Cl2>Br2>I2
(4)特性:
②、Br2是易挥发的深红棕色液体,是中学阶段唯一一种液态非金属单质,其保存通常加入少量的水,即“液封”;
①I2遇淀粉变蓝色。
2F2 + 2H2O = 4HF + O2 (爆炸)
(能反应)
(很弱)
(极弱)
与水反应的剧烈程度逐渐减弱
(5)卤素与水反应
F2的特殊性
Cl2 + H2O HCl + HClO
Br2 + H2O HBr + HBrO
I2 + H2O HI + HIO
X2 + H2O HX+ HXO(F除外)
(6)卤素单质与碱反应
X2+ 2NaOH = NaX+ NaXO+H2O (F除外)
卤族
元素 核电
荷数 原子
半径 得电
子能
力 非金
属性 单质与氢气化合的难易 气态氢化物的稳定性
F
Cl
Br
I
依次增大
逐渐增大
逐渐减弱
逐渐减弱
越来越难
逐渐减弱
【总结】卤族元素元素性质的递变
具体表现如下:
①与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,其水溶液的酸性逐渐增强,即:
稳定性:HF>HCl>HBr>HI;
还原性:HF
②最高价氧化物对应水化物的酸性逐渐减弱,即HClO4>HBrO4>HIO4。
2.从原子结构角度认识卤族元素性质的递变规律
Be
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
1
2
3
4
5
6
7
B
Al
Si
Ge
As
Sb
Te
Po
At
非金属区
金属区
主族元素金属性、非金属性的递变规律
