人教版高二化学选修3第一章第二节 原子结构与元素的性质 (共24张PPT)
文档属性
| 名称 | 人教版高二化学选修3第一章第二节 原子结构与元素的性质 (共24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 493.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-08 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
第一章 原子结构与性质
第二节 原子结构与元素的性质
学习目标:
2、能应用元素的电离能说明元素的某些性质
1、掌握原子半径、第一电离能的周期性变化
3、认识主族元素电离能与核外电子排布的关系
思考
1.什么是元素周期律?
2.元素的性质包括哪些内容?
元素的性质随核电荷数的递增发生周期性递变的规律
主要化合价
金属性非金属性
原子半径
电负性
3.这些性质在同周期主族元素中有怎样的递变规律?
电离能
二、元素周期律
(一)原子半径
主族元素原子半径的周期性变化
1.找出主族元素原子半径在同一周期、同一主族中的变化规律
原子半径从左到右逐渐减小
原子半径从上到下逐渐增大
问题探究1
2.分析变化原因,总结影响原子半径的因素
(教材P17图1-20)
归纳:
1、原子半径递变规律:
同周期从左到右原子半径逐渐减小
同主族从上到下原子半径逐渐增大
2、影响因素
电子的能层数
核电荷数
层多,半径大
核大,半径小
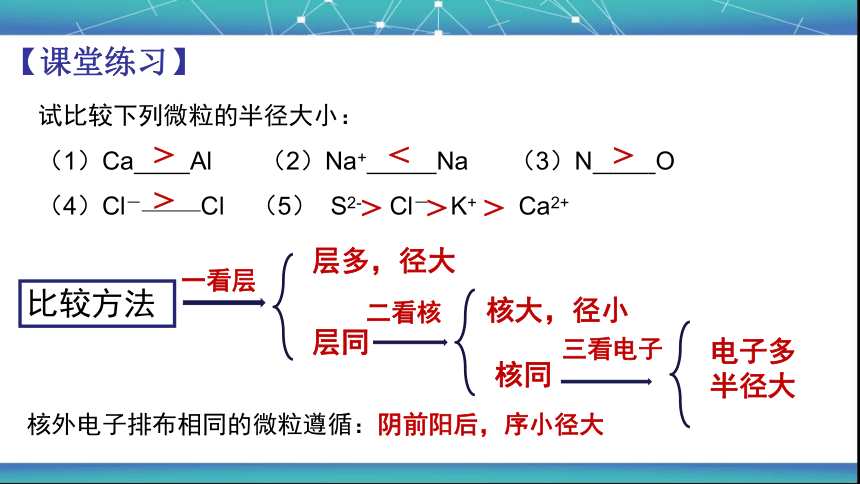
试比较下列微粒的半径大小:
(1)Ca Al (2)Na+ Na (3)N O (4)Cl- Cl (5) S2- Cl- K+ Ca2+
【课堂练习】
比较方法
一看层
层多,径大
层同
二看核
核大,径小
核同
三看电子
电子多半径大
核外电子排布相同的微粒遵循:阴前阳后,序小径大
>
>
>
<
>
>
>
(二)电离能
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。用I1表示,单位:kJ·mol-1
阅读教材P17
逐级电离能
从一价气态基态正离子中再失去一个电子所消耗的能量叫做第二电离能(用I2表示)
依次类推,可得到I3、I4、……
1、定义:
第一电离能
I1越小,表示原子越易失电子,元素的金属性越强。
I1越大,表示原子越难失电子,元素的非金属性越强。
2、电离能的意义
电离能的应用
思考
元素的第一电离能与原子失电子能力有何关系?
(1)可判断元素的金属性和非金属性。
衡量原子失去电子的难易程度。
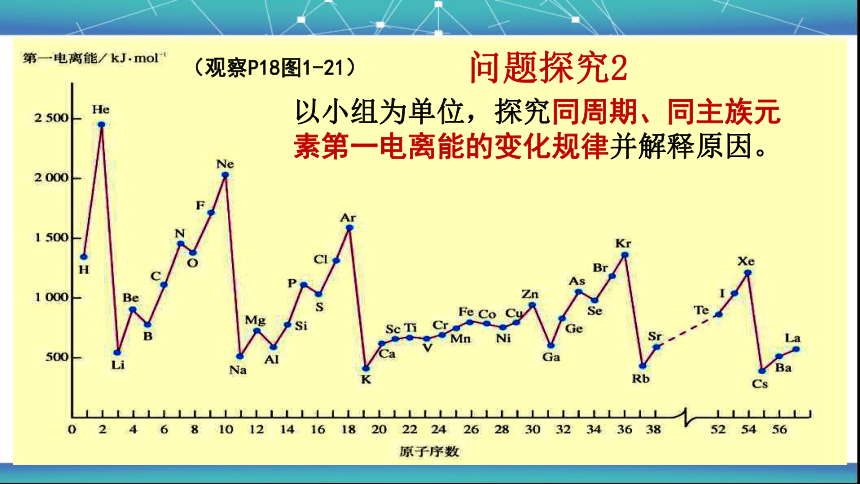
问题探究2
以小组为单位,探究同周期、同主族元素第一电离能的变化规律并解释原因。
(观察P18图1-21)
交流讨论1:第一电离能的变化规律
元素从左到右第一电离能总体呈增大趋势
(3)第ⅡA元素>ⅢA元素;第ⅤA元素>ⅥA元素
规律1. (1)同主族
(2)同周期
元素从上到下第一电离能逐渐减小
为什么元素的第一电离能同周期从左到右有增大趋势,同主族从上到下逐渐减小?
思考
同周期元素从左到右,原子半径逐渐减小,失电子能力逐渐减弱,第一电离能有增大趋势;
同主族元素从上到下,原子半径逐渐增大,失电子能力逐渐增大,第一电离能逐渐减小。
交流讨论2:
半满
全满
2S2
2S22P1
2S22P3
2S22P4
Li
Be
B
C
N
O
F
Ne
以第二周期为例,说明为什么同周期的第ⅡA、ⅤA的I1反常,比下一主族的高?请试从价电子排布分析。
ⅤA半充满、 ⅡA全充满结构
Be
B
N
O
Li
<
B
<
Be
<
C
<
O
N
<
<
F
<
Ne
交流讨论3:
根据递变规律推知,哪种元素第一电离能最大?哪种元素第一电离能最小?(过渡元素与放射性元素除外)
规律2:
周期表中He元素第一电离能最大,Cs元素第一电离能最小。
拓展讨论4:同种元素逐级电离能的变化规律
规律3:
同种元素逐级电离能逐渐升高: I1﹤I2﹤I3……﹤In
I1 I2 I3 I4 I5 I6 ……
496 4562 6912 9543 13353 16610 ……
Na元素的逐级电离能数据:
M(g)= M+ (g) + e- I1(第一电离能)
M+(g)= M2+ (g) + e- I2(第二电离能)
M2+(g)= M3+ (g) + e- I3(第三电离能)
. . . . . .
为什么?
3.递变规律
(二)电离能
a. 同主族元素从上到下第一电离能逐渐减小
b.同周期元素从左到右第一电离能总体呈增大趋势
c.第ⅡA元素>ⅢA的元素;第ⅤA元素>ⅥA元素
d.同种元素逐级电离能逐渐升高: I1﹤I2﹤I3……﹤In
4.电离能的应用
Na Mg Al
电离能(kJ/mol) I1 496 738 578
I2 4562 1451 1817
I3 6912 7733 2745
I4 9543 10540 11575
I5 13353 13630 14830
I6 16610 17995 18376
I7 20114 21703 23293
(2)判断元素的最高化合价
这些数据跟钠、镁、铝的化合价有什么联系?
I1 I2 I3 I4 I5 I6 I7 I8 I9 I10 I11
496 4562 6910 9543 13354 16613 20117 25496 28932 141362 159076
Na元素的逐级电离能数据: (单位:kJ/mol)
4.电离能的应用
I1<(3)说明原子核外电子的分层排布
电离能的突变,说明核外电子是分层排布的。
【课堂检测】
1、下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是( )
A K、Na、Li
B Al、Mg、Na
C N、O、C
D Cl、S、P
A
【课堂检测】
2.在下面的电子结构中,第一电离能最小的原子可能是 (? ? )
A ns2np3 B? ns2np5
C? ns2np4 D? ns2np6
C
3.某元素的电离能(电子伏特)如下:
I1F I2 I3 I4 I5 I6 I7
14.5 29.6 47.4 77.5 97.9 551.9 666.8
此元素位于元素周期表的族数是( )
A. IA B. ⅡA C. ⅢA D、ⅣA E、ⅥA F、ⅤA G、 ⅦA
F
【课堂检测】
【小试高考】
1. 根据元素周期律,第一电离能Ga_________As。(填“大于”或“小于”)
2.(2014·新课标全国卷Ⅱ) N、O、S元素中第一电离能最大的是________(填元素符号)。
小于
N
总结
二、元素周期律
(一)原子半径
1、递变规律:同周期从左到右原子半径逐渐减小
同主族从上到下原子半径逐渐增大
2、影响因素
(二)电离能
1、定义:
2、意义:
3.递变规律
a. 同主族元素从上到下第一电离能逐渐减小
b.同周期元素从左到右第一电离能总体呈增大趋势
c.第ⅡA元素>ⅢA的元素;第ⅤA元素>ⅥA元素
4.应用
作业:
能力培养相应练习题
预习电负性
谢谢大家!
第一章 原子结构与性质
第二节 原子结构与元素的性质
学习目标:
2、能应用元素的电离能说明元素的某些性质
1、掌握原子半径、第一电离能的周期性变化
3、认识主族元素电离能与核外电子排布的关系
思考
1.什么是元素周期律?
2.元素的性质包括哪些内容?
元素的性质随核电荷数的递增发生周期性递变的规律
主要化合价
金属性非金属性
原子半径
电负性
3.这些性质在同周期主族元素中有怎样的递变规律?
电离能
二、元素周期律
(一)原子半径
主族元素原子半径的周期性变化
1.找出主族元素原子半径在同一周期、同一主族中的变化规律
原子半径从左到右逐渐减小
原子半径从上到下逐渐增大
问题探究1
2.分析变化原因,总结影响原子半径的因素
(教材P17图1-20)
归纳:
1、原子半径递变规律:
同周期从左到右原子半径逐渐减小
同主族从上到下原子半径逐渐增大
2、影响因素
电子的能层数
核电荷数
层多,半径大
核大,半径小
试比较下列微粒的半径大小:
(1)Ca Al (2)Na+ Na (3)N O (4)Cl- Cl (5) S2- Cl- K+ Ca2+
【课堂练习】
比较方法
一看层
层多,径大
层同
二看核
核大,径小
核同
三看电子
电子多半径大
核外电子排布相同的微粒遵循:阴前阳后,序小径大
>
>
>
<
>
>
>
(二)电离能
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。用I1表示,单位:kJ·mol-1
阅读教材P17
逐级电离能
从一价气态基态正离子中再失去一个电子所消耗的能量叫做第二电离能(用I2表示)
依次类推,可得到I3、I4、……
1、定义:
第一电离能
I1越小,表示原子越易失电子,元素的金属性越强。
I1越大,表示原子越难失电子,元素的非金属性越强。
2、电离能的意义
电离能的应用
思考
元素的第一电离能与原子失电子能力有何关系?
(1)可判断元素的金属性和非金属性。
衡量原子失去电子的难易程度。
问题探究2
以小组为单位,探究同周期、同主族元素第一电离能的变化规律并解释原因。
(观察P18图1-21)
交流讨论1:第一电离能的变化规律
元素从左到右第一电离能总体呈增大趋势
(3)第ⅡA元素>ⅢA元素;第ⅤA元素>ⅥA元素
规律1. (1)同主族
(2)同周期
元素从上到下第一电离能逐渐减小
为什么元素的第一电离能同周期从左到右有增大趋势,同主族从上到下逐渐减小?
思考
同周期元素从左到右,原子半径逐渐减小,失电子能力逐渐减弱,第一电离能有增大趋势;
同主族元素从上到下,原子半径逐渐增大,失电子能力逐渐增大,第一电离能逐渐减小。
交流讨论2:
半满
全满
2S2
2S22P1
2S22P3
2S22P4
Li
Be
B
C
N
O
F
Ne
以第二周期为例,说明为什么同周期的第ⅡA、ⅤA的I1反常,比下一主族的高?请试从价电子排布分析。
ⅤA半充满、 ⅡA全充满结构
Be
B
N
O
Li
<
B
<
Be
<
C
<
O
N
<
<
F
<
Ne
交流讨论3:
根据递变规律推知,哪种元素第一电离能最大?哪种元素第一电离能最小?(过渡元素与放射性元素除外)
规律2:
周期表中He元素第一电离能最大,Cs元素第一电离能最小。
拓展讨论4:同种元素逐级电离能的变化规律
规律3:
同种元素逐级电离能逐渐升高: I1﹤I2﹤I3……﹤In
I1 I2 I3 I4 I5 I6 ……
496 4562 6912 9543 13353 16610 ……
Na元素的逐级电离能数据:
M(g)= M+ (g) + e- I1(第一电离能)
M+(g)= M2+ (g) + e- I2(第二电离能)
M2+(g)= M3+ (g) + e- I3(第三电离能)
. . . . . .
为什么?
3.递变规律
(二)电离能
a. 同主族元素从上到下第一电离能逐渐减小
b.同周期元素从左到右第一电离能总体呈增大趋势
c.第ⅡA元素>ⅢA的元素;第ⅤA元素>ⅥA元素
d.同种元素逐级电离能逐渐升高: I1﹤I2﹤I3……﹤In
4.电离能的应用
Na Mg Al
电离能(kJ/mol) I1 496 738 578
I2 4562 1451 1817
I3 6912 7733 2745
I4 9543 10540 11575
I5 13353 13630 14830
I6 16610 17995 18376
I7 20114 21703 23293
(2)判断元素的最高化合价
这些数据跟钠、镁、铝的化合价有什么联系?
I1 I2 I3 I4 I5 I6 I7 I8 I9 I10 I11
496 4562 6910 9543 13354 16613 20117 25496 28932 141362 159076
Na元素的逐级电离能数据: (单位:kJ/mol)
4.电离能的应用
I1<
电离能的突变,说明核外电子是分层排布的。
【课堂检测】
1、下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是( )
A K、Na、Li
B Al、Mg、Na
C N、O、C
D Cl、S、P
A
【课堂检测】
2.在下面的电子结构中,第一电离能最小的原子可能是 (? ? )
A ns2np3 B? ns2np5
C? ns2np4 D? ns2np6
C
3.某元素的电离能(电子伏特)如下:
I1F I2 I3 I4 I5 I6 I7
14.5 29.6 47.4 77.5 97.9 551.9 666.8
此元素位于元素周期表的族数是( )
A. IA B. ⅡA C. ⅢA D、ⅣA E、ⅥA F、ⅤA G、 ⅦA
F
【课堂检测】
【小试高考】
1. 根据元素周期律,第一电离能Ga_________As。(填“大于”或“小于”)
2.(2014·新课标全国卷Ⅱ) N、O、S元素中第一电离能最大的是________(填元素符号)。
小于
N
总结
二、元素周期律
(一)原子半径
1、递变规律:同周期从左到右原子半径逐渐减小
同主族从上到下原子半径逐渐增大
2、影响因素
(二)电离能
1、定义:
2、意义:
3.递变规律
a. 同主族元素从上到下第一电离能逐渐减小
b.同周期元素从左到右第一电离能总体呈增大趋势
c.第ⅡA元素>ⅢA的元素;第ⅤA元素>ⅥA元素
4.应用
作业:
能力培养相应练习题
预习电负性
谢谢大家!
