人教版高二选修4第二章第三节化学平衡的建立及平衡标志判断(19张ppt)
文档属性
| 名称 | 人教版高二选修4第二章第三节化学平衡的建立及平衡标志判断(19张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 352.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-08 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
第三节 第一课时
化学平衡的建立及
平衡标志的判断
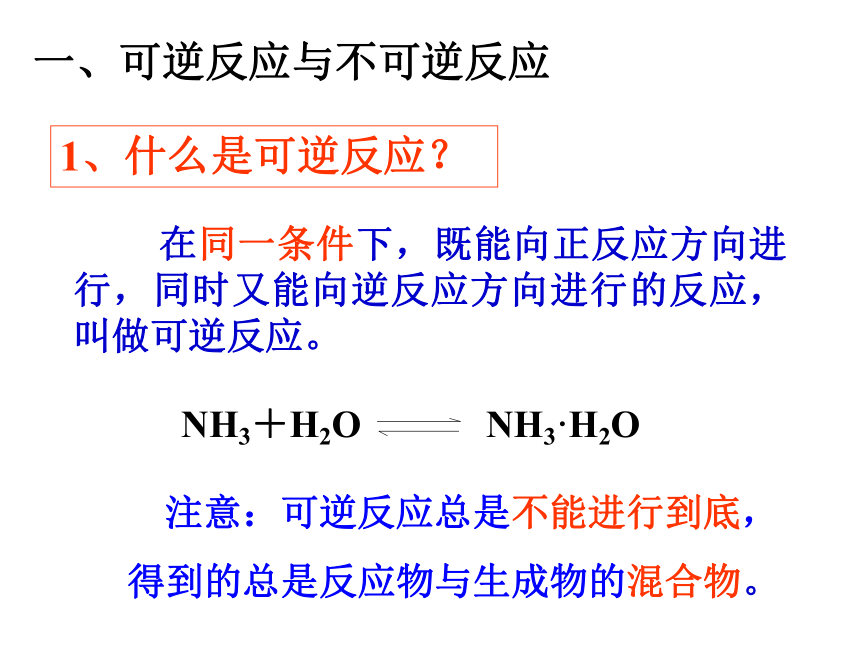
一、可逆反应与不可逆反应
1、什么是可逆反应?
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。
注意:可逆反应总是不能进行到底,
得到的总是反应物与生成物的混合物。
2、什么是饱和溶液?
在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
饱和溶液中溶质的溶解过程完全停止了吗?
没有!
?
开始:溶解速率 > 结晶速率
一段时间后:溶解速率= 结晶速率
达到溶解平衡,形成硫酸铜饱和溶液
达到溶解平衡后,溶解与结晶没有停止,只是速率相等。溶解平衡是一种动态平衡。
3、溶解平衡的建立
4、溶解平衡状态的特征
(3)动:动态平衡(溶解、结晶仍在进行)
(5)变:条件改变,原溶解平衡被破坏,在新的条件下建立新的平衡。
(2)等:溶解速率=结晶速率
(4)定:溶液中溶质浓度保持不变。
(1)逆:可逆过程;
同:溶解平衡的建立与途径无关,只要条件相同,均可形成同一溶解平衡状态。
【复习】化学平衡状态的定义:(化学反应的限度)一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
化学平衡的特征:
逆
等
动
定
变
——可逆反应(或可逆过程)
——V正 =V逆(用同一物质浓度表示)
——动态平衡。 (V正=V逆≠0)
——平衡时,各组分浓度、含量保持不变(恒定)
——条件改变,平衡发生改变
如何判断可逆反应达到平衡状态?
一、直接标志:
①速率关系:正反应速率与逆反应速率相等,
即:A消耗速率与A的生成速率相等,
A的消耗速率与B的生成速率之比等于m:n ,
A消耗速率与C的消耗速率之比等于m : p;(同边异名,同名异边)
②反应体系中各物质的百分含量保持不变。
可逆反应达到平衡状态的标志及判断方法如下:
以mA(g) + nB(g) ?pC(g)+ qD(g)为例:
(三)判断标志
二、间接标志:
①混合气体的总压强、总体积、总物质的量不随时间的改变而 改变(m + n ≠ p + q);
②各物质的浓度、物质的量不随时间的改变而改变;
③各气体的体积、各气体的分压不随时间的改变而改变。
递进题组
考点一
知识梳理
递进题组
返回
平衡
不一定平衡
平衡
不一定平衡
递进题组
考点一
知识梳理
递进题组
返回
不一定平衡
不一定平衡
平衡
平衡
平衡
递进题组
考点一
知识梳理
递进题组
返回
平衡
平衡
平衡
不一定平衡
递进题组
考点一
知识梳理
递进题组
返回
不一定平衡
平衡
对于不同类型的可逆反应,某
一物理量不变是否可作为平衡已到达
的标志,取决于该物理量在平衡到达
前(反应过程中)是否发生变化。若
是则可;否则,不行。
注意!
*
例2、一定条件下,反应N2+3H2 2NH3达到平衡的标志是
A、一个N≡N键断裂的同时,有三个H-H键形成
B、一个N≡N键断裂的同时,有三个H-H键断裂
C、一个N≡N键断裂的同时,有六个N-H键断裂
D、一个N≡N键断裂的同时,有六个N-H键形成
√
√
在判断化学平衡时,要注意化学键数与反应物质的物质的量之间的联系,同时要注意成键、断键与反应方向之间的关系。
*
课堂练习:
【1】 在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是 ( )
A. C的生成速率与C分解的速率相等
B. 单位时间内生成n molA,同时生3n molB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2
AC
*
【2】 下列说法中可以充分说明反应:
P(g)+Q(g) R(g)+S(g) , 在恒温下已达平衡状态的是( )
反应容器内压强不随时间变化
B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存
D. 反应容器内总物质的量不随时间而变化
B
*
【3】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明A(s)+3B(g) 2C(g)+D(g)已达平衡状态的是 ( )
A.混合气体的压强
B.混合气体的密度
C.B的物质的量浓度
D.气体的总物质的量
BC
(1)混合气体的颜色不再改变 ( )
(2)混合气体的平均相对分子质量不变 ( )
(3)混合气体的密度不变 ( )
(4)混合气体的压强不变 ( )
(5)单位时间内消耗2nmolNO2的同时生成2nmolO2 ( )
(6) O2气体的物质的量浓度不变 ( )
化学平衡状态的判断
第三节 第一课时
化学平衡的建立及
平衡标志的判断
一、可逆反应与不可逆反应
1、什么是可逆反应?
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。
注意:可逆反应总是不能进行到底,
得到的总是反应物与生成物的混合物。
2、什么是饱和溶液?
在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
饱和溶液中溶质的溶解过程完全停止了吗?
没有!
?
开始:溶解速率 > 结晶速率
一段时间后:溶解速率= 结晶速率
达到溶解平衡,形成硫酸铜饱和溶液
达到溶解平衡后,溶解与结晶没有停止,只是速率相等。溶解平衡是一种动态平衡。
3、溶解平衡的建立
4、溶解平衡状态的特征
(3)动:动态平衡(溶解、结晶仍在进行)
(5)变:条件改变,原溶解平衡被破坏,在新的条件下建立新的平衡。
(2)等:溶解速率=结晶速率
(4)定:溶液中溶质浓度保持不变。
(1)逆:可逆过程;
同:溶解平衡的建立与途径无关,只要条件相同,均可形成同一溶解平衡状态。
【复习】化学平衡状态的定义:(化学反应的限度)一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
化学平衡的特征:
逆
等
动
定
变
——可逆反应(或可逆过程)
——V正 =V逆(用同一物质浓度表示)
——动态平衡。 (V正=V逆≠0)
——平衡时,各组分浓度、含量保持不变(恒定)
——条件改变,平衡发生改变
如何判断可逆反应达到平衡状态?
一、直接标志:
①速率关系:正反应速率与逆反应速率相等,
即:A消耗速率与A的生成速率相等,
A的消耗速率与B的生成速率之比等于m:n ,
A消耗速率与C的消耗速率之比等于m : p;(同边异名,同名异边)
②反应体系中各物质的百分含量保持不变。
可逆反应达到平衡状态的标志及判断方法如下:
以mA(g) + nB(g) ?pC(g)+ qD(g)为例:
(三)判断标志
二、间接标志:
①混合气体的总压强、总体积、总物质的量不随时间的改变而 改变(m + n ≠ p + q);
②各物质的浓度、物质的量不随时间的改变而改变;
③各气体的体积、各气体的分压不随时间的改变而改变。
递进题组
考点一
知识梳理
递进题组
返回
平衡
不一定平衡
平衡
不一定平衡
递进题组
考点一
知识梳理
递进题组
返回
不一定平衡
不一定平衡
平衡
平衡
平衡
递进题组
考点一
知识梳理
递进题组
返回
平衡
平衡
平衡
不一定平衡
递进题组
考点一
知识梳理
递进题组
返回
不一定平衡
平衡
对于不同类型的可逆反应,某
一物理量不变是否可作为平衡已到达
的标志,取决于该物理量在平衡到达
前(反应过程中)是否发生变化。若
是则可;否则,不行。
注意!
*
例2、一定条件下,反应N2+3H2 2NH3达到平衡的标志是
A、一个N≡N键断裂的同时,有三个H-H键形成
B、一个N≡N键断裂的同时,有三个H-H键断裂
C、一个N≡N键断裂的同时,有六个N-H键断裂
D、一个N≡N键断裂的同时,有六个N-H键形成
√
√
在判断化学平衡时,要注意化学键数与反应物质的物质的量之间的联系,同时要注意成键、断键与反应方向之间的关系。
*
课堂练习:
【1】 在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是 ( )
A. C的生成速率与C分解的速率相等
B. 单位时间内生成n molA,同时生3n molB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2
AC
*
【2】 下列说法中可以充分说明反应:
P(g)+Q(g) R(g)+S(g) , 在恒温下已达平衡状态的是( )
反应容器内压强不随时间变化
B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存
D. 反应容器内总物质的量不随时间而变化
B
*
【3】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明A(s)+3B(g) 2C(g)+D(g)已达平衡状态的是 ( )
A.混合气体的压强
B.混合气体的密度
C.B的物质的量浓度
D.气体的总物质的量
BC
(1)混合气体的颜色不再改变 ( )
(2)混合气体的平均相对分子质量不变 ( )
(3)混合气体的密度不变 ( )
(4)混合气体的压强不变 ( )
(5)单位时间内消耗2nmolNO2的同时生成2nmolO2 ( )
(6) O2气体的物质的量浓度不变 ( )
化学平衡状态的判断
