人教版高二化学选修3第一章第一节 原子结构(共45张PPT)
文档属性
| 名称 | 人教版高二化学选修3第一章第一节 原子结构(共45张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 969.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-08 21:43:00 | ||
图片预览











文档简介
(共45张PPT)
第一节
原子结构
第一章
学习目标
1.了解原子核外电子的运动状态;
2.了解原子结构的构造原理;
3.知道原子核外电子的能级分布,能用电
子排布式表示常见元素(1~36号)原子
核外电子的排布。
学习重难点
根据构造原理写出 1~36 号元素原子的电子排布式
宇宙大爆炸
氢是含量最高的元素,其次是氦
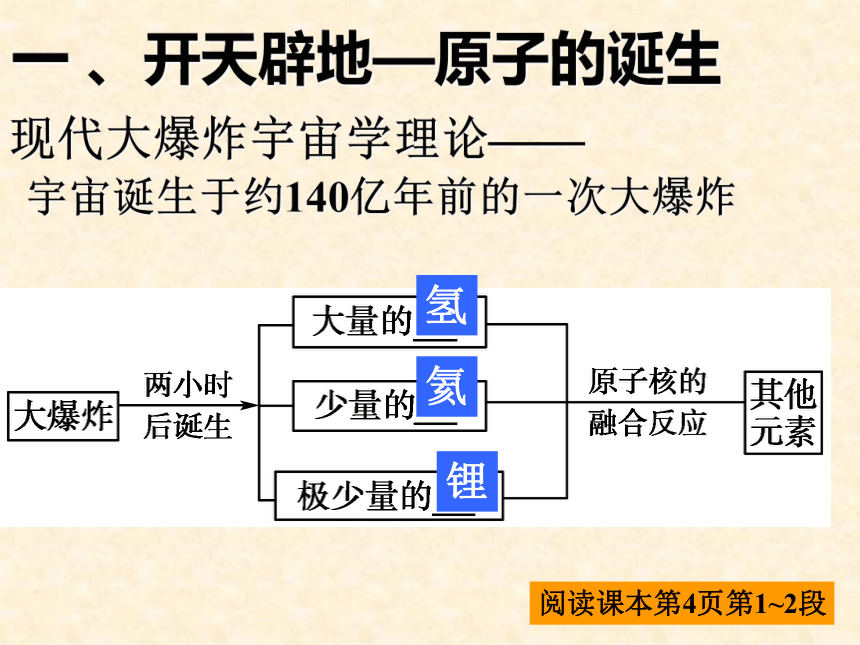
一 、开天辟地—原子的诞生
现代大爆炸宇宙学理论——
宇宙诞生于约140亿年前的一次大爆炸
阅读课本第4页第1~2段
氢
氦
锂
原子的结构
原子
原子核
核外电子
质子
中子
核电荷数=核内质子数=核外电子数
质量数=质子数+中子数
1、能层
按电子能量的高低及离核远近划分。
二、能层与能级
2n2
能层 一
二 三 四 五 六 七
符号 K L M N O P Q
最多容纳电子数 2 8 18 32 50 ……
离核远近 由近→到远
能量高低 由低→到高
(1)先排能量低的电子层,再排能量高的电子层,由里往外。
(2)每一层最多容纳电子数:2n2个。
(3)最外层电子数不超过8个(K层为最外层时不超过2个)。
(4)次外层电子数不超过18个,倒数第三层不超过32个。
核外电子的排布规律:
规定,任一能层的能级总是从 s 能级开始,依次称p、d、f、g能级……
能层 K L M N O
能级
最多 电子 数
2
2、能级
多电子原子中,同一能层的电子能量也有差别,按能量不同分成能级。
阅读教材P4,总结规律
2s 2p
4s 4p 4d 4f
3s 3p 3d
5s …
1s
2 6 10 14
2 6
2 6 10
2
8
18
32
K层:只有s能级
L层:有两个能级,分别为s能级 和 p能级
具体如下
(备注:每个轨道只能排2个电子)
M层:有三个能级,分别为s、p能级和d能级
N层:
有四个能级,
分别为s、p、d能级和f能级
学与问
1、原子核外电子的每一个能层最多可容纳的电子数与能层的序数(n)间存在什么关系?
2、不同能层分别有多少个能级,与能层的序数间存在什么关系?
答:每一层最多容纳电子数=2n2个。
答:①能层的能级数等于该能层序数,即
(第一能层) K能层:1个能级;
(第二能层) L能层:2个能级;
(第三能层) M能层:3个能级;……
②任一能层的能级总是从s能级开始。
③在每一能层中,能级符号与能量大小的顺序是:
ns3、英文字母相同的不同能级中所能容纳的最多电子数是否相同?
答:①各能级可容纳最多电子数按s、p、d、f…顺序
依次为1、3、5、7的二倍;
②不同能级中的s级,所容纳的电子数是相同的,
但是能量是不同的。
1.下列电子层中,包含有f 能级的是( )
A.K电子层 B.L电子层
C.M电子层 D.N电子层
解析: 能层数=能层中所包含的能级数。而要含有f能级则能层数必须大于4,即从N层往后才会出现f能级。
答案: D
2.下列说法中,不符合现代大爆炸宇宙学理论的是( ) A.我们所在的宇宙诞生于一次大爆炸B.恒星正在不断地合成自然界中没有的新元素 C.氢、氦等轻核元素是宇宙中天然元素之母 D.宇宙的所有原子中,最多的是氢元素的原子
B
3.若n=3,以下能级符号错误的是( )
A.np B.nf
C.nd D. ns
B
各能级上的电子有怎样的能量关系:
(1)相同能层:
①相同能级:E(npx)=E(npy)=E(npz);
②不同能级:E(ns)(2)不同能层:
①符号相同的能级:E(1s)②符号不同的能级:符合构造原理
我们知道了原子核外电子的能层和能级可容纳的最
多电子数,是否就可以得出各种原子的电子排布情况呢?
三、构造原理
原子核外电子排布必须遵循一定的排布顺序 —构造原理
1、各能级的能量低高顺序
在多电子原子中,电子在能级上的排布顺序是电子最先排布在能量最低的能级上,然后依次排布在能量较高的能级上。
存在着能级交错
1s----2s----2p----3s----3p---4s----3d---4p----5s----4d----
核外电子排布的构造原理图
教材P6
E(ns)核外电子排布的构造原理图
★原子的电子排布遵循构造原
理使整个原子的能量处于最低状态,简称能量最低原理
练习题.按能量由低到高的顺序排列,正确的一组是( )
A.1s、2p、3d、4s B.1s、2s、3s、2p C.2s、2p、3s、3p D.4p、3d、4s、3p
C
2.电子排布式
将 上所容纳的电子数标在该能级符号 ,并按照能层从左到右的顺序排列的式子,称电子排布式,如氢元素的电子排布式为:
能级
右上角
原子的核外电子排布的表示方法
原子结构示意图 意义 将每个能层上的电子总数表示在原子核外的式子
实例
??
电子
排布式 意义 用数字在能级符号右上角标明该能级上排布的电子数,这就是电子排布式
实例 O 1s22s22p4
刚接触此类题目时,若直接书写电子排布式若有困难,可先写出原子的原子结构示意图,再据此写出电子排布式,如
已知碳( C )元素原子的电子排布式为: 1s22s22p2
试书写下列原子的电子排布式
S
B
Cl
Fe☆
1s22s22p63s23p4
1s22s22p1
1s22s22p63s23p5
1s22s22p63s23p63d64s2
何为外围电子排布式(简称价电子层)
电子能在化学反应中可发生变化的能级。
如:
29Cu:3d104s1
19K:4s1
17Cl:3s23p5
(并不一定是最外层)
思考与交流
试书写N、Cl、K、Ca2+ 、
26Fe原子的 核外电子
排布式
①不符合构造原理。
原因:在同一能级的电子排布全充满或全空状态、
或半充满状态具有较低的能量和较大的稳定性
如对于Cr原子而言,外围电子呈3d54s1排布时,3d 、4s轨道上的电子均为半满状态时,整个体系的能量最低。
全充满: s2 p6 d10 f14 (稀有气体)
半充满: s1 p3 d5 f7 (VI A元素)
全 空: s0 p0 d0 f0 (Ca、Ag等)
相对
稳定
状态:
思考:Cr的电子排布式该如何写呢?
试写出铜的核外电子排布式
1s22s22p63s23p63d54s1
29号元素铜的电子排布式正确的是( )
A.1s22s22p63s23p64s13d10
B.1s22s22p63s23p63d104s1
C.1s22s22p63s23p63d94s2
D.1s22s22p63s23p63d84s24p1
答案: B
思考与交流: 从元素周期表中查出银、金的外围电子层排布。它们是否符合构造原理?
?答:不符合。大多数元素的原子核外电子排布符合构造原理,有少数元素的基态原子的电子排布对于构造原理有一个电子的偏差,如:
24号铬Cr:3d54s1;?? ?
29号铜Cu:3d104s1
47号银Ag:4d105s1;?? ?
79号金Au:5d106s1;?
各有电子的能级都排满了
如:稀有气体、ⅡA 、
全 满
特点:s2,p6,d10,f14
有电子的某一能级只排了该能级最大容量的一半电子
如:ⅠA、
半 满
特点:s1或p3或d5或f7
ⅤA等
Cr的核外电子排布式应为:
1s22s22p63s23p63d54s1
如果按照各能级填充规则,其核外电子排布式应为
1s22s22p63s23p63d44s2
但是,依据前面所学能量最低原理可知,3d能级填充5个电子、4s能级填充1个电子时较稳定,故Cr的正确电子排布式为:
在有电子的情况下,未排内层能级,便排外层能级
如:Ca、Ag等
全 空
特点:s0或p0或d0
K的核外电子排布式应为:
1s22s22p63s23p64s1
如果按照各能级填充规则,其核外电子排布式应为
1s22s22p63s23p63d1
但是,依据前面所学能量最低原理可知,3d能级填充全空、4s填充一个电子时较稳定,故K的正确电子排布式为:
简化电子排布式?
如:
Na:1s22s22p63s1
[Ne]3s1
表示钠的内层电子排布与稀有气体元素Ne的核外电子排布相同
Ne:1s22s22p6
故钠的电子排布式可简化为
思考 与 交流
何为
电子排布式可以简化,如可以把钠的电子排布式写成[Ne]3s1。试问:上式方括号中的符号的意义是什么?你能仿照钠原子的简化电子排布式写出O、Si、Fe的简化电子排布式吗?
①“[Ne]”表示与Ne的核外电子排布相同,
即1s22s22p6
②简化方法:用上一周期的稀有气体符号代
替内层部分电子排布
氧O:[He]2s22p4 硅Si:[Ne]3s23p2
铁Fe:1s22s22p63s23p63d64s2? [Ar]3d64s2
各电子层最多容纳的电子数是2n2(n表示电子层)
第1层 最多排:
(K层)
2个
第2层 最多排:
8个
(L层)
第3层 最多排:
18个
(M层)
第4层 最多排:
32个
(N层)
K层:只有s能级
L层:有两个能级,分别为s能级 和 p能级
具体如下
(备注:每个轨道只能排2个电子)
只有一个轨道
只有1个轨道
有3个轨道
M层:有三个能级,分别为s、p能级和d能级
有5个轨道
N层:
有7个轨道
有四个能级,
分别为s、p、d能级和f能级
注意:核外电子排布的规律遵循的原理
1.能量最低原理(构造原理)
2.泡利原理
3.洪特规则
能量最低原理(构造原理)
电子先排能量低的内层,再排能量高的外层。
泡利原理
每个轨道最多只容纳两个电子,且自旋方向相反。
如:Ne原子的电子排布图(轨道表示式)为
1s
2s
2p
洪特规则
(1)电子在分布时,尽量分占同一能级的
不同轨道
如:N原子的电子排布图(轨道表示式)为
1s
2s
2p
1.试写出下列原子的电子排布图:
O
Al
Ar
1s
2s
2p
1s
2s
2p
3s
3p
1s
2s
2p
3s
3p
2.做P12学与问
洪特规则
(1)电子在分布时,尽量分占同一能级的
不同轨道。
(2)电子排布时轨道处于全满、半满、全
空时比较稳定。
课堂总结
一、原子的诞生
二、能层与能级
1.能层(1)定义
(2)每一能层电子数及能量
2.能级(1)定义
(2)符号
(3)各能级所能容纳的最多电子数
(4)能层的能级关系
三、构造原理
1.定义及构造原理示意图
2.电子排布式
板书设计
一、原子的诞生
二、能层与能级
1.能层
2.能级
三、构造原理
1.能量高低顺序
2.电子排布式
第一节
原子结构
第一章
学习目标
1.了解原子核外电子的运动状态;
2.了解原子结构的构造原理;
3.知道原子核外电子的能级分布,能用电
子排布式表示常见元素(1~36号)原子
核外电子的排布。
学习重难点
根据构造原理写出 1~36 号元素原子的电子排布式
宇宙大爆炸
氢是含量最高的元素,其次是氦
一 、开天辟地—原子的诞生
现代大爆炸宇宙学理论——
宇宙诞生于约140亿年前的一次大爆炸
阅读课本第4页第1~2段
氢
氦
锂
原子的结构
原子
原子核
核外电子
质子
中子
核电荷数=核内质子数=核外电子数
质量数=质子数+中子数
1、能层
按电子能量的高低及离核远近划分。
二、能层与能级
2n2
能层 一
二 三 四 五 六 七
符号 K L M N O P Q
最多容纳电子数 2 8 18 32 50 ……
离核远近 由近→到远
能量高低 由低→到高
(1)先排能量低的电子层,再排能量高的电子层,由里往外。
(2)每一层最多容纳电子数:2n2个。
(3)最外层电子数不超过8个(K层为最外层时不超过2个)。
(4)次外层电子数不超过18个,倒数第三层不超过32个。
核外电子的排布规律:
规定,任一能层的能级总是从 s 能级开始,依次称p、d、f、g能级……
能层 K L M N O
能级
最多 电子 数
2
2、能级
多电子原子中,同一能层的电子能量也有差别,按能量不同分成能级。
阅读教材P4,总结规律
2s 2p
4s 4p 4d 4f
3s 3p 3d
5s …
1s
2 6 10 14
2 6
2 6 10
2
8
18
32
K层:只有s能级
L层:有两个能级,分别为s能级 和 p能级
具体如下
(备注:每个轨道只能排2个电子)
M层:有三个能级,分别为s、p能级和d能级
N层:
有四个能级,
分别为s、p、d能级和f能级
学与问
1、原子核外电子的每一个能层最多可容纳的电子数与能层的序数(n)间存在什么关系?
2、不同能层分别有多少个能级,与能层的序数间存在什么关系?
答:每一层最多容纳电子数=2n2个。
答:①能层的能级数等于该能层序数,即
(第一能层) K能层:1个能级;
(第二能层) L能层:2个能级;
(第三能层) M能层:3个能级;……
②任一能层的能级总是从s能级开始。
③在每一能层中,能级符号与能量大小的顺序是:
ns
答:①各能级可容纳最多电子数按s、p、d、f…顺序
依次为1、3、5、7的二倍;
②不同能级中的s级,所容纳的电子数是相同的,
但是能量是不同的。
1.下列电子层中,包含有f 能级的是( )
A.K电子层 B.L电子层
C.M电子层 D.N电子层
解析: 能层数=能层中所包含的能级数。而要含有f能级则能层数必须大于4,即从N层往后才会出现f能级。
答案: D
2.下列说法中,不符合现代大爆炸宇宙学理论的是( ) A.我们所在的宇宙诞生于一次大爆炸B.恒星正在不断地合成自然界中没有的新元素 C.氢、氦等轻核元素是宇宙中天然元素之母 D.宇宙的所有原子中,最多的是氢元素的原子
B
3.若n=3,以下能级符号错误的是( )
A.np B.nf
C.nd D. ns
B
各能级上的电子有怎样的能量关系:
(1)相同能层:
①相同能级:E(npx)=E(npy)=E(npz);
②不同能级:E(ns)
①符号相同的能级:E(1s)
我们知道了原子核外电子的能层和能级可容纳的最
多电子数,是否就可以得出各种原子的电子排布情况呢?
三、构造原理
原子核外电子排布必须遵循一定的排布顺序 —构造原理
1、各能级的能量低高顺序
在多电子原子中,电子在能级上的排布顺序是电子最先排布在能量最低的能级上,然后依次排布在能量较高的能级上。
存在着能级交错
1s----2s----2p----3s----3p---4s----3d---4p----5s----4d----
核外电子排布的构造原理图
教材P6
E(ns)
★原子的电子排布遵循构造原
理使整个原子的能量处于最低状态,简称能量最低原理
练习题.按能量由低到高的顺序排列,正确的一组是( )
A.1s、2p、3d、4s B.1s、2s、3s、2p C.2s、2p、3s、3p D.4p、3d、4s、3p
C
2.电子排布式
将 上所容纳的电子数标在该能级符号 ,并按照能层从左到右的顺序排列的式子,称电子排布式,如氢元素的电子排布式为:
能级
右上角
原子的核外电子排布的表示方法
原子结构示意图 意义 将每个能层上的电子总数表示在原子核外的式子
实例
??
电子
排布式 意义 用数字在能级符号右上角标明该能级上排布的电子数,这就是电子排布式
实例 O 1s22s22p4
刚接触此类题目时,若直接书写电子排布式若有困难,可先写出原子的原子结构示意图,再据此写出电子排布式,如
已知碳( C )元素原子的电子排布式为: 1s22s22p2
试书写下列原子的电子排布式
S
B
Cl
Fe☆
1s22s22p63s23p4
1s22s22p1
1s22s22p63s23p5
1s22s22p63s23p63d64s2
何为外围电子排布式(简称价电子层)
电子能在化学反应中可发生变化的能级。
如:
29Cu:3d104s1
19K:4s1
17Cl:3s23p5
(并不一定是最外层)
思考与交流
试书写N、Cl、K、Ca2+ 、
26Fe原子的 核外电子
排布式
①不符合构造原理。
原因:在同一能级的电子排布全充满或全空状态、
或半充满状态具有较低的能量和较大的稳定性
如对于Cr原子而言,外围电子呈3d54s1排布时,3d 、4s轨道上的电子均为半满状态时,整个体系的能量最低。
全充满: s2 p6 d10 f14 (稀有气体)
半充满: s1 p3 d5 f7 (VI A元素)
全 空: s0 p0 d0 f0 (Ca、Ag等)
相对
稳定
状态:
思考:Cr的电子排布式该如何写呢?
试写出铜的核外电子排布式
1s22s22p63s23p63d54s1
29号元素铜的电子排布式正确的是( )
A.1s22s22p63s23p64s13d10
B.1s22s22p63s23p63d104s1
C.1s22s22p63s23p63d94s2
D.1s22s22p63s23p63d84s24p1
答案: B
思考与交流: 从元素周期表中查出银、金的外围电子层排布。它们是否符合构造原理?
?答:不符合。大多数元素的原子核外电子排布符合构造原理,有少数元素的基态原子的电子排布对于构造原理有一个电子的偏差,如:
24号铬Cr:3d54s1;?? ?
29号铜Cu:3d104s1
47号银Ag:4d105s1;?? ?
79号金Au:5d106s1;?
各有电子的能级都排满了
如:稀有气体、ⅡA 、
全 满
特点:s2,p6,d10,f14
有电子的某一能级只排了该能级最大容量的一半电子
如:ⅠA、
半 满
特点:s1或p3或d5或f7
ⅤA等
Cr的核外电子排布式应为:
1s22s22p63s23p63d54s1
如果按照各能级填充规则,其核外电子排布式应为
1s22s22p63s23p63d44s2
但是,依据前面所学能量最低原理可知,3d能级填充5个电子、4s能级填充1个电子时较稳定,故Cr的正确电子排布式为:
在有电子的情况下,未排内层能级,便排外层能级
如:Ca、Ag等
全 空
特点:s0或p0或d0
K的核外电子排布式应为:
1s22s22p63s23p64s1
如果按照各能级填充规则,其核外电子排布式应为
1s22s22p63s23p63d1
但是,依据前面所学能量最低原理可知,3d能级填充全空、4s填充一个电子时较稳定,故K的正确电子排布式为:
简化电子排布式?
如:
Na:1s22s22p63s1
[Ne]3s1
表示钠的内层电子排布与稀有气体元素Ne的核外电子排布相同
Ne:1s22s22p6
故钠的电子排布式可简化为
思考 与 交流
何为
电子排布式可以简化,如可以把钠的电子排布式写成[Ne]3s1。试问:上式方括号中的符号的意义是什么?你能仿照钠原子的简化电子排布式写出O、Si、Fe的简化电子排布式吗?
①“[Ne]”表示与Ne的核外电子排布相同,
即1s22s22p6
②简化方法:用上一周期的稀有气体符号代
替内层部分电子排布
氧O:[He]2s22p4 硅Si:[Ne]3s23p2
铁Fe:1s22s22p63s23p63d64s2? [Ar]3d64s2
各电子层最多容纳的电子数是2n2(n表示电子层)
第1层 最多排:
(K层)
2个
第2层 最多排:
8个
(L层)
第3层 最多排:
18个
(M层)
第4层 最多排:
32个
(N层)
K层:只有s能级
L层:有两个能级,分别为s能级 和 p能级
具体如下
(备注:每个轨道只能排2个电子)
只有一个轨道
只有1个轨道
有3个轨道
M层:有三个能级,分别为s、p能级和d能级
有5个轨道
N层:
有7个轨道
有四个能级,
分别为s、p、d能级和f能级
注意:核外电子排布的规律遵循的原理
1.能量最低原理(构造原理)
2.泡利原理
3.洪特规则
能量最低原理(构造原理)
电子先排能量低的内层,再排能量高的外层。
泡利原理
每个轨道最多只容纳两个电子,且自旋方向相反。
如:Ne原子的电子排布图(轨道表示式)为
1s
2s
2p
洪特规则
(1)电子在分布时,尽量分占同一能级的
不同轨道
如:N原子的电子排布图(轨道表示式)为
1s
2s
2p
1.试写出下列原子的电子排布图:
O
Al
Ar
1s
2s
2p
1s
2s
2p
3s
3p
1s
2s
2p
3s
3p
2.做P12学与问
洪特规则
(1)电子在分布时,尽量分占同一能级的
不同轨道。
(2)电子排布时轨道处于全满、半满、全
空时比较稳定。
课堂总结
一、原子的诞生
二、能层与能级
1.能层(1)定义
(2)每一能层电子数及能量
2.能级(1)定义
(2)符号
(3)各能级所能容纳的最多电子数
(4)能层的能级关系
三、构造原理
1.定义及构造原理示意图
2.电子排布式
板书设计
一、原子的诞生
二、能层与能级
1.能层
2.能级
三、构造原理
1.能量高低顺序
2.电子排布式
