人教版高二化学选修三第二章第二节2.2.1杂化轨道理论 第一课时(共24张PPT)
文档属性
| 名称 | 人教版高二化学选修三第二章第二节2.2.1杂化轨道理论 第一课时(共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-10 08:59:05 | ||
图片预览





文档简介
(共24张PPT)
杂化轨道
第一课时
化学
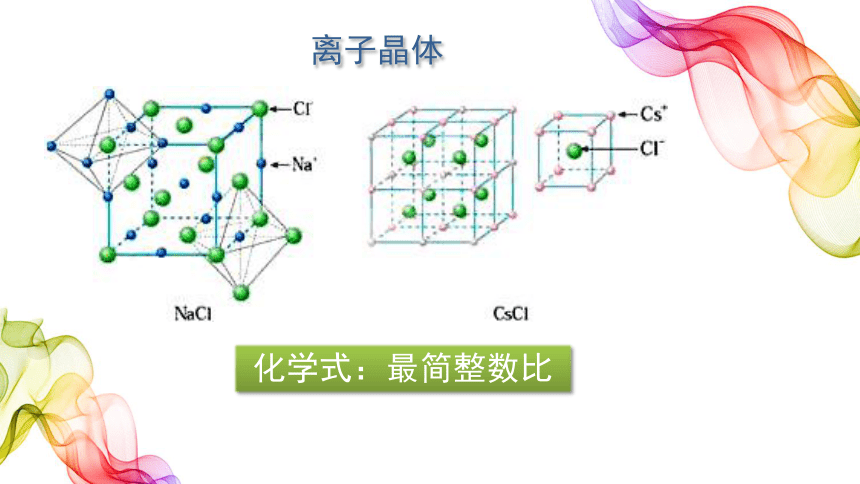
化学式:最简整数比
离子晶体
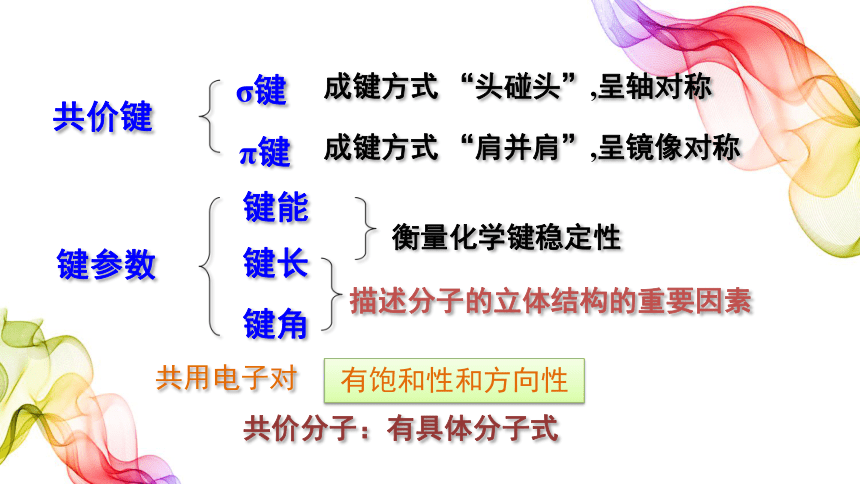
共价键
σ键
π键
键参数
键能
键长
键角
衡量化学键稳定性
描述分子的立体结构的重要因素
成键方式 “头碰头”,呈轴对称
成键方式 “肩并肩”,呈镜像对称
共用电子对
有饱和性和方向性
共价分子:有具体分子式
BeCl2
Be:IIA Cl:VIIA
Be
Al
电负性: 1.5 3.0
差值:1.5<1.7
2s
2p
Be原子的基态
3s
3p
… …
Cl Be Cl
2s
2p
美国科学家鲍林受生物杂交思想的启发于1931年提出杂化轨道理论,成功解决这一问题。他认为---
在同一个原子中能量相近的不同类型的几个原子轨道“混合”起来,杂化后形成同等数目的能量完全相同的新轨道,这些新轨道重新分配能量和空间方向,组成成键能力更强的杂化轨道
2s
2p
Be原子的基态
2s
2p
激发态
激发
sp杂化轨道
2p
杂化
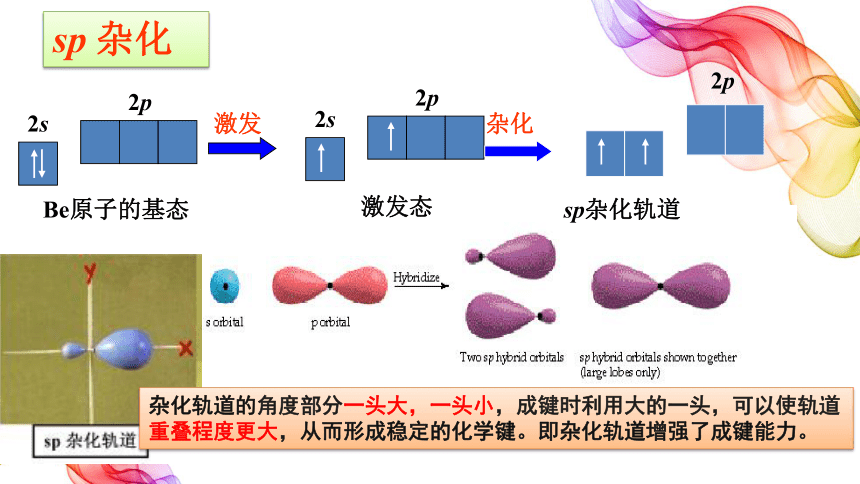
杂化轨道的角度部分一头大,一头小,成键时利用大的一头,可以使轨道重叠程度更大,从而形成稳定的化学键。即杂化轨道增强了成键能力。
sp 杂化
1个s轨道和1个p轨道发生杂化,得到2个能量相等、成分和形状完全相同(每个sp杂化轨道都含有1/2的s轨道和1/2的p轨道的成分)的轨道,杂化轨道之间的夹角是180°
Be
Cl
Cl
180o
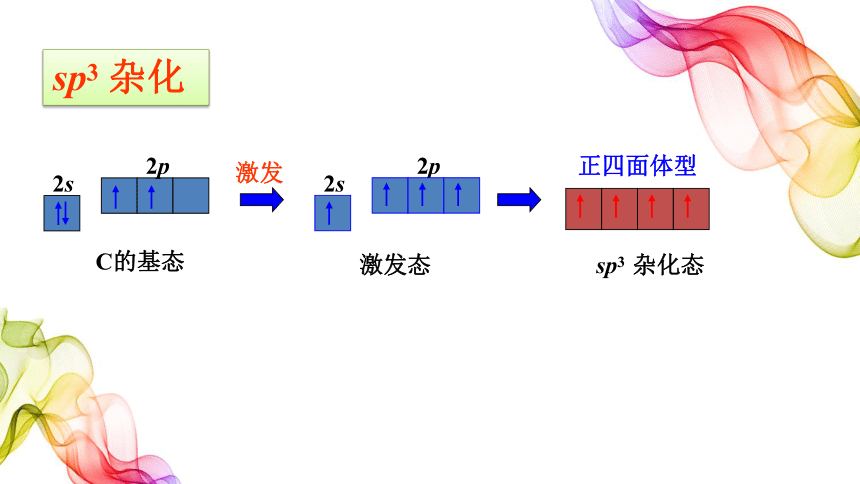
C原子的价电子
2s
2p
有机物中碳原子有且仅有四个价键
CH4
2s
2p
C的基态
2s
2p
激发态
正四面体型
sp3 杂化态
激发
sp3 杂化
sp3 杂化
sp3杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
1个2s轨道和3个2p轨道进行sp3杂化
4个完全等同sp3杂化轨道
1个s轨道+2个p轨道杂化?
B
F
F
F
2s
2p
B的基态
2p
2s
激发态
正三角形
sp2 杂化态
激发
sp2杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
1个2s轨道和2个2p轨道进行sp2杂化
3个完全等同sp2杂化轨道
sp2杂化
回顾一:
①是否所有的原子轨道都能发生杂化?
②杂化前后原子轨道数发生变化了没有?
只有能量相近的原子轨道才能发生杂化。
杂化轨道的数目与组成杂化轨道的各原子轨道的数目相等。
③杂化轨道的形状和伸展方向与单纯的s轨道和p轨道一样吗?如果不一样,成键能力如何变化?
杂化轨道的电子云形状一头大,一头小。杂化轨道增强了成σ键的能力。
你能用杂化轨道理论分析乙烷、乙烯的成键情况吗?
C2H6分子形成
2s
2p
C的基态
2s
2p
激发态
正四面体形
sp3 杂化态
激发
C原子在形成乙烷分子时,每个碳原子的1个2s轨道与3个2p轨道发生杂化,形成4个sp3杂化轨道,伸向空间正四面体的三个顶点。
杂化
每个C原子的3个sp3杂化轨道分别与3个H原子的1s轨道形成3个相同的C—Hσ键。两个C各自剩余的1个sp3杂化轨道相互重叠形成1个C—Cσ键。
1
H
H
H
H
H
H
C原子在形成乙烯分子时,每个碳原子的1个2s轨道与2个2p轨道发生杂化,形成3个sp2杂化轨道,伸向平面正三角形的三个顶点。
C2H4分子形成
2s
2p
C的基态
2s
2p
激发态
激发
杂化
正三角形
sp2 杂化态
C2H4分子中,C原子均采用sp2杂化,每个C原子的2个sp2杂化轨道分别与2个H原子的1s轨道重叠形成C—H σ 键;两个C原子各以1个sp2杂化轨道发生重叠形成C—C σ 键。
每个碳原子各以1个未参与杂化的2p轨道肩并肩重叠形成 π 键。在与溴发生加成反应时, π 键发生断裂。
C2H2分子形成
C原子在形成乙炔分子时,每个碳原子的2s轨道与1个2p轨道发生杂化,形成2个sp杂化轨道,形成直线型。
2s
2p
C的基态
2s
2p
激发态
激发
杂化
直线形
sp杂化态
谢 谢 !
杂化轨道
第一课时
化学
化学式:最简整数比
离子晶体
共价键
σ键
π键
键参数
键能
键长
键角
衡量化学键稳定性
描述分子的立体结构的重要因素
成键方式 “头碰头”,呈轴对称
成键方式 “肩并肩”,呈镜像对称
共用电子对
有饱和性和方向性
共价分子:有具体分子式
BeCl2
Be:IIA Cl:VIIA
Be
Al
电负性: 1.5 3.0
差值:1.5<1.7
2s
2p
Be原子的基态
3s
3p
… …
Cl Be Cl
2s
2p
美国科学家鲍林受生物杂交思想的启发于1931年提出杂化轨道理论,成功解决这一问题。他认为---
在同一个原子中能量相近的不同类型的几个原子轨道“混合”起来,杂化后形成同等数目的能量完全相同的新轨道,这些新轨道重新分配能量和空间方向,组成成键能力更强的杂化轨道
2s
2p
Be原子的基态
2s
2p
激发态
激发
sp杂化轨道
2p
杂化
杂化轨道的角度部分一头大,一头小,成键时利用大的一头,可以使轨道重叠程度更大,从而形成稳定的化学键。即杂化轨道增强了成键能力。
sp 杂化
1个s轨道和1个p轨道发生杂化,得到2个能量相等、成分和形状完全相同(每个sp杂化轨道都含有1/2的s轨道和1/2的p轨道的成分)的轨道,杂化轨道之间的夹角是180°
Be
Cl
Cl
180o
C原子的价电子
2s
2p
有机物中碳原子有且仅有四个价键
CH4
2s
2p
C的基态
2s
2p
激发态
正四面体型
sp3 杂化态
激发
sp3 杂化
sp3 杂化
sp3杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
1个2s轨道和3个2p轨道进行sp3杂化
4个完全等同sp3杂化轨道
1个s轨道+2个p轨道杂化?
B
F
F
F
2s
2p
B的基态
2p
2s
激发态
正三角形
sp2 杂化态
激发
sp2杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
1个2s轨道和2个2p轨道进行sp2杂化
3个完全等同sp2杂化轨道
sp2杂化
回顾一:
①是否所有的原子轨道都能发生杂化?
②杂化前后原子轨道数发生变化了没有?
只有能量相近的原子轨道才能发生杂化。
杂化轨道的数目与组成杂化轨道的各原子轨道的数目相等。
③杂化轨道的形状和伸展方向与单纯的s轨道和p轨道一样吗?如果不一样,成键能力如何变化?
杂化轨道的电子云形状一头大,一头小。杂化轨道增强了成σ键的能力。
你能用杂化轨道理论分析乙烷、乙烯的成键情况吗?
C2H6分子形成
2s
2p
C的基态
2s
2p
激发态
正四面体形
sp3 杂化态
激发
C原子在形成乙烷分子时,每个碳原子的1个2s轨道与3个2p轨道发生杂化,形成4个sp3杂化轨道,伸向空间正四面体的三个顶点。
杂化
每个C原子的3个sp3杂化轨道分别与3个H原子的1s轨道形成3个相同的C—Hσ键。两个C各自剩余的1个sp3杂化轨道相互重叠形成1个C—Cσ键。
1
H
H
H
H
H
H
C原子在形成乙烯分子时,每个碳原子的1个2s轨道与2个2p轨道发生杂化,形成3个sp2杂化轨道,伸向平面正三角形的三个顶点。
C2H4分子形成
2s
2p
C的基态
2s
2p
激发态
激发
杂化
正三角形
sp2 杂化态
C2H4分子中,C原子均采用sp2杂化,每个C原子的2个sp2杂化轨道分别与2个H原子的1s轨道重叠形成C—H σ 键;两个C原子各以1个sp2杂化轨道发生重叠形成C—C σ 键。
每个碳原子各以1个未参与杂化的2p轨道肩并肩重叠形成 π 键。在与溴发生加成反应时, π 键发生断裂。
C2H2分子形成
C原子在形成乙炔分子时,每个碳原子的2s轨道与1个2p轨道发生杂化,形成2个sp杂化轨道,形成直线型。
2s
2p
C的基态
2s
2p
激发态
激发
杂化
直线形
sp杂化态
谢 谢 !
