沪教版(上海)初中化学九年级第二学期第五单元 初识酸和碱检测题(含答案)
文档属性
| 名称 | 沪教版(上海)初中化学九年级第二学期第五单元 初识酸和碱检测题(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 137.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-10 00:00:00 | ||
图片预览


文档简介
《初识酸和碱》检测题
一、单选题
1.下列物质分别和36.5g20%的盐酸恰好完全反应后,所得溶液中溶质质量分数最小的是
A.Mg B.MgO C.Mg(OH)2 D.MgCO3
2.下列关于化学反应A+B→C+D的叙述,正确的是
A.该反应一定属于置换反应或复分解反应
B.A、B的相对分子质量之和,一定等于C、D的相对分子质量之和
C.若C为水,则A、B中至少有一种物质为酸或碱
D.A为酸,则C、D一定有一种物质为盐
3.下列各组物质能在pH=1的溶液中大量共存,且能形成无色溶液的是( )
A.NaCl、BaCl2、Na2SO4 B.HCl、KCl、NaNO3
C.CuSO4、KNO3、NH4NO3 D.Na2CO3、NaCl、KNO3
4.通过下列实验现象,能说明氢氧化钠与稀硫酸发生了化学反应的是( )
A.在稀硫酸中加入一定量的氢氧化钠固体,用温度计测得溶液的温度显著升高
B.在的氢氧化钠溶液中加入一定量的稀硫酸,用pH计测得溶液的pH值变为8
C.在氢氧化钠溶液中先滴加无色酚酞,再逐滴加入稀硫酸,看到酚酞红色逐渐变浅
D.在氢氧化钠溶液中先加入一定量的稀硫酸,再逐滴加入硫酸铜溶液,无明显现象
5.下列物质分类的说法中正确的是( )
A.化石燃料:煤,石油,一氧化碳 B.合成材料:塑料,合成纤维,合金
C.碱:火碱,纯碱,熟石灰 D.有机化合物:甲烷,乙醇,蛋白质
6.在烧杯中加入10mLNaOH溶液,滴入几滴酚酞溶液,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液恰好由红色变成无色为止,则所得溶液的pH为
A.0 B.3 C.7 D.10
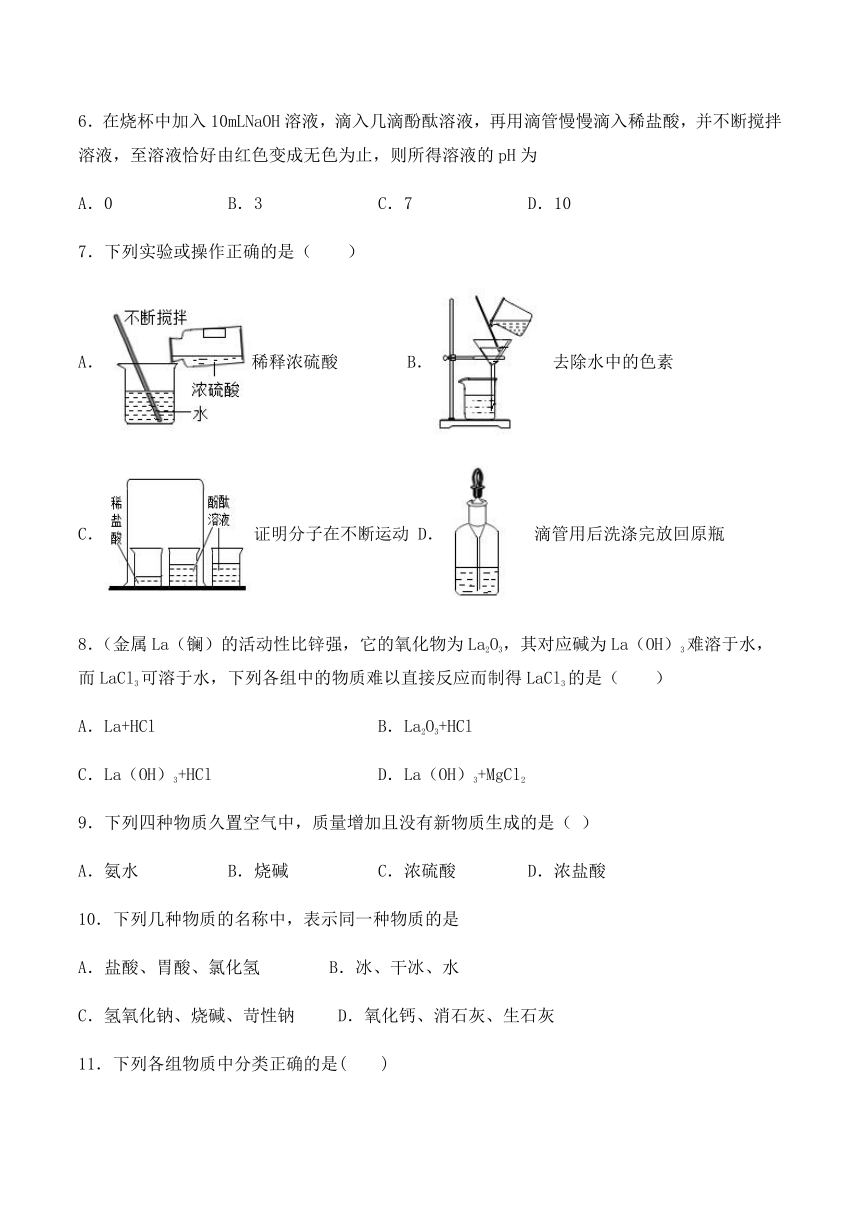
7.下列实验或操作正确的是( )
A.稀释浓硫酸 B.去除水中的色素
C.证明分子在不断运动 D.滴管用后洗涤完放回原瓶
8.(金属La(镧)的活动性比锌强,它的氧化物为La2O3,其对应碱为La(OH)3难溶于水,而LaCl3可溶于水,下列各组中的物质难以直接反应而制得LaCl3的是( )
A.La+HCl B.La2O3+HCl
C.La(OH)3+HCl D.La(OH)3+MgCl2
9.下列四种物质久置空气中,质量增加且没有新物质生成的是( )
A.氨水 B.烧碱 C.浓硫酸 D.浓盐酸
10.下列几种物质的名称中,表示同一种物质的是
A.盐酸、胃酸、氯化氢 B.冰、干冰、水
C.氢氧化钠、烧碱、苛性钠 D.氧化钙、消石灰、生石灰
11.下列各组物质中分类正确的是( )
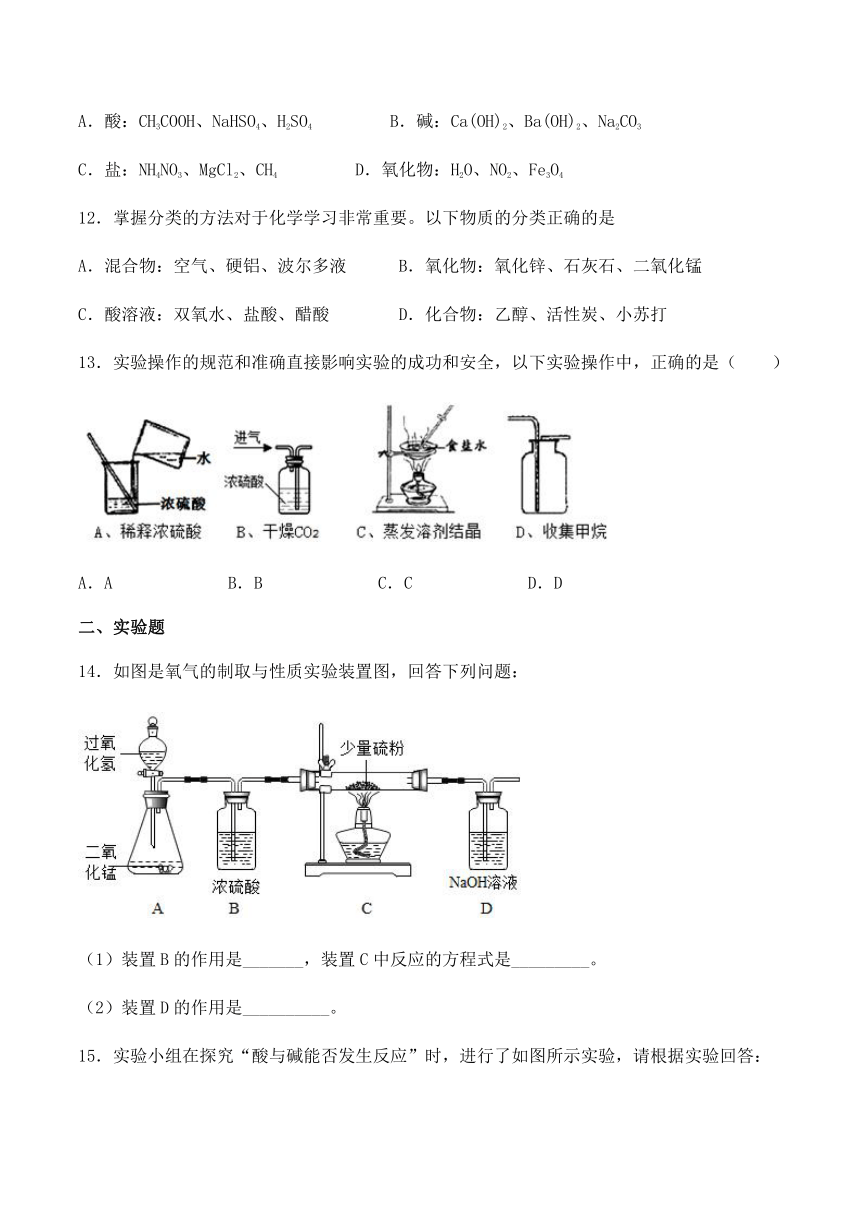
A.酸:CH3COOH、NaHSO4、H2SO4 B.碱:Ca(OH)2、Ba(OH)2、Na2CO3
C.盐:NH4NO3、MgCl2、CH4 D.氧化物:H2O、NO2、Fe3O4
12.掌握分类的方法对于化学学习非常重要。以下物质的分类正确的是
A.混合物:空气、硬铝、波尔多液 B.氧化物:氧化锌、石灰石、二氧化锰
C.酸溶液:双氧水、盐酸、醋酸 D.化合物:乙醇、活性炭、小苏打
13.实验操作的规范和准确直接影响实验的成功和安全,以下实验操作中,正确的是( )
A.A B.B C.C D.D
二、实验题
14.如图是氧气的制取与性质实验装置图,回答下列问题:
(1)装置B的作用是_______,装置C中反应的方程式是_________。
(2)装置D的作用是__________。
15.实验小组在探究“酸与碱能否发生反应”时,进行了如图所示实验,请根据实验回答:
(1)实验中观察到的明显现象是_____,此时溶液的pH_____(填“>”、“<”或“=”)7,说明酸能与碱发生化学反应。
(2)写出该实验中的化学方程式_____。
三、推断题
16.推断题:如下图所示,A~H是初中化学常见的物质,已知A中含有两种元素,A和B可发生中和反应,C为生活中最常见的液体,F可供给呼吸,X常用作食品干燥剂。Y为单质。
请根据图示回答下列问题:
(1)H的化学式为______。
(2)反应②的基本类型为______。
(3)A和B反应的化学方程式为_________。
(4)写出物质B的一种用途_________。
17.如图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答:
(1)溶液X是________(填“酸”或“碱”),试剂A的名称是________。
(2)若X是稀硫酸,B是氧化物,则B的化学式为________。
(3)若X是稀盐酸,C是单质,则C与X反应的化学方程式_____________。
(4)若X是稀硫酸,D是氧化物,则X与D反应的化学方程式为______________。
18.A~E是五种不同类别的常见物质:铁、二氧化碳、氢氧化钙、氯化铜、硫酸中的某一种,B常用于中和酸性土壤,E属于酸类物质,它们之间的相互关系如图所示(其中实线表示物质间可以相互反应,虚线表示物质间不能反应)。请回答下列问题:
(1)E的化学式为_____,B与E反应的化学方程式为__________,该反应的类型是_____。
(2)C和D反应的化学方程式为_______________。
(3)虚线相邻物质间存在转化关系的是__________。(填化学式)
四、计算题
19.日常生活中,人们利用碳酸钠溶液具有碱性,清洗餐具上的油污,碱性越强,去油污的效果越好。下面实验是影响碳酸钠溶液碱性的因素展开探究。用碳酸钠固体和不同温度的水,配置溶质质量分数分别为 2%、6%和10%的碳酸钠溶液,立即测量溶液的pH,记录如下表:
实验编号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
溶质质量分数 2% 2% 2% 6% 6% 6% 10% 10% 10%
水的温度/°C 20 40 60 20 40 60 20 40 60
溶液 pH 10.90 11.18 11.26 11.08 11.27 11.30 11.22 11.46 11.50
(1)去油污的效果最好的是___________ (填实验编号)。
(2) 在一定温度范围内,温度对碳酸钠溶液pH的影响是:当_______相同时,______。
(3)如果某实验小组想得到更好的去污效果,根据之前的实验规律,可以尝试的实验条件是__________________
A 12%、 60°C B 8%、 40° C C 10%、 70°C
(4)碳酸钠溶液呈碱性的原因是:一部分碳酸根离子水解产生碳酸氢根离子和氢氧根离子,少部分碳酸氢根离子水解产生碳酸和氢氧根离子。计算100g10%碳酸钠溶液中碳元素的质量是_________g(精确到0.1)
20.(1)配制200g质量分数为5%的氢氧化钠溶液,需要需要水______mL.配制时用到玻璃仪器有______、烧杯、玻璃棒和胶头滴管。(水的密度近似看作1g/cm3)
(2)用配得氢氧化钠溶液与某硫酸溶液反应,如图是利用数字化传感器得到的溶液pH变化图象。
①根据图中曲线,判断进行的操作是______(填字母)。
A 将硫酸溶液逐滴滴加到氢氧化钠溶液中
B 将氢氧化钠溶液逐滴滴加到硫酸溶液中
②从微观角度分析,该反应实质为______。
③b点对应的溶液中的溶质为______(写化学式)。
④若80g 5%的氢氧化钠溶液能恰好中和50g硫酸溶液,试计算该硫酸溶液的溶质质量分数_____。(请写出计算过程)。
参考答案
1.C 2.D 3.B 4.D 5.D 6.C 7.A 8.D 9.C 10.C 11.D 12.A 13.C
14.除去水蒸气 吸收二氧化硫,防止污染空气
15.溶液由无变为红色 > HCl+NaOH═NaCl+H2O
16. 化合反应 改良酸性士壤(合理即可)
17.酸 紫色石蕊试液 Fe2O3 Fe+2HCl ===Fe Cl2 + H2↑ H2SO4+ CuO=== CuSO4 + H2O
18.H2SO4 Ca(OH)2+H2SO4===CaSO4+2H2O 复分解反应 Fe+CuCl2===FeCl2+Cu H2SO4→CO2
19.⑨ 碳酸钠溶液质量分数 温度越高pH值越大 A、C 1.1
20.190, 量筒 B 氢离子和氢氧根离子结合成水分子 Na2SO4、NaOH 9.8%
