人教化学选修3第一章第二节 原子结构与元素的性质 (共26张PPT)
文档属性
| 名称 | 人教化学选修3第一章第二节 原子结构与元素的性质 (共26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-11 14:33:23 | ||
图片预览





文档简介
(共26张PPT)
第一章 原子结构与性质
第二节
《原子结构与元素
的性质》
科学探究:
根据核外电子构造原理,分析
1、每周期的元素种类有多少?为什么?
2、观察周期表中各族元素的价电子(即外围
电子)排布,从中找出核外电子排布与族
划分之间的内在联系。
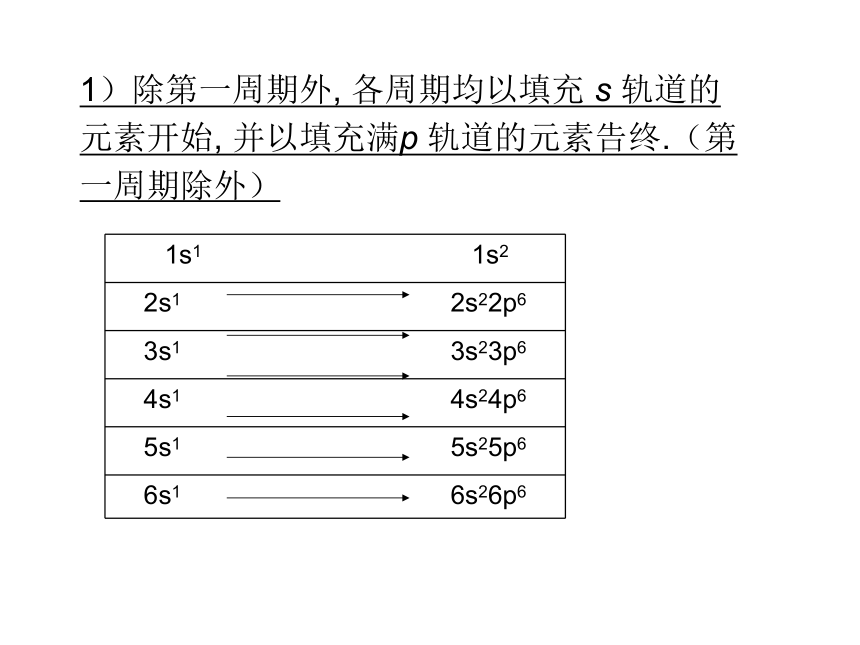
1)除第一周期外, 各周期均以填充 s 轨道的元素开始, 并以填充满p 轨道的元素告终.(第一周期除外)
1s1 1s2
2s1 2s22p6
3s1 3s23p6
4s1 4s24p6
5s1 5s25p6
6s1 6s26p6
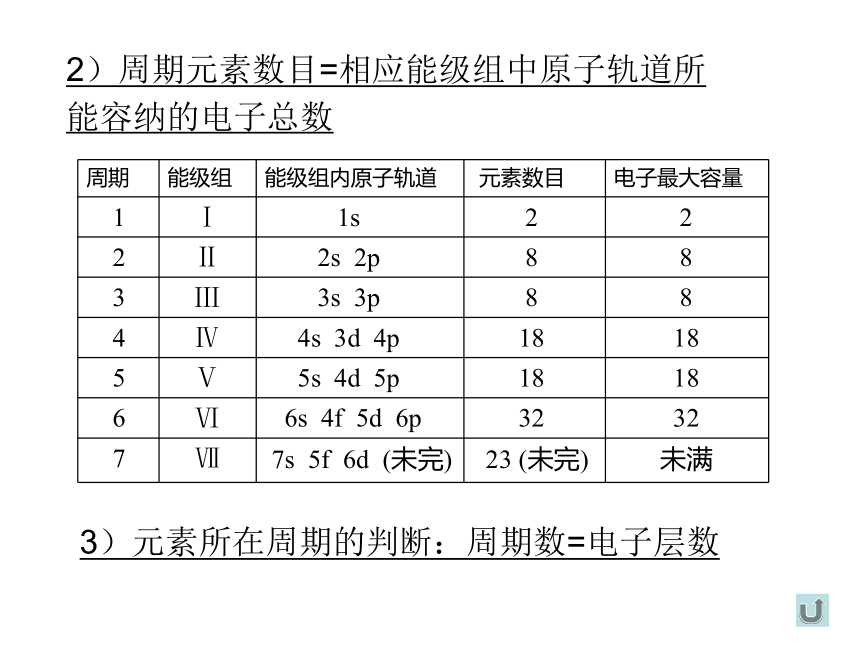
2)周期元素数目=相应能级组中原子轨道所 能容纳的电子总数
3)元素所在周期的判断:周期数=电子层数
周期 能级组 能级组内原子轨道 元素数目 电子最大容量
1 Ⅰ 1s 2 2
2 Ⅱ 2s 2p 8 8
3 Ⅲ 3s 3p 8 8
4 Ⅳ 4s 3d 4p 18 18
5 Ⅴ 5s 4d 5p 18 18
6 Ⅵ 6s 4f 5d 6p 32 32
7 Ⅶ 7s 5f 6d (未完) 23 (未完) 未满
主族元素(A):
1、价电子全部排布在最外层的s或p轨道上
2、内层d轨道全空或者全满
3、族序数 = 价电子数(最外层电子数)
副族元素(B):
1、价电子排布为(n-1)d1-10ns1-2
2、价电子不再是最外层电子
3、族序数 = ns电子数+(n-1)d电子数
第Ⅷ族元素:
价电子排布为(n-1)d6-8ns2
第零族元素:
价电子排布为ns2np6 或1s2
4)ds 区元素: ⅠB和ⅡB ;(n-1)d10ns1~2
3)d 区元素:过渡元素,ⅢB~ⅦB和 Ⅷ;(n-1)d1~10ns1~2
镧系 f
锕系
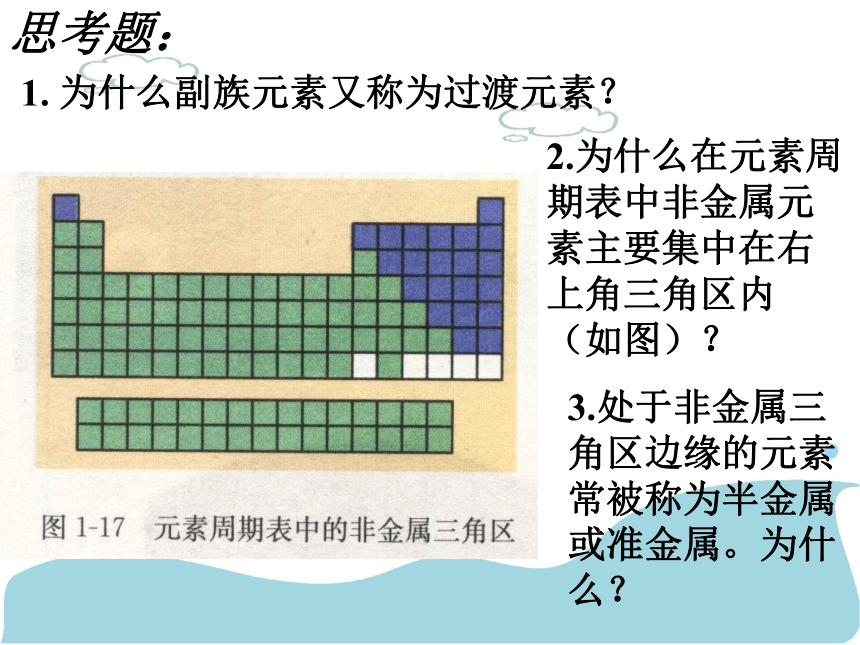
1. 为什么副族元素又称为过渡元素?
2.为什么在元素周期表中非金属元素主要集中在右上角三角区内(如图)?
3.处于非金属三角区边缘的元素常被称为半金属或准金属。为什么?
思考题:
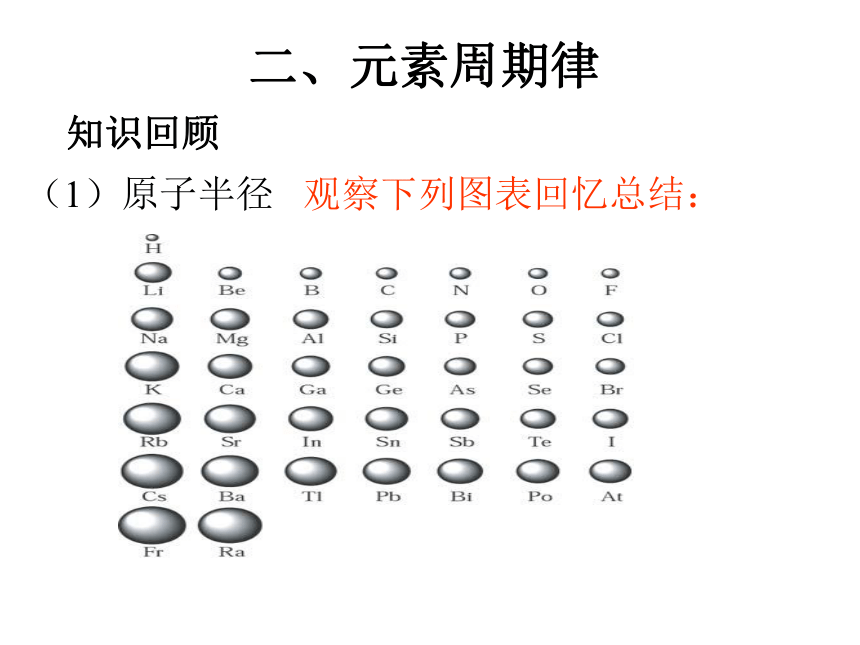
(1)原子半径
观察下列图表回忆总结:
二、元素周期律
知识回顾
元素周期表中,同周期主族元素从左到右,原子半径的变化趋势如何?应如何理解这种趋势?
元素周期表中,同主族元素从上到下,原子半径的变化趋势如何?应如何理解这种趋势?
原子半径的大小取决于两个相反的因素:
1、电子的能层数
2、核电荷数。
(2)主要化合价
主族元素:
最高正价= 最外层电子数
负价的绝对值 = 8 - 最外层电子数
同周期:________________________
副族元素:
价电子处于最外层和倒数第二层,化合价
比较复杂。
(3)元素的金属性与非金属性
金属性的具体表现:
(1)与酸反应或与水反应
(2)最高价氧化物的水化物的碱性
(3)阳离子的氧化性
非金属性的具体表现:
(1)与氢气的化合能力
(2)最高价氧化物的水化物的酸性
(3)气态氢化物的稳定性
(4)阴离子的还原性
(4)电离能
[基础要点]概念
1、第一电离能I1; 态电 性基态原子失去 个电子,转化为气态基态正离子所需要的 叫做第一电离能。第一电离能越大,金属活动性越 。同一元素的第二电离能 第一电离能。
气
中
一
最低能量
弱
大于
2、如何理解第二电离能I2、第三电离能I3 、I4、I5…… ?
从一价气态基态正离子中再失去一个电子所需
消耗的能量叫做第二电离能(用I2表示),依次
类推,可得到I3、I4、I5……同一种元素的逐
级电离能的大小关系:I1一个原子的逐级电离能是逐渐增大的。这是因
为随着电子的逐个失去,阳离子所带的正电荷
数越来越大,再要失去一个电子需克服的电性
引力也越来越大,消耗的能量也越来越多。
分析下表:
〖科学探究〗
⑴、原子的第一电离能有什么变化规律呢?
第一电离能
周一周期
同一族
从左往右,第一电离能呈增大的趋势
从上到下,第一电离能呈减小趋势。
⑵、碱金属元素的第一电离能有什么变化规律呢?碱金属的电离能与金属活泼性有什么关系为什么?
碱金属元素从上到下,第一电离能变小.第一电离能越小,越易失电子,金属的活泼性就越强。因此碱金属元素的第一电离能越小,金属的活泼性就越强。
⑶、Be的第一电离能大于B,N的第一电离能大于O,Mg的第一电离能大于Al,Zn的第一电离能大于Ga?
Be有价电子排布为2s2,是全充满结构,比较稳定,而B的价电子排布为2s22p1,、比Be不稳定,因此失去第一个电子B比Be容易,第一电离能小
⑸、阅读分析表格数据:
Na Mg Al
各级电离能(KJ/mol) 496 738 578
4562 1415 1817
6912 7733 2745
9543 10540 11575
13353 13630 14830
16610 17995 18376
20114 21703 23293
为什么原子的逐级电离能越来越大?这些数据与钠、镁、铝的化合价有什么关系?数据的突跃变化说明了什么?
Na的I1,比I2小很多,电离能差值很大,说明失去第一个电子比失去第二电子容易得多,所以Na容易失去一个电子形成+1价离子;Mg的I1和I2相差不多,而I2比I3小很多,所以Mg容易失去两个电子形成十2价离子;Al的I1、I2、I3相差不多,而I3比I4小很多,所以A1容易失去三个电子形成+3价离子。而电离能的突跃变化,说明核外电子是分能层排布的。
(5)电负性:
〖思考与交流〗
1、什么是电负性?电负性的大小体现了 什么性质?阅读教材p20页表
电负性是用来描述不同元素的原子对键
合电子吸引力的大小
电负性的大小体现了元素的金属性与非金属性的强弱,电负性越大元素的非金属性越强,电负性越小元素的金属性越强.
2、同周期元素、同主族元素电负性如何变化规律?如何理解这些规律?根据电负性大小,判断氧的非金属性与氯的非金属性哪个强?
同周期元素从左往右,电负性逐渐增大,同主族元素从上往下,电负性逐渐减小。
非金属性:氧大于氯
同周期元素从左往右,非金属性增强;同主族元素从上往下,金属性增强
3、电负性的应用:
①判断元素的金属性和非金属性的强弱
一般:非金属>1.8 金属<1.8 类金属≈1.8
②判断化学键的类型
一般:成键元素原子的电负性差>1.7,离子键
成键元素原子的电负性差<1.7,共价键
例:H:2.1,Cl:3.0 3.0-2.1=0.9
HCl为共价化合物
③判断化合物中元素化合价的正负
例:NaH中,Na:0.9 H:2.1
Na显正价,H显负价
第一章 原子结构与性质
第二节
《原子结构与元素
的性质》
科学探究:
根据核外电子构造原理,分析
1、每周期的元素种类有多少?为什么?
2、观察周期表中各族元素的价电子(即外围
电子)排布,从中找出核外电子排布与族
划分之间的内在联系。
1)除第一周期外, 各周期均以填充 s 轨道的元素开始, 并以填充满p 轨道的元素告终.(第一周期除外)
1s1 1s2
2s1 2s22p6
3s1 3s23p6
4s1 4s24p6
5s1 5s25p6
6s1 6s26p6
2)周期元素数目=相应能级组中原子轨道所 能容纳的电子总数
3)元素所在周期的判断:周期数=电子层数
周期 能级组 能级组内原子轨道 元素数目 电子最大容量
1 Ⅰ 1s 2 2
2 Ⅱ 2s 2p 8 8
3 Ⅲ 3s 3p 8 8
4 Ⅳ 4s 3d 4p 18 18
5 Ⅴ 5s 4d 5p 18 18
6 Ⅵ 6s 4f 5d 6p 32 32
7 Ⅶ 7s 5f 6d (未完) 23 (未完) 未满
主族元素(A):
1、价电子全部排布在最外层的s或p轨道上
2、内层d轨道全空或者全满
3、族序数 = 价电子数(最外层电子数)
副族元素(B):
1、价电子排布为(n-1)d1-10ns1-2
2、价电子不再是最外层电子
3、族序数 = ns电子数+(n-1)d电子数
第Ⅷ族元素:
价电子排布为(n-1)d6-8ns2
第零族元素:
价电子排布为ns2np6 或1s2
4)ds 区元素: ⅠB和ⅡB ;(n-1)d10ns1~2
3)d 区元素:过渡元素,ⅢB~ⅦB和 Ⅷ;(n-1)d1~10ns1~2
镧系 f
锕系
1. 为什么副族元素又称为过渡元素?
2.为什么在元素周期表中非金属元素主要集中在右上角三角区内(如图)?
3.处于非金属三角区边缘的元素常被称为半金属或准金属。为什么?
思考题:
(1)原子半径
观察下列图表回忆总结:
二、元素周期律
知识回顾
元素周期表中,同周期主族元素从左到右,原子半径的变化趋势如何?应如何理解这种趋势?
元素周期表中,同主族元素从上到下,原子半径的变化趋势如何?应如何理解这种趋势?
原子半径的大小取决于两个相反的因素:
1、电子的能层数
2、核电荷数。
(2)主要化合价
主族元素:
最高正价= 最外层电子数
负价的绝对值 = 8 - 最外层电子数
同周期:________________________
副族元素:
价电子处于最外层和倒数第二层,化合价
比较复杂。
(3)元素的金属性与非金属性
金属性的具体表现:
(1)与酸反应或与水反应
(2)最高价氧化物的水化物的碱性
(3)阳离子的氧化性
非金属性的具体表现:
(1)与氢气的化合能力
(2)最高价氧化物的水化物的酸性
(3)气态氢化物的稳定性
(4)阴离子的还原性
(4)电离能
[基础要点]概念
1、第一电离能I1; 态电 性基态原子失去 个电子,转化为气态基态正离子所需要的 叫做第一电离能。第一电离能越大,金属活动性越 。同一元素的第二电离能 第一电离能。
气
中
一
最低能量
弱
大于
2、如何理解第二电离能I2、第三电离能I3 、I4、I5…… ?
从一价气态基态正离子中再失去一个电子所需
消耗的能量叫做第二电离能(用I2表示),依次
类推,可得到I3、I4、I5……同一种元素的逐
级电离能的大小关系:I1
为随着电子的逐个失去,阳离子所带的正电荷
数越来越大,再要失去一个电子需克服的电性
引力也越来越大,消耗的能量也越来越多。
分析下表:
〖科学探究〗
⑴、原子的第一电离能有什么变化规律呢?
第一电离能
周一周期
同一族
从左往右,第一电离能呈增大的趋势
从上到下,第一电离能呈减小趋势。
⑵、碱金属元素的第一电离能有什么变化规律呢?碱金属的电离能与金属活泼性有什么关系为什么?
碱金属元素从上到下,第一电离能变小.第一电离能越小,越易失电子,金属的活泼性就越强。因此碱金属元素的第一电离能越小,金属的活泼性就越强。
⑶、Be的第一电离能大于B,N的第一电离能大于O,Mg的第一电离能大于Al,Zn的第一电离能大于Ga?
Be有价电子排布为2s2,是全充满结构,比较稳定,而B的价电子排布为2s22p1,、比Be不稳定,因此失去第一个电子B比Be容易,第一电离能小
⑸、阅读分析表格数据:
Na Mg Al
各级电离能(KJ/mol) 496 738 578
4562 1415 1817
6912 7733 2745
9543 10540 11575
13353 13630 14830
16610 17995 18376
20114 21703 23293
为什么原子的逐级电离能越来越大?这些数据与钠、镁、铝的化合价有什么关系?数据的突跃变化说明了什么?
Na的I1,比I2小很多,电离能差值很大,说明失去第一个电子比失去第二电子容易得多,所以Na容易失去一个电子形成+1价离子;Mg的I1和I2相差不多,而I2比I3小很多,所以Mg容易失去两个电子形成十2价离子;Al的I1、I2、I3相差不多,而I3比I4小很多,所以A1容易失去三个电子形成+3价离子。而电离能的突跃变化,说明核外电子是分能层排布的。
(5)电负性:
〖思考与交流〗
1、什么是电负性?电负性的大小体现了 什么性质?阅读教材p20页表
电负性是用来描述不同元素的原子对键
合电子吸引力的大小
电负性的大小体现了元素的金属性与非金属性的强弱,电负性越大元素的非金属性越强,电负性越小元素的金属性越强.
2、同周期元素、同主族元素电负性如何变化规律?如何理解这些规律?根据电负性大小,判断氧的非金属性与氯的非金属性哪个强?
同周期元素从左往右,电负性逐渐增大,同主族元素从上往下,电负性逐渐减小。
非金属性:氧大于氯
同周期元素从左往右,非金属性增强;同主族元素从上往下,金属性增强
3、电负性的应用:
①判断元素的金属性和非金属性的强弱
一般:非金属>1.8 金属<1.8 类金属≈1.8
②判断化学键的类型
一般:成键元素原子的电负性差>1.7,离子键
成键元素原子的电负性差<1.7,共价键
例:H:2.1,Cl:3.0 3.0-2.1=0.9
HCl为共价化合物
③判断化合物中元素化合价的正负
例:NaH中,Na:0.9 H:2.1
Na显正价,H显负价
