人教化学选修3第二章第二节分子的立体构型(共21张PPT)
文档属性
| 名称 | 人教化学选修3第二章第二节分子的立体构型(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-11 14:46:47 | ||
图片预览



文档简介
(共21张PPT)
第二章 分子结构与性质
第二节分子的立体构型
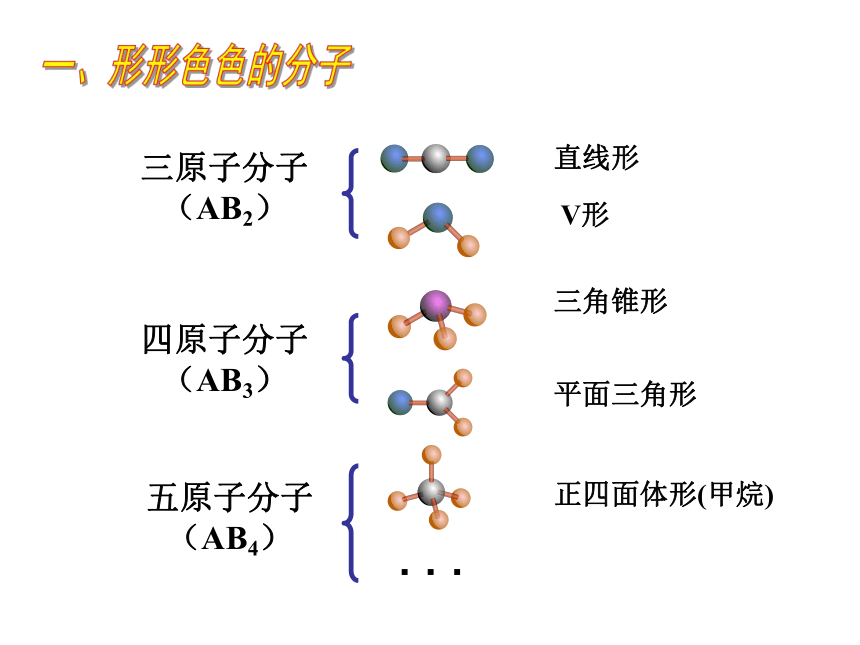
三原子分子
(AB2)
四原子分子
(AB3)
五原子分子
(AB4)
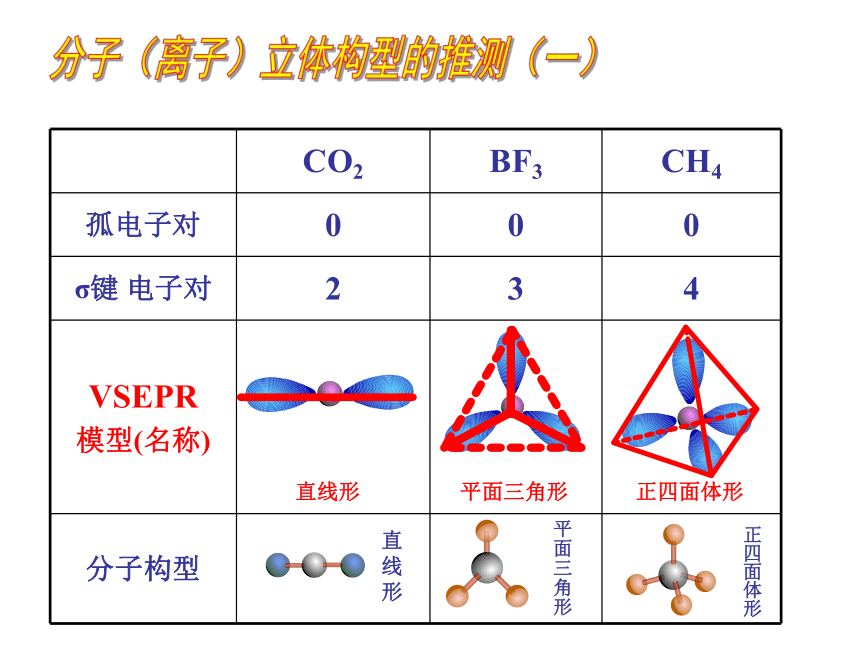
直线形
平面三角形
正四面体形
理论要点:分子的立体构型是“价层电子对”互相排斥的结果。
ABn型分子
中心原子
电子对
未成键电子对(孤电子对)
成键电子对
σ键 电子对
∏键 电子对
————√
——————————√
ABn型分子
中心原子
价层电子对
σ键 电子对数量=与中心原子成键原子数
(例如ABn型分子等于“n”)。
孤电子对数量=1/2(a-xb)
对于主族元素来说:
a — 中心原子价电子数=原子最外层电子数
x — 与中心原子成键原子数(ABn型分子等于“n”)
b — 与中心原子成键的原子最多接受的电子数
4
5
2
2
0
4
1
0
-1
=4
NH4+
孤电子对数量=1/2(a-xb),对于主族元素来说:
a — 中心原子价电子数=原子最外层电子数=所在主
族序数
x — 与中心原子成键原子数(ABn型分子等于“n”)
b — 与中心原子成键的原子最多接受的电子数(H为1,
其它原子等于“8-该原子价电子数”)
a x b 孤电子对数
CO2
直
线
形
平
面
三
角
形
正四面体形
直线形
平面三角形
正
四
面
体
形
CO2 BF3 CH4
孤电子对 0 0 0
σ键 电子对 2 3 4
VSEPR
模型(名称)
分子构型
V形
三角
锥形
四
面
体
形
平
面
三
角
形
SO2 SO32-
孤电子对 1 1
σ键
电子对 2 3
VSEPR
模型
(名称)
分子构型
四
面
体
形
V形
2
2
2
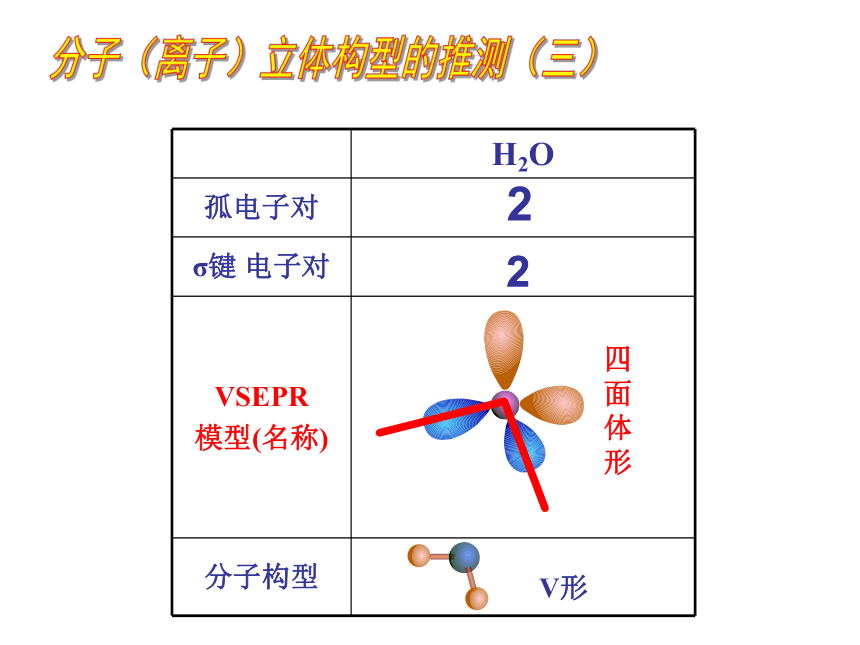
H2O
孤电子对
σ键 电子对
VSEPR
模型(名称)
分子构型
CO2 SO2 H2O
孤电子对 0 1 2
σ键电子对 2 2 2
VSEPR
模型(名称) 直线形 平面三角形 四面体形
分子构型 直线形 V形
2
3
4
0
2
2
0
0
0
1
4
3
V形
三角锥形
四面体形
平面三角形
四面体形
直线形
孤电子对 σ键
电子对 VSEPR
模型 分子(离子)的
立体构型
CS2
H2S
NH3
CCl4
NH4+
CO32-
如:CH4按价键理论
形成四个C-H 键不完全相同, 与实际不符
实际测定→
正四面体形
一、杂化轨道理论的基本要点
杂化:原子成键时, 参与成键的若干个能级相近的原子轨道相互“混杂”, 组成一组新轨道(杂化轨道)
三、杂化轨道理论简介
C原子基态原子电子排布的轨道表示式
sp3杂化轨道
2.杂化前后轨道数目和总能量不变。
3.杂化轨道电子云分布更为集中,使成键能力增强。
1.成键时,同一原子能级相近,类型不同的轨道可重新组合形成新的杂化轨道。
C原子基态电子排布轨道表示式
sp2杂化轨道
两个C原子发生sp2杂化, 各留有一个p电子未参与杂化。
乙烯(H2C=CH2):
两个C原子的P电子垂直
与 sp2 三角形平面, 肩并肩重叠形成 ? 键.
每个C原子的三个 sp2 杂化轨道, 一个与另一C原子,两个与H原子形成?键.
2.sp2杂化 例 BCl3
sp2杂化——1个s 轨道+2个p 轨道
平面三角形
2p
C原子基态原子电子排布的轨道表示式
sp杂化轨道
每个C原子的两个 sp 杂化轨道, 一个与另一C原子,另一个与H原子形成?键.
两个C原子的剩余两个P电子均垂直于 ?键, 肩并肩重叠形成两个? 键.
乙炔 (HC≡CH):两个C原子发生sp杂化,每个C原子各留有两个未参与杂化的相互垂直的p电子。
由s轨道和p轨道形成的杂化轨道和分子的空间构型列于下表中。
杂化轨道
构型 线形 三角形 四面体形
杂化轨道类型 sp sp2 sp3 sp3
孤电子对数 0 0 0 1 2
参加杂化的轨道 1个s、1个p 1个s、2个p 1个s、3个p 1个s、3个p
生成杂化轨道数 2 3 4 4
成健轨道夹角 180° 120° 109°28′ 90° ~ 109°28′
空间构型 直线型 平面三角形 正四面体 三角锥 V形
实 例 BeCl2 BF3 CH4 NH3 H2O
第二章 分子结构与性质
第二节分子的立体构型
三原子分子
(AB2)
四原子分子
(AB3)
五原子分子
(AB4)
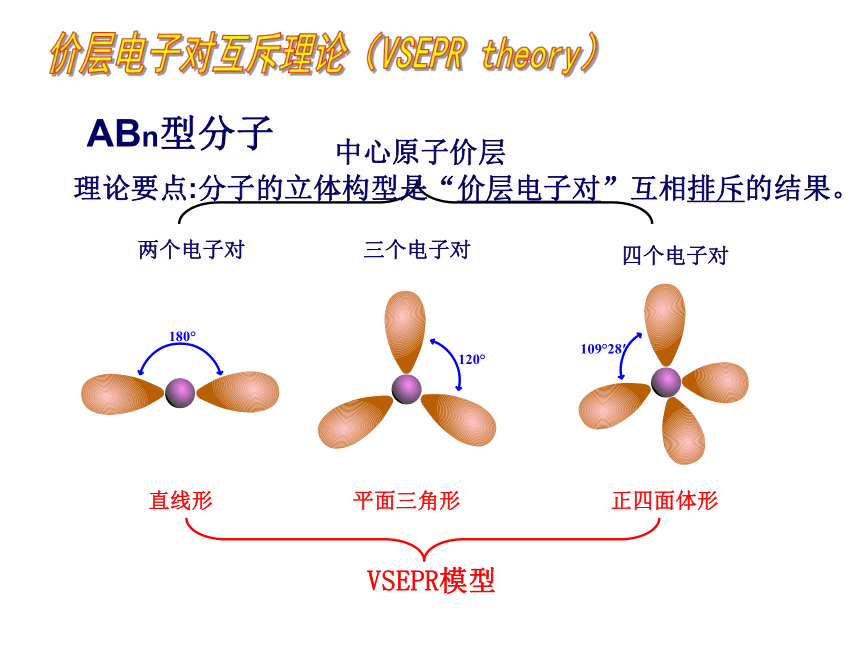
直线形
平面三角形
正四面体形
理论要点:分子的立体构型是“价层电子对”互相排斥的结果。
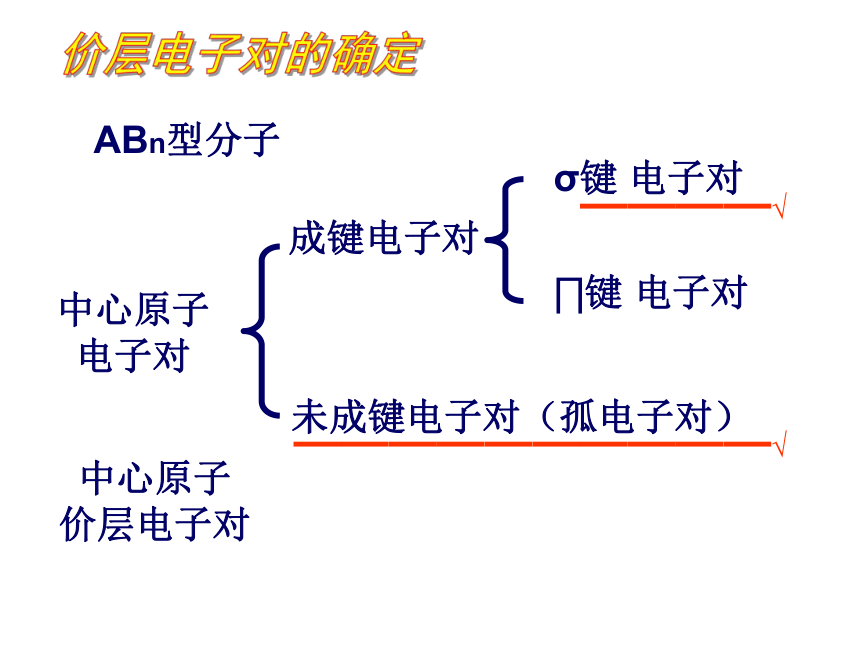
ABn型分子
中心原子
电子对
未成键电子对(孤电子对)
成键电子对
σ键 电子对
∏键 电子对
————√
——————————√
ABn型分子
中心原子
价层电子对
σ键 电子对数量=与中心原子成键原子数
(例如ABn型分子等于“n”)。
孤电子对数量=1/2(a-xb)
对于主族元素来说:
a — 中心原子价电子数=原子最外层电子数
x — 与中心原子成键原子数(ABn型分子等于“n”)
b — 与中心原子成键的原子最多接受的电子数
4
5
2
2
0
4
1
0
-1
=4
NH4+
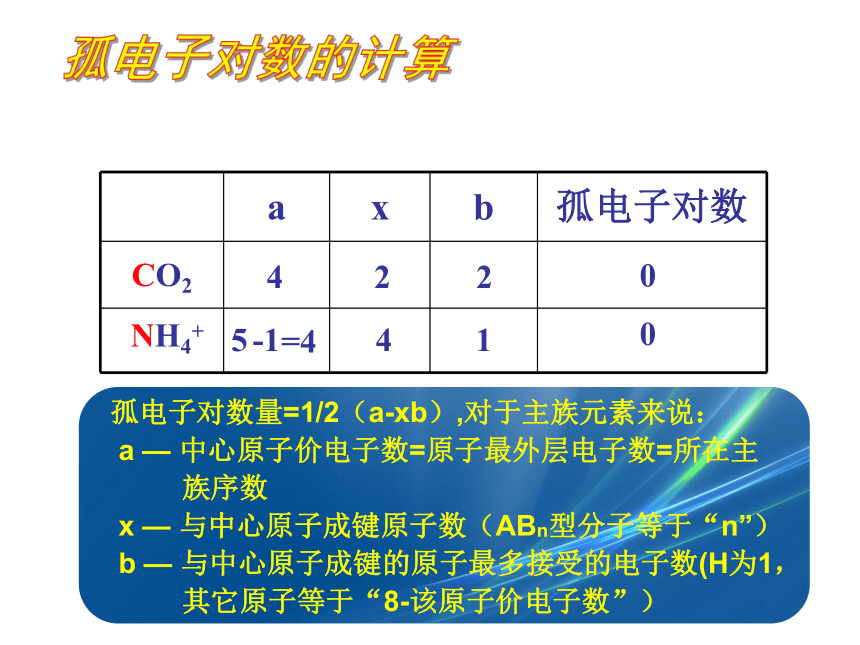
孤电子对数量=1/2(a-xb),对于主族元素来说:
a — 中心原子价电子数=原子最外层电子数=所在主
族序数
x — 与中心原子成键原子数(ABn型分子等于“n”)
b — 与中心原子成键的原子最多接受的电子数(H为1,
其它原子等于“8-该原子价电子数”)
a x b 孤电子对数
CO2
直
线
形
平
面
三
角
形
正四面体形
直线形
平面三角形
正
四
面
体
形
CO2 BF3 CH4
孤电子对 0 0 0
σ键 电子对 2 3 4
VSEPR
模型(名称)
分子构型
V形
三角
锥形
四
面
体
形
平
面
三
角
形
SO2 SO32-
孤电子对 1 1
σ键
电子对 2 3
VSEPR
模型
(名称)
分子构型
四
面
体
形
V形
2
2
2
H2O
孤电子对
σ键 电子对
VSEPR
模型(名称)
分子构型
CO2 SO2 H2O
孤电子对 0 1 2
σ键电子对 2 2 2
VSEPR
模型(名称) 直线形 平面三角形 四面体形
分子构型 直线形 V形
2
3
4
0
2
2
0
0
0
1
4
3
V形
三角锥形
四面体形
平面三角形
四面体形
直线形
孤电子对 σ键
电子对 VSEPR
模型 分子(离子)的
立体构型
CS2
H2S
NH3
CCl4
NH4+
CO32-
如:CH4按价键理论
形成四个C-H 键不完全相同, 与实际不符
实际测定→
正四面体形
一、杂化轨道理论的基本要点
杂化:原子成键时, 参与成键的若干个能级相近的原子轨道相互“混杂”, 组成一组新轨道(杂化轨道)
三、杂化轨道理论简介
C原子基态原子电子排布的轨道表示式
sp3杂化轨道
2.杂化前后轨道数目和总能量不变。
3.杂化轨道电子云分布更为集中,使成键能力增强。
1.成键时,同一原子能级相近,类型不同的轨道可重新组合形成新的杂化轨道。
C原子基态电子排布轨道表示式
sp2杂化轨道
两个C原子发生sp2杂化, 各留有一个p电子未参与杂化。
乙烯(H2C=CH2):
两个C原子的P电子垂直
与 sp2 三角形平面, 肩并肩重叠形成 ? 键.
每个C原子的三个 sp2 杂化轨道, 一个与另一C原子,两个与H原子形成?键.
2.sp2杂化 例 BCl3
sp2杂化——1个s 轨道+2个p 轨道
平面三角形
2p
C原子基态原子电子排布的轨道表示式
sp杂化轨道
每个C原子的两个 sp 杂化轨道, 一个与另一C原子,另一个与H原子形成?键.
两个C原子的剩余两个P电子均垂直于 ?键, 肩并肩重叠形成两个? 键.
乙炔 (HC≡CH):两个C原子发生sp杂化,每个C原子各留有两个未参与杂化的相互垂直的p电子。
由s轨道和p轨道形成的杂化轨道和分子的空间构型列于下表中。
杂化轨道
构型 线形 三角形 四面体形
杂化轨道类型 sp sp2 sp3 sp3
孤电子对数 0 0 0 1 2
参加杂化的轨道 1个s、1个p 1个s、2个p 1个s、3个p 1个s、3个p
生成杂化轨道数 2 3 4 4
成健轨道夹角 180° 120° 109°28′ 90° ~ 109°28′
空间构型 直线型 平面三角形 正四面体 三角锥 V形
实 例 BeCl2 BF3 CH4 NH3 H2O
