人教化学选修3第二章分子结构与性质 复习(共18张PPT)
文档属性
| 名称 | 人教化学选修3第二章分子结构与性质 复习(共18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 158.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-11 00:00:00 | ||
图片预览





文档简介
(共18张PPT)
分子结构与性质
归纳总结
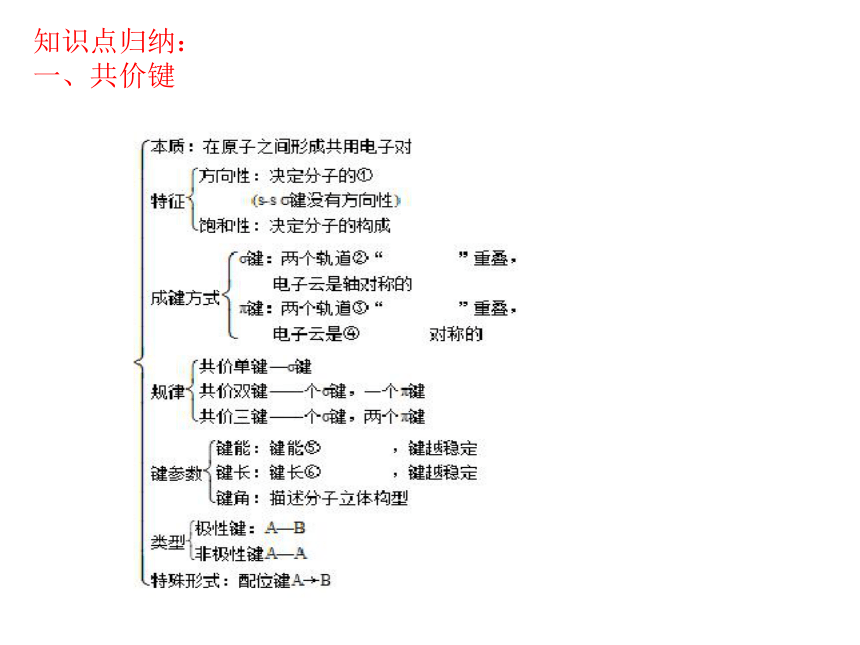
知识点归纳:
一、共价键
二、分子的立体构型
三、分子的性质
四、 分子的立体构型及判断方法
1.用价层电子对互斥理论判断
价层电子对互斥模型说明价层电子对的排斥作用对分子立体构型的影响,而分子的立体构型指的是成键电子对的空间构型,不包括孤电子对。
(1)当中心原子无孤电子对时,分子的立体构型与VSEPR模型一致。
(2)当中心原子有孤电子对时,分子的立体构型与VSEPR模型不一致。
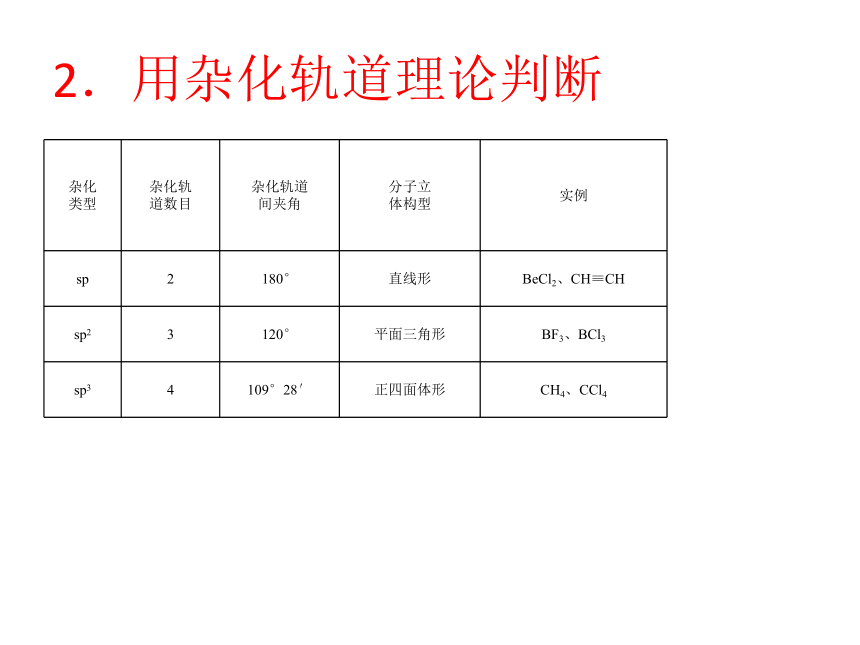
2.用杂化轨道理论判断
杂化
类型 杂化轨
道数目 杂化轨道
间夹角 分子立
体构型 实例
sp 2 180° 直线形 BeCl2、CH≡CH
sp2 3 120° 平面三角形 BF3、BCl3
sp3 4 109°28′ 正四面体形 CH4、CCl4
3.用键角判断,分子的立体构型和键角的关系如下表所示
分子
类型 分子的
立体构型 键角 键的
极性 分子极性 实例
A2 直线形
(对称) — 非极
性键 非极性 H2、O2、N2等
AB 直线形
(非对称) — 极性键 极性 HX、CO、NO等
ABA 直线形
(对称) 180° 极性键 非极性 CO2、CS2等
V形
(不对称) — 极性键 极性 H2O、H2S等
AB3 平面三角形
(对称) 120° 极性键 非极性 BF3、SO3等
三角锥形
(不对称) — 极性键 极性 NH3、PCl3等
AB4 正四面体形
(对称) 109°28′ 极性键 非极性 CH4、CCl4等
4.根据等电子原理判断
通常情况下,等电子体的立体构型相同,如SO2与O3均为V形,CH4与NH均为正四面体形。常见的等电子体及立体构型如下表所示:
类型 实例 立体构型
2原子10电子 CO、N2、CN-、NO+、C 直线形
3原子16电子 CO2、CS2、N2O、BeCl2、COS、OCN-、SCN-、N、NO 直线形
3原子18电子 SO2、O3、NO V形
4原子24电子 NO、CO、BO、CS、BF3、SO3 平面三角形
4原子26电子 ClO、BrO、SO 三角锥形
5原子8电子 CH4、SiH4 正四面体形
5原子32电子 SiF4、CCl4、SiCl4、SiO、SO、PO、AsO、S2O、BF 正四面体形
五、分子的性质
1.范德华力对物质性质的影响
(1)对物质熔、沸点的影响
一般来说,组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点通常越高。如熔、沸点:I2>Br2>Cl2>F2,Rn>Xe>Kr>Ar>Ne>He。
(2)相似相溶规律
极性分子易溶于极性溶剂中(如HCl易溶于水中),非极性分子易溶于非极性溶剂中(如I2易溶于CCl4中,白磷易溶于CS2中)。
2.氢键对物质性质的影响
(1)对物质熔、沸点的影响
①某些氢化物分子存在氢键,如H2O、NH3、HF等,会比同族氢化物沸点反常的高,如H2O>H2S。
②氢键存在于分子内对物质性质的影响与分子间氢键对物质性质的影响不同。邻羟基苯甲醛存在分子内氢键、对羟基苯甲醛存在分子间氢键,对羟基苯甲醛的熔点、沸点分别比邻羟基苯甲醛的熔点、沸点高。
(2)对物质密度的影响
氢键的存在,会使物质的密度出现反常,如液态水变为冰,密度会变小。
(3)对物质溶解度的影响
溶剂和溶质之间存在氢键,溶解性好,溶质分子不能与水分子形成氢键,在水中溶解度就比较小。如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为它们与水形成了分子间氢键的原因。
(4)氢键对物质结构的影响
氢键的存在使一些物质具有一些特殊结构,如冰晶体的孔穴结构等。
3.分子的手性
(1)手性碳原子:连接四个不同的原子或基团的碳原子称为手性碳原子。
(2)手性异构体:如果一对分子,它们的组成和原子的排列方式完全相同,如同左手和右手一样互为镜像,在三维空间不能重叠,这对分子互称为手性异构体。
(3)手性分子:存在手性异构体的分子称为手性分子。
4.无机含氧酸分子的酸性
(1)对于同种元素的含氧酸,该元素的化合价越高,其含氧酸的酸性越强。如:HClO (2)无机含氧酸[(HO)mROn]中n值越大,酸性越强。
典例1 有A、B、C、D四种元素,A元素是所有元素中原子半径最小的元素;B、C两种元素原子的核外电子层数相同,C元素的单质为深红棕色液体,B元素的最高价阳离子0.5 mol被还原成中性原子时,需得到6.02×1023个电子。当B元素的单质同盐酸充分反应时,放出0.02 g H2,用去B元素0.4 g;D元素的气态氢化物和最高价氧化物的水化物之间反应生成盐。
(1)各元素的名称分别为:A__氢____,B__钙____,C__溴____,D__氮____。
(2)用电子式表示A与C、B与C形成化合物的过程__ ____、__ ____,化学键类型分别为__共价键____、__离子键____。
(3)四种元素形成常见化合物中具有离子键、极性键、配位键的物质是__NH4Br____,电子式为__ ____。
典例2 用价层电子对互斥理论推测下列分子或离子的空间构型。
(1)BeCl2 __直线形____;
(2)HCN __直线形____;
(3)NH __正四面体____;
(4)H3O+ __三角锥形____;
(5)H2O __V形____;
(6)NH3 __三角锥形____。
典例3 (1)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也属于非极性分子,但既有非极性键,又有极性键;C的分子属于极性分子。则A的电子式是__︰N??N︰____;B的结构式是__H—C≡C—H____;C的名称是__一氧化碳____。
(2)1,2-二氯乙烯存在两种同分异构体, 其中属于极性分子的结构式是__A____(填字母编号,下同),属于非极性分子的结构式是__B____。
练习:硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S S8 FeS2 SO2 SO3 H2SO4
熔点/℃ -85.5 115.2 >600
(分解) -75.5 16.8 10.3
沸点/℃ -60.3 444.6 -10.0 45.0 337.0
回答下列问题:
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的__H2S____。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__S8相对分子质量大,分子间范德华力强____。
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为__平面三角____形,其中共价键的类型有__2____种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__sp3____。
分子结构与性质
归纳总结
知识点归纳:
一、共价键
二、分子的立体构型
三、分子的性质
四、 分子的立体构型及判断方法
1.用价层电子对互斥理论判断
价层电子对互斥模型说明价层电子对的排斥作用对分子立体构型的影响,而分子的立体构型指的是成键电子对的空间构型,不包括孤电子对。
(1)当中心原子无孤电子对时,分子的立体构型与VSEPR模型一致。
(2)当中心原子有孤电子对时,分子的立体构型与VSEPR模型不一致。
2.用杂化轨道理论判断
杂化
类型 杂化轨
道数目 杂化轨道
间夹角 分子立
体构型 实例
sp 2 180° 直线形 BeCl2、CH≡CH
sp2 3 120° 平面三角形 BF3、BCl3
sp3 4 109°28′ 正四面体形 CH4、CCl4
3.用键角判断,分子的立体构型和键角的关系如下表所示
分子
类型 分子的
立体构型 键角 键的
极性 分子极性 实例
A2 直线形
(对称) — 非极
性键 非极性 H2、O2、N2等
AB 直线形
(非对称) — 极性键 极性 HX、CO、NO等
ABA 直线形
(对称) 180° 极性键 非极性 CO2、CS2等
V形
(不对称) — 极性键 极性 H2O、H2S等
AB3 平面三角形
(对称) 120° 极性键 非极性 BF3、SO3等
三角锥形
(不对称) — 极性键 极性 NH3、PCl3等
AB4 正四面体形
(对称) 109°28′ 极性键 非极性 CH4、CCl4等
4.根据等电子原理判断
通常情况下,等电子体的立体构型相同,如SO2与O3均为V形,CH4与NH均为正四面体形。常见的等电子体及立体构型如下表所示:
类型 实例 立体构型
2原子10电子 CO、N2、CN-、NO+、C 直线形
3原子16电子 CO2、CS2、N2O、BeCl2、COS、OCN-、SCN-、N、NO 直线形
3原子18电子 SO2、O3、NO V形
4原子24电子 NO、CO、BO、CS、BF3、SO3 平面三角形
4原子26电子 ClO、BrO、SO 三角锥形
5原子8电子 CH4、SiH4 正四面体形
5原子32电子 SiF4、CCl4、SiCl4、SiO、SO、PO、AsO、S2O、BF 正四面体形
五、分子的性质
1.范德华力对物质性质的影响
(1)对物质熔、沸点的影响
一般来说,组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点通常越高。如熔、沸点:I2>Br2>Cl2>F2,Rn>Xe>Kr>Ar>Ne>He。
(2)相似相溶规律
极性分子易溶于极性溶剂中(如HCl易溶于水中),非极性分子易溶于非极性溶剂中(如I2易溶于CCl4中,白磷易溶于CS2中)。
2.氢键对物质性质的影响
(1)对物质熔、沸点的影响
①某些氢化物分子存在氢键,如H2O、NH3、HF等,会比同族氢化物沸点反常的高,如H2O>H2S。
②氢键存在于分子内对物质性质的影响与分子间氢键对物质性质的影响不同。邻羟基苯甲醛存在分子内氢键、对羟基苯甲醛存在分子间氢键,对羟基苯甲醛的熔点、沸点分别比邻羟基苯甲醛的熔点、沸点高。
(2)对物质密度的影响
氢键的存在,会使物质的密度出现反常,如液态水变为冰,密度会变小。
(3)对物质溶解度的影响
溶剂和溶质之间存在氢键,溶解性好,溶质分子不能与水分子形成氢键,在水中溶解度就比较小。如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为它们与水形成了分子间氢键的原因。
(4)氢键对物质结构的影响
氢键的存在使一些物质具有一些特殊结构,如冰晶体的孔穴结构等。
3.分子的手性
(1)手性碳原子:连接四个不同的原子或基团的碳原子称为手性碳原子。
(2)手性异构体:如果一对分子,它们的组成和原子的排列方式完全相同,如同左手和右手一样互为镜像,在三维空间不能重叠,这对分子互称为手性异构体。
(3)手性分子:存在手性异构体的分子称为手性分子。
4.无机含氧酸分子的酸性
(1)对于同种元素的含氧酸,该元素的化合价越高,其含氧酸的酸性越强。如:HClO
典例1 有A、B、C、D四种元素,A元素是所有元素中原子半径最小的元素;B、C两种元素原子的核外电子层数相同,C元素的单质为深红棕色液体,B元素的最高价阳离子0.5 mol被还原成中性原子时,需得到6.02×1023个电子。当B元素的单质同盐酸充分反应时,放出0.02 g H2,用去B元素0.4 g;D元素的气态氢化物和最高价氧化物的水化物之间反应生成盐。
(1)各元素的名称分别为:A__氢____,B__钙____,C__溴____,D__氮____。
(2)用电子式表示A与C、B与C形成化合物的过程__ ____、__ ____,化学键类型分别为__共价键____、__离子键____。
(3)四种元素形成常见化合物中具有离子键、极性键、配位键的物质是__NH4Br____,电子式为__ ____。
典例2 用价层电子对互斥理论推测下列分子或离子的空间构型。
(1)BeCl2 __直线形____;
(2)HCN __直线形____;
(3)NH __正四面体____;
(4)H3O+ __三角锥形____;
(5)H2O __V形____;
(6)NH3 __三角锥形____。
典例3 (1)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也属于非极性分子,但既有非极性键,又有极性键;C的分子属于极性分子。则A的电子式是__︰N??N︰____;B的结构式是__H—C≡C—H____;C的名称是__一氧化碳____。
(2)1,2-二氯乙烯存在两种同分异构体, 其中属于极性分子的结构式是__A____(填字母编号,下同),属于非极性分子的结构式是__B____。
练习:硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S S8 FeS2 SO2 SO3 H2SO4
熔点/℃ -85.5 115.2 >600
(分解) -75.5 16.8 10.3
沸点/℃ -60.3 444.6 -10.0 45.0 337.0
回答下列问题:
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的__H2S____。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__S8相对分子质量大,分子间范德华力强____。
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为__平面三角____形,其中共价键的类型有__2____种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__sp3____。
