人教化学选修3第二章第三节 分子的性质第1课时(共28张PPT)
文档属性
| 名称 | 人教化学选修3第二章第三节 分子的性质第1课时(共28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-11 15:09:21 | ||
图片预览








文档简介
(共28张PPT)
*
*
第二章 分子结构与性质
第三节 分子的性质
第2课时
选修3 物质结构与性质
*
*
我们知道:分子内部原子间存在相互作用——化学键,形成或破坏化学键都伴随着能量变化。
物质三相之间的转化也伴随着能量变化。这说明:分子间也存在着相互作用力。
范德华力及其对物质性质的影响
*
*
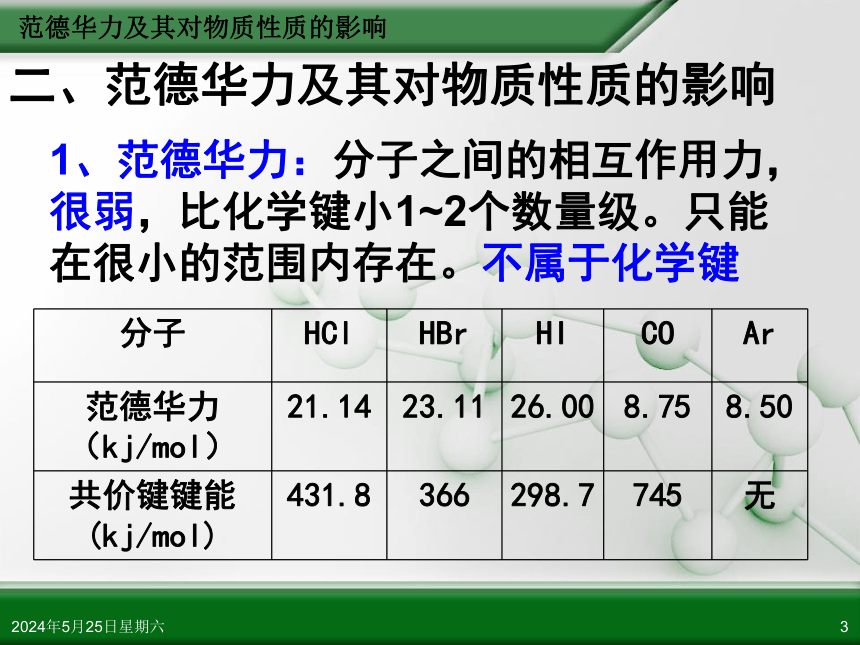
二、范德华力及其对物质性质的影响
1、范德华力:分子之间的相互作用力,很弱,比化学键小1~2个数量级。只能在很小的范围内存在。不属于化学键
范德华力及其对物质性质的影响
分子 HCl HBr HI CO Ar
范德华力(kj/mol) 21.14 23.11 26.00 8.75 8.50
共价键键能(kj/mol) 431.8 366 298.7 745 无
*
*
2、影响范德华力大小的因素
①结构相似的分子,相对分子质量
越大,范德华力越大。如卤素单质
②分子极性越强,范德华力越大
范德华力及其对物质性质的影响
*
*
化学键影响物质的化学性质(主)和物理性质
范德华力影响物质的物理性质(熔、沸点及溶解度等)
分子间范德华力越大,熔沸点越高
3、范德华力对物质性质的影响
范德华力及其对物质性质的影响
*
*
壁虎为什么能在天花板土爬行自如?这曾是一个困扰科学家一百多年的谜。用电子显微镜可观察到,壁虎的四足覆盖着几十万条纤细的由角蛋白构成的纳米级尺寸的毛。壁虎的足有多大吸力?实验证明,如果在一个分币的面积土布满100万条壁虎足的细毛,可以吊起20kg重的物体。近年来,有人用计算机模拟,证明壁虎的足与墙体之间的作用力在本质上是它的细毛与墙体之间的范德华力。
思考?夏天经常见到许多壁虎在墙壁或天花板上爬行,却掉不下来,为什么?
范德华力及其对物质性质的影响
*
*
将干冰气化,破坏了CO2分子晶体的—————
将CO2气体溶于水,破坏了CO2分子的————
分子间作用力
共价键
范德华力及其对物质性质的影响
*
*
思考:
解释CCl4(液体),CH4及CF4是气体,而CI4却是固体的原因。
它们均是正四面体结构,它们分子间范德华力随相对分子质量增大而增大,相对分子质量越大,范德华力越大。
范德华力大小: CI4> CCl4 >CF4 >CH4
范德华力及其对物质性质的影响
*
*
练习:
下列变化过程只是克服了范德华力的是( )
A、食盐的熔化 B、水的分解
C、碘单质的升华 D、金属钠的熔化
C
范德华力及其对物质性质的影响
*
*
氢键及其对物质性质的影响
*
*
1.定义:当氢原子与电负性大的X原子以共价键结合时,它们之间的共用电子对强烈地偏向X,使H几乎成为“裸露”的质子,这样相对显正电性的H与另一分子中相对显负电性的X(或Y)中的孤对电子接近并产生相互作用,这种相互作用称氢键。
三、氢键及其对物质性质的影响
氢键及其对物质性质的影响
*
*
2.表示:氢键可以用X—H…Y表示。X和Y可以是同种原子,也可以是不同种原子,但都是电负性较大、半径极小的非金属原子(一般就是N、O、F)。表示式中的实线表示共价键,虚线表示氢键。
3.氢键的键能一般小于40kJ/mol,强度介于化学键和分子间作用力之间.因此氢键不属于化学键,而属于分子间作用力的范畴。
氢键及其对物质性质的影响
*
*
邻羟基苯甲醛(熔点:-7℃)
对羟基苯甲醛
(熔点:115-117℃)
4.氢键的存在
(1)分子间氢键
(2)分子内氢键
氢键及其对物质性质的影响
*
*
5、氢键的特征
①饱和性
②方向性
一个氢原子只能形成一个氢键
分子间氢键为直线型
分子内氢键成一定角度
中心原子有几对孤对电子就可以形成几条氢键
氢键及其对物质性质的影响
*
*
6、氢键对物质性质的影响:
①对物质熔沸点的影响
分子间氢键使物质熔点升高
分子内氢键使物质熔点降低
氢键及其对物质性质的影响
*
*
讨论:醋酸、硝酸是相对分子质量相近的两种分子,但这两种物质的熔点和沸点相差比较大;醋酸的熔点为16.6℃,在温度低于16.6℃时即凝结成冰状的固体;常温下硝酸是一种具有挥发性的液体,熔点为-41.6 ℃.根据上述两种物质熔、沸点差异较大的事实,分析它们可能含有的氢键,画出示意图.
氢键及其对物质性质的影响
*
*
氢键及其对物质性质的影响
*
*
②对物质的溶解性的影响
思考:NH3为什么极易溶于水?NH3溶于
水是形成N-H…O还是形成O-H…N?
NH3溶于水形成氢键示意图如右,正是这样,NH3溶于水溶液呈碱性
氢键及其对物质性质的影响
*
*
讨论:我们在学习化学的过程中还有什么地方能用氢键的知识来解释的?
(1)水的特殊物理性质
(2)蛋白质结构中存在氢键
(3)核酸DNA中也存在氢键
(4)甲醇易溶于水
(5)乙醇与水互溶
…………
氢键及其对物质性质的影响
*
*
水的物理性质:
氢键及其对物质性质的影响
水的熔点(℃) 水的沸点(℃) 水在0 ℃时密度(g/ml) 水在4 ℃时密度(g/ml) 水在20 ℃时密度(g/ml) 水在100 ℃时密度(g/ml)
0.00
100.00
0.999841
1.000000
0.998203
0.958354
*
*
讨论水的特殊性:
(1)水的熔沸点比较高?
(2)为什么水结冰后体积膨胀?
(3)为什么水在4℃时密度最大?
氢键及其对物质性质的影响
*
*
液态水中的氢键
氢键及其对物质性质的影响
*
*
氢键及其对物质性质的影响
*
*
氢键及其对物质性质的影响
*
*
下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键
练习:
C
氢键及其对物质性质的影响
沸腾时只需克服范德华力的液体物质是 ( )
A.水 B.酒精 C.溴 D.水银
*
*
C
下列物质中分子间能形成氢键的是 ( )
A.N2 B.HBr C.NH3 D.H2S
*
*
C
*
*
谢谢您的指导!
*
*
第二章 分子结构与性质
第三节 分子的性质
第2课时
选修3 物质结构与性质
*
*
我们知道:分子内部原子间存在相互作用——化学键,形成或破坏化学键都伴随着能量变化。
物质三相之间的转化也伴随着能量变化。这说明:分子间也存在着相互作用力。
范德华力及其对物质性质的影响
*
*
二、范德华力及其对物质性质的影响
1、范德华力:分子之间的相互作用力,很弱,比化学键小1~2个数量级。只能在很小的范围内存在。不属于化学键
范德华力及其对物质性质的影响
分子 HCl HBr HI CO Ar
范德华力(kj/mol) 21.14 23.11 26.00 8.75 8.50
共价键键能(kj/mol) 431.8 366 298.7 745 无
*
*
2、影响范德华力大小的因素
①结构相似的分子,相对分子质量
越大,范德华力越大。如卤素单质
②分子极性越强,范德华力越大
范德华力及其对物质性质的影响
*
*
化学键影响物质的化学性质(主)和物理性质
范德华力影响物质的物理性质(熔、沸点及溶解度等)
分子间范德华力越大,熔沸点越高
3、范德华力对物质性质的影响
范德华力及其对物质性质的影响
*
*
壁虎为什么能在天花板土爬行自如?这曾是一个困扰科学家一百多年的谜。用电子显微镜可观察到,壁虎的四足覆盖着几十万条纤细的由角蛋白构成的纳米级尺寸的毛。壁虎的足有多大吸力?实验证明,如果在一个分币的面积土布满100万条壁虎足的细毛,可以吊起20kg重的物体。近年来,有人用计算机模拟,证明壁虎的足与墙体之间的作用力在本质上是它的细毛与墙体之间的范德华力。
思考?夏天经常见到许多壁虎在墙壁或天花板上爬行,却掉不下来,为什么?
范德华力及其对物质性质的影响
*
*
将干冰气化,破坏了CO2分子晶体的—————
将CO2气体溶于水,破坏了CO2分子的————
分子间作用力
共价键
范德华力及其对物质性质的影响
*
*
思考:
解释CCl4(液体),CH4及CF4是气体,而CI4却是固体的原因。
它们均是正四面体结构,它们分子间范德华力随相对分子质量增大而增大,相对分子质量越大,范德华力越大。
范德华力大小: CI4> CCl4 >CF4 >CH4
范德华力及其对物质性质的影响
*
*
练习:
下列变化过程只是克服了范德华力的是( )
A、食盐的熔化 B、水的分解
C、碘单质的升华 D、金属钠的熔化
C
范德华力及其对物质性质的影响
*
*
氢键及其对物质性质的影响
*
*
1.定义:当氢原子与电负性大的X原子以共价键结合时,它们之间的共用电子对强烈地偏向X,使H几乎成为“裸露”的质子,这样相对显正电性的H与另一分子中相对显负电性的X(或Y)中的孤对电子接近并产生相互作用,这种相互作用称氢键。
三、氢键及其对物质性质的影响
氢键及其对物质性质的影响
*
*
2.表示:氢键可以用X—H…Y表示。X和Y可以是同种原子,也可以是不同种原子,但都是电负性较大、半径极小的非金属原子(一般就是N、O、F)。表示式中的实线表示共价键,虚线表示氢键。
3.氢键的键能一般小于40kJ/mol,强度介于化学键和分子间作用力之间.因此氢键不属于化学键,而属于分子间作用力的范畴。
氢键及其对物质性质的影响
*
*
邻羟基苯甲醛(熔点:-7℃)
对羟基苯甲醛
(熔点:115-117℃)
4.氢键的存在
(1)分子间氢键
(2)分子内氢键
氢键及其对物质性质的影响
*
*
5、氢键的特征
①饱和性
②方向性
一个氢原子只能形成一个氢键
分子间氢键为直线型
分子内氢键成一定角度
中心原子有几对孤对电子就可以形成几条氢键
氢键及其对物质性质的影响
*
*
6、氢键对物质性质的影响:
①对物质熔沸点的影响
分子间氢键使物质熔点升高
分子内氢键使物质熔点降低
氢键及其对物质性质的影响
*
*
讨论:醋酸、硝酸是相对分子质量相近的两种分子,但这两种物质的熔点和沸点相差比较大;醋酸的熔点为16.6℃,在温度低于16.6℃时即凝结成冰状的固体;常温下硝酸是一种具有挥发性的液体,熔点为-41.6 ℃.根据上述两种物质熔、沸点差异较大的事实,分析它们可能含有的氢键,画出示意图.
氢键及其对物质性质的影响
*
*
氢键及其对物质性质的影响
*
*
②对物质的溶解性的影响
思考:NH3为什么极易溶于水?NH3溶于
水是形成N-H…O还是形成O-H…N?
NH3溶于水形成氢键示意图如右,正是这样,NH3溶于水溶液呈碱性
氢键及其对物质性质的影响
*
*
讨论:我们在学习化学的过程中还有什么地方能用氢键的知识来解释的?
(1)水的特殊物理性质
(2)蛋白质结构中存在氢键
(3)核酸DNA中也存在氢键
(4)甲醇易溶于水
(5)乙醇与水互溶
…………
氢键及其对物质性质的影响
*
*
水的物理性质:
氢键及其对物质性质的影响
水的熔点(℃) 水的沸点(℃) 水在0 ℃时密度(g/ml) 水在4 ℃时密度(g/ml) 水在20 ℃时密度(g/ml) 水在100 ℃时密度(g/ml)
0.00
100.00
0.999841
1.000000
0.998203
0.958354
*
*
讨论水的特殊性:
(1)水的熔沸点比较高?
(2)为什么水结冰后体积膨胀?
(3)为什么水在4℃时密度最大?
氢键及其对物质性质的影响
*
*
液态水中的氢键
氢键及其对物质性质的影响
*
*
氢键及其对物质性质的影响
*
*
氢键及其对物质性质的影响
*
*
下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键
练习:
C
氢键及其对物质性质的影响
沸腾时只需克服范德华力的液体物质是 ( )
A.水 B.酒精 C.溴 D.水银
*
*
C
下列物质中分子间能形成氢键的是 ( )
A.N2 B.HBr C.NH3 D.H2S
*
*
C
*
*
谢谢您的指导!
