人教版高二化学选修3第二章第二节分子的立体构型(共25张PPT)
文档属性
| 名称 | 人教版高二化学选修3第二章第二节分子的立体构型(共25张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-11 00:00:00 | ||
图片预览





文档简介
(共25张PPT)
1.了解分子空间结构的多样性和复杂性。
2.理解价层电子对互斥理论的含义。
3.能利用价层电子对互斥理论判断简单分子或离子的空间构型。
能利用价层电子对互斥理论判断简单分子或离子的空间构型
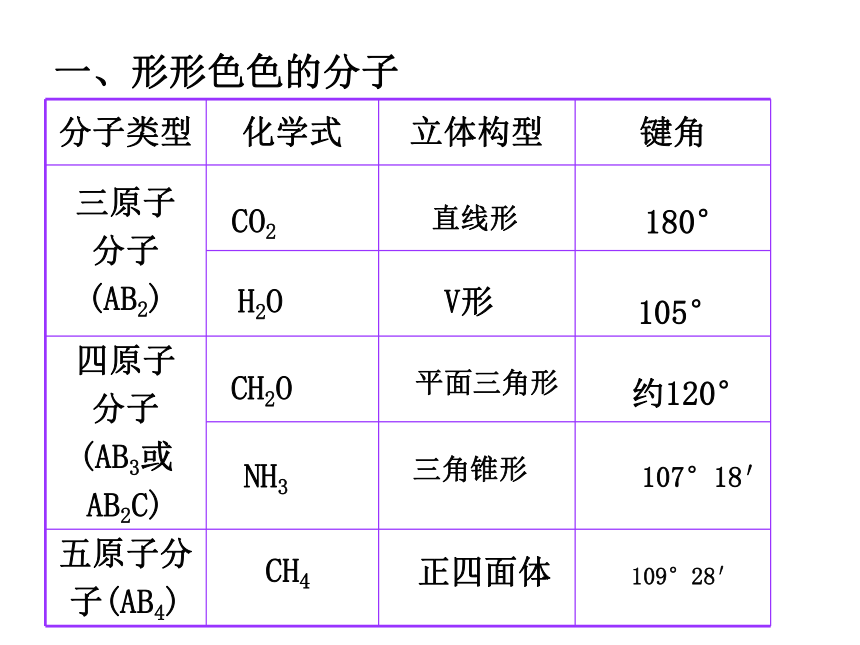
一、形形色色的分子
CO2
H2O
CH2O
NH3
CH4
分子类型 化学式 立体构型 键角
三原子
分子
(AB2)
四原子
分子
(AB3或
AB2C)
五原子分
子(AB4)
说明:分子的空间构型不仅局限于上面的几种情况它具有多样性和复杂性,在多原子分子中,分子的结构形形色色,异彩纷呈
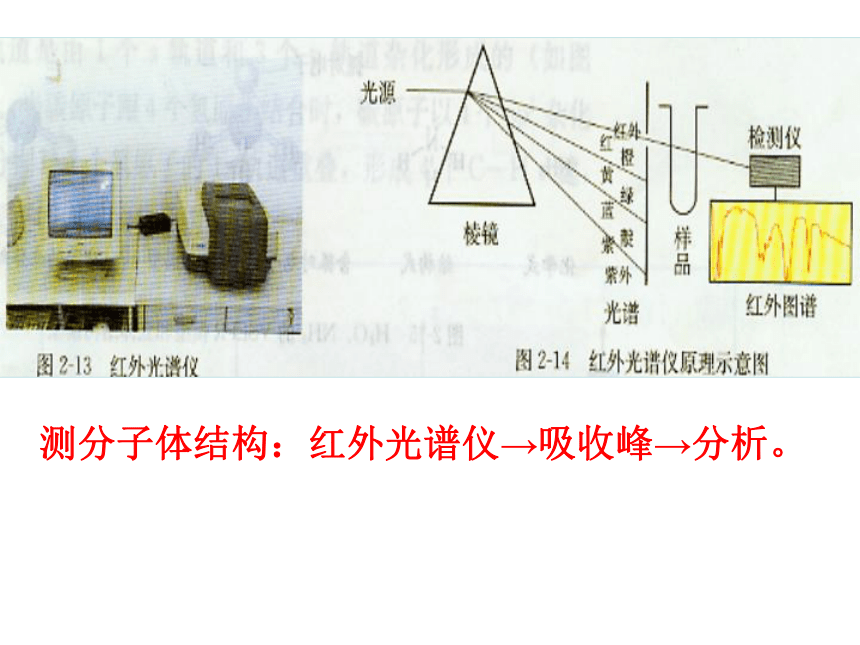
早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息,可分析出分子的立体结构。
科学视野 分子立体构型的测定
测分子体结构:红外光谱仪→吸收峰→分析。
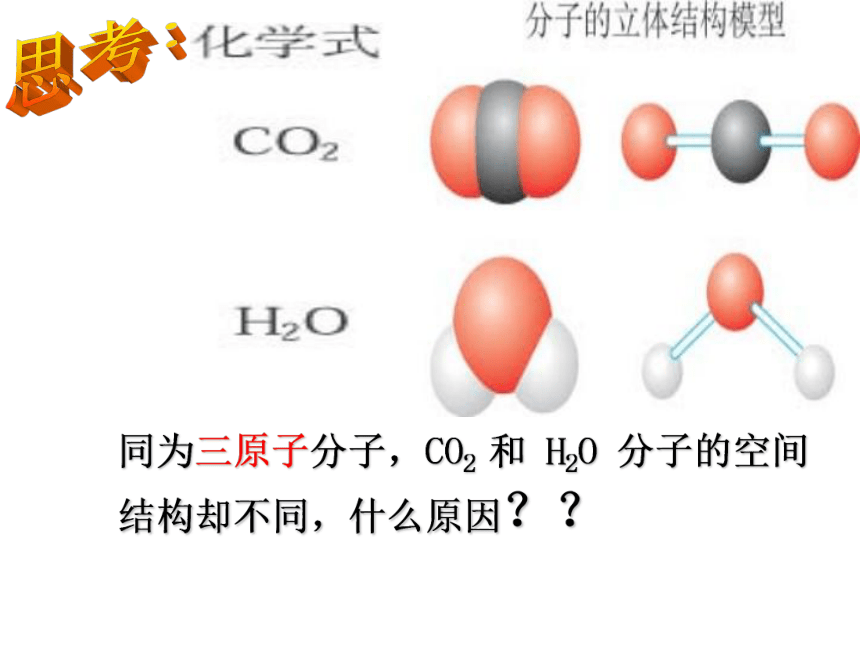
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因??
2.理论中心内容(VSEPR theory)
二、价层电子对互斥理论(VSEPR theory)
1.用途:用来预测分子( ABn )的立体构型
由于电子对间相互排斥作用,电子对间尽可能彼此远离以减小斥力,电子对之间的夹角越大,排斥力越小,分子尽可能采取对称的空间构型。
ABn 分子中心原子A上的价层电子对具体包括:σ键电子对和中心原子上的孤电子对;
例如:
2
直线形
180°
3
平面
三角形
120°
4
正四
面体
109°28′
A上价层电子对总数 电子对排布方式 VSEPR模型 键角
(1).中心原子A上价层电子对的确定
3.分子立体构型(ABn型)的确定方法
A上价层电子对 包括σ键和孤电子对
具体计算方法:
σ键数 ==== n
孤电子对 ==== 1/2(a-nb)
其中:① n为与中心原子结合的B原子数
②a为中心原子的价电子数(阴、阳离子还要分别加、减离子的电荷数)),b为与中心原子结合的原子最多能接受的电子数(氢为1,其他为“8-价电子数”)
A上价层电子对 ==== n + 1/2(a-nb)
示例 σ键数 孤电子对数
价层电子对数
CH4
NH3
H3O+
NH4+
CO32-
NO3-
当堂小练习
判断下列微粒的价层电子对数。
(1) CO2 SO2 BF3
(2)NO3- SO42- SCl2
(3)CCl4 H3O+ NH4+
(4)CO32- PCl3 SO3
(5)CH4 NH3 H2O
三角锥
?
正四面体
V形
示例 σ键数 孤电子对数
价层电子对数 VSEPR模型 真实构型
CH4 4 0 4 正四面体
NH3 3 1 4 正四面体
H2O 2 2 4 正四面体
孤电子对的出现和存在让分子构型出现了差异!!!
VSEPR模型和分子的立体构型,二者是相同的吗?
答:不是。(1)VSEPR模型指的是包括共价键和孤电子对在内的分子空间构型;分子的立体构型指的是组成分子的所有原子(只考虑分子内的共价键)所形成的分子空间构型。
(2)若分子中没有孤电子对,VSEPR模型和分子模型一致;若分子中有孤电子对,VSEPR模型和分子模型不一致。
CH4
CO2
分子立体结构
①对ABm型分子,若中心原子A的价层电子对只有σ键电子对,则价层电子对的在空间的相对位置就是分子的构型,即VSEPR模型和分子模型一致。
(2)判断出分子中心原子中有无孤电子对的存在,最终确定分子的空间构型
化学式 σ键数 孤电子对数 价层电子对数 VSEPR模型 分子的立体构型
CH4
NH4+
CO32-
V形
②中心原子A上有孤电子对的分子
若中心原子有孤电子对,孤电子对也要占据空间,并与σ键电子对相互排斥,则VSEPR模型和分子模型不一致。推测分子的最终立体构型必须略去孤电子对所占空间,余下的空间是分子真正的构型。
2
4
化学式 孤电子对数 价层电子对数 含孤电子对的VSEPR模型 分子的立体构型 分子的立体
构型名称
H2O
NH3
总结:对于ABn型分子空间构型确定的一般步骤:
确定中心原子A的价层电子对数
完成下列表格
当堂小练习
化学式 中心原子
孤对电子数 σ键数 空间构型
SO2
NH2-
BF3
SiCl4
NH4+
本节重点总结:
1.理解价层电子对互斥理论的含义。
2.掌握ABn型分子或离子中心原子数的计算方法,并能推测出分子的最终空间构型
本节作业:①练习册P15-16
②预习杂化轨道理论
1.了解分子空间结构的多样性和复杂性。
2.理解价层电子对互斥理论的含义。
3.能利用价层电子对互斥理论判断简单分子或离子的空间构型。
能利用价层电子对互斥理论判断简单分子或离子的空间构型
一、形形色色的分子
CO2
H2O
CH2O
NH3
CH4
分子类型 化学式 立体构型 键角
三原子
分子
(AB2)
四原子
分子
(AB3或
AB2C)
五原子分
子(AB4)
说明:分子的空间构型不仅局限于上面的几种情况它具有多样性和复杂性,在多原子分子中,分子的结构形形色色,异彩纷呈
早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息,可分析出分子的立体结构。
科学视野 分子立体构型的测定
测分子体结构:红外光谱仪→吸收峰→分析。
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因??
2.理论中心内容(VSEPR theory)
二、价层电子对互斥理论(VSEPR theory)
1.用途:用来预测分子( ABn )的立体构型
由于电子对间相互排斥作用,电子对间尽可能彼此远离以减小斥力,电子对之间的夹角越大,排斥力越小,分子尽可能采取对称的空间构型。
ABn 分子中心原子A上的价层电子对具体包括:σ键电子对和中心原子上的孤电子对;
例如:
2
直线形
180°
3
平面
三角形
120°
4
正四
面体
109°28′
A上价层电子对总数 电子对排布方式 VSEPR模型 键角
(1).中心原子A上价层电子对的确定
3.分子立体构型(ABn型)的确定方法
A上价层电子对 包括σ键和孤电子对
具体计算方法:
σ键数 ==== n
孤电子对 ==== 1/2(a-nb)
其中:① n为与中心原子结合的B原子数
②a为中心原子的价电子数(阴、阳离子还要分别加、减离子的电荷数)),b为与中心原子结合的原子最多能接受的电子数(氢为1,其他为“8-价电子数”)
A上价层电子对 ==== n + 1/2(a-nb)
示例 σ键数 孤电子对数
价层电子对数
CH4
NH3
H3O+
NH4+
CO32-
NO3-
当堂小练习
判断下列微粒的价层电子对数。
(1) CO2 SO2 BF3
(2)NO3- SO42- SCl2
(3)CCl4 H3O+ NH4+
(4)CO32- PCl3 SO3
(5)CH4 NH3 H2O
三角锥
?
正四面体
V形
示例 σ键数 孤电子对数
价层电子对数 VSEPR模型 真实构型
CH4 4 0 4 正四面体
NH3 3 1 4 正四面体
H2O 2 2 4 正四面体
孤电子对的出现和存在让分子构型出现了差异!!!
VSEPR模型和分子的立体构型,二者是相同的吗?
答:不是。(1)VSEPR模型指的是包括共价键和孤电子对在内的分子空间构型;分子的立体构型指的是组成分子的所有原子(只考虑分子内的共价键)所形成的分子空间构型。
(2)若分子中没有孤电子对,VSEPR模型和分子模型一致;若分子中有孤电子对,VSEPR模型和分子模型不一致。
CH4
CO2
分子立体结构
①对ABm型分子,若中心原子A的价层电子对只有σ键电子对,则价层电子对的在空间的相对位置就是分子的构型,即VSEPR模型和分子模型一致。
(2)判断出分子中心原子中有无孤电子对的存在,最终确定分子的空间构型
化学式 σ键数 孤电子对数 价层电子对数 VSEPR模型 分子的立体构型
CH4
NH4+
CO32-
V形
②中心原子A上有孤电子对的分子
若中心原子有孤电子对,孤电子对也要占据空间,并与σ键电子对相互排斥,则VSEPR模型和分子模型不一致。推测分子的最终立体构型必须略去孤电子对所占空间,余下的空间是分子真正的构型。
2
4
化学式 孤电子对数 价层电子对数 含孤电子对的VSEPR模型 分子的立体构型 分子的立体
构型名称
H2O
NH3
总结:对于ABn型分子空间构型确定的一般步骤:
确定中心原子A的价层电子对数
完成下列表格
当堂小练习
化学式 中心原子
孤对电子数 σ键数 空间构型
SO2
NH2-
BF3
SiCl4
NH4+
本节重点总结:
1.理解价层电子对互斥理论的含义。
2.掌握ABn型分子或离子中心原子数的计算方法,并能推测出分子的最终空间构型
本节作业:①练习册P15-16
②预习杂化轨道理论
