人教化学选修3第二章第二节分子的立体构型第2课时课件 (共20张PPT)
文档属性
| 名称 | 人教化学选修3第二章第二节分子的立体构型第2课时课件 (共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-12 00:00:00 | ||
图片预览



文档简介
(共20张PPT)
第二节 分子的立体结构
(第二课时)
思考:
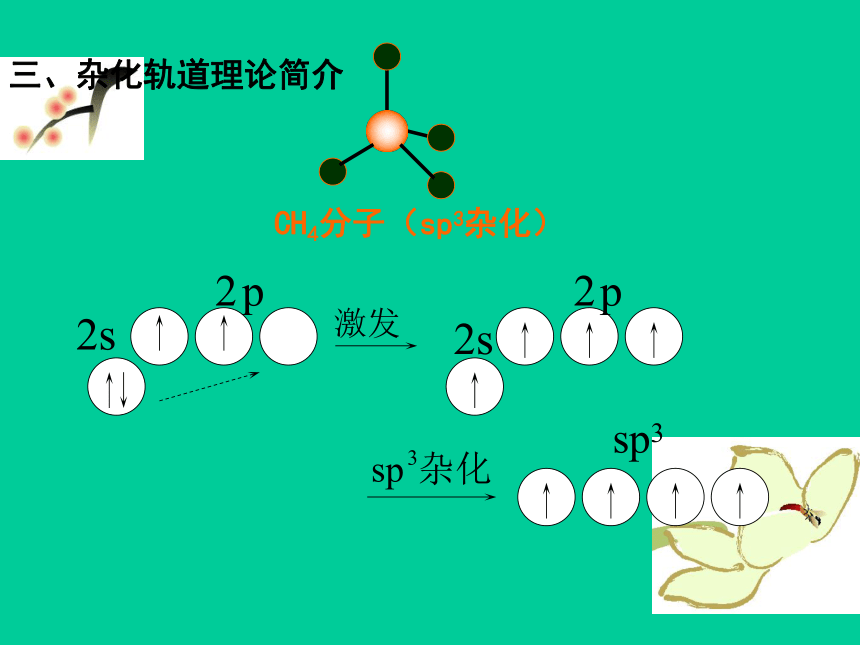
价层电子对互斥模型只能解释化合物分子的空间构形,却无法解释许多深层次的问题,如无法解释甲烷中四个C-H的键长、键能相同及H-C-H的键角为109?28′。因为按照我们已经学过的价键理论,甲烷的4个C-H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到四面体构型的甲烷分子。
这是为什么呢?
三、杂化理论:
1.在形成分子时,每一原子中能量相近的“轨道”会发生重组,形成新的原子轨道,这个过程称“杂化”,新的原子轨道称“杂化轨道”。
2.杂化前后原子“轨道”总数不变,但能量趋于平均化,“杂化轨道”的对称性更高,杂化后轨道伸展方向,形状发生改变,更有利于成键。
3.原子可用“杂化轨道”与其它原子的轨道(或“杂化轨道”)重叠形成共价键。
为了补充了价键理论的不足,鲍林(Pauling)在价键理论基础上提出了“杂化”假设。
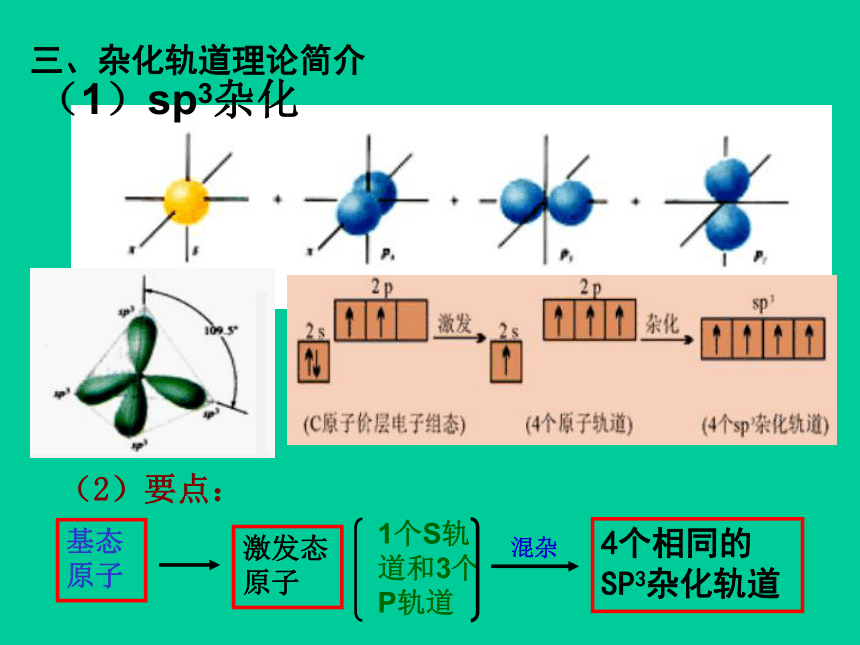
三、杂化轨道理论简介
(2)要点:
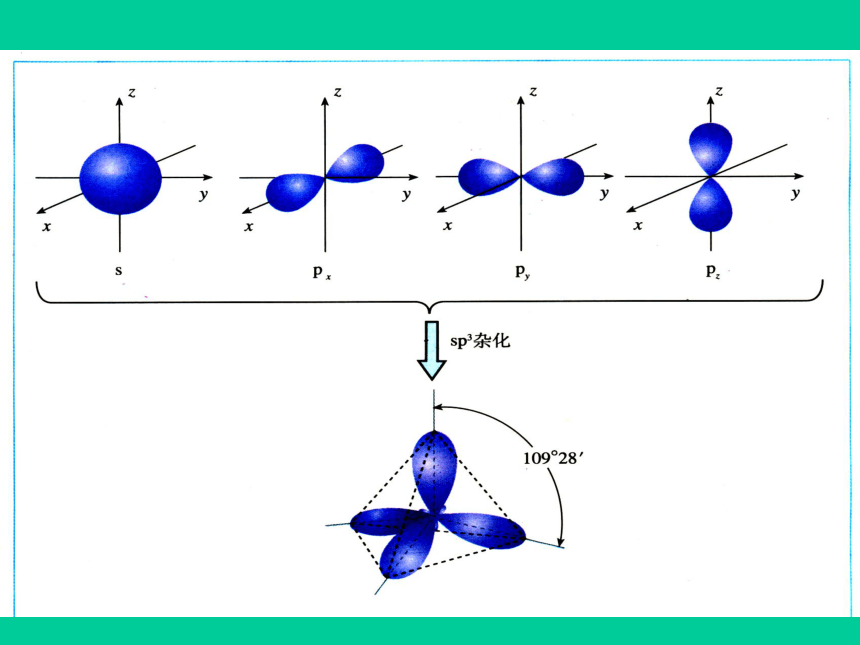
(1)sp3杂化
1个S轨道和3个P轨道
基态原子
激发态原子
4个相同的SP3杂化轨道
混杂
三、杂化轨道理论简介
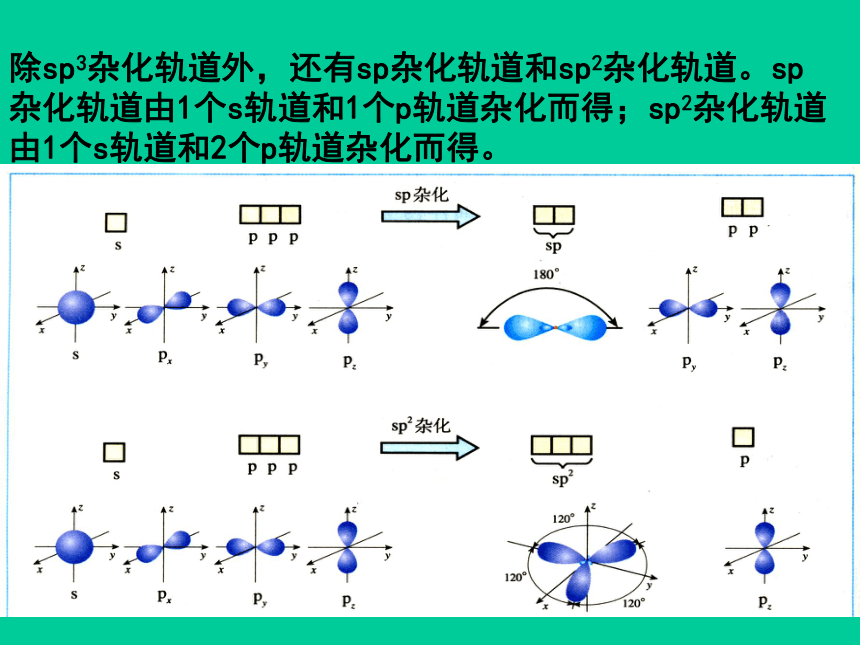
除sp3杂化轨道外,还有sp杂化轨道和sp2杂化轨道。sp杂化轨道由1个s轨道和1个p轨道杂化而得;sp2杂化轨道由1个s轨道和2个p轨道杂化而得。
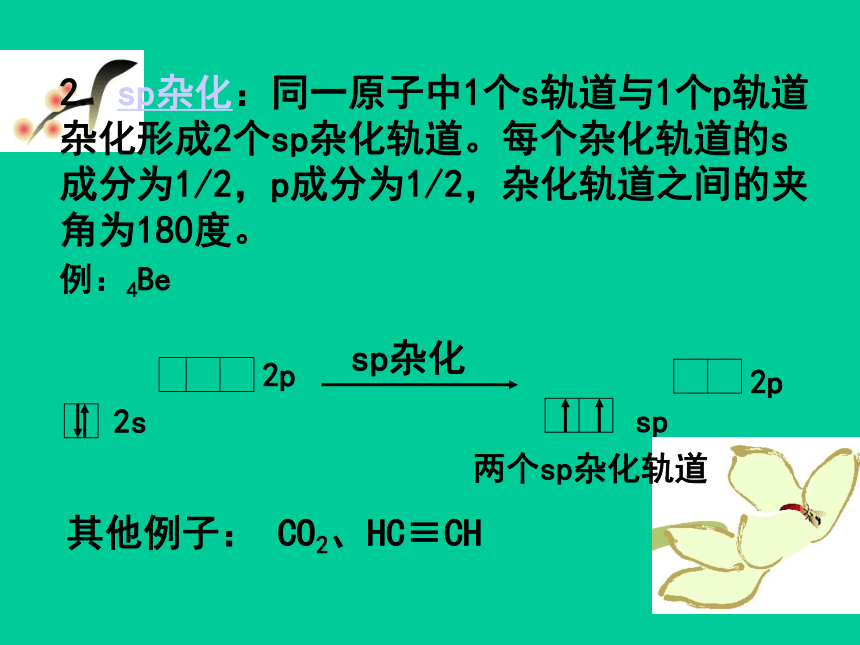
2. sp杂化:同一原子中1个s轨道与1个p轨道杂化形成2个sp杂化轨道。每个杂化轨道的s成分为1/2,p成分为1/2,杂化轨道之间的夹角为180度。
例:4Be
sp杂化
两个sp杂化轨道
其他例子: CO2、HC≡CH
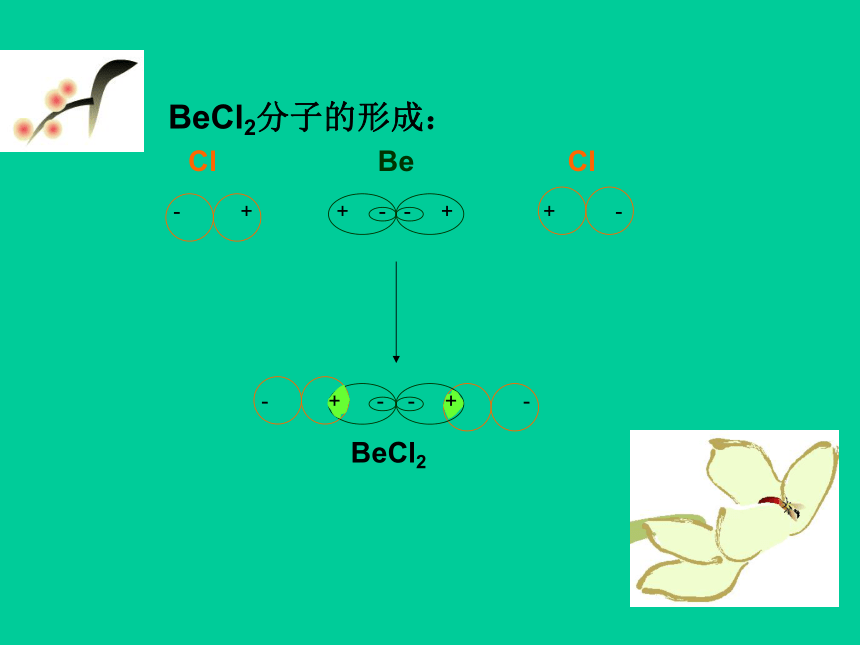
BeCl2分子的形成:
1)sp杂化
乙炔中的碳原子为sp杂化,分子呈直线构型。
两个碳原子的sp杂化轨道沿各自对称轴形成C—C ? 键,另两个sp杂化轨道分别与两个氢原子的1s轨道重叠形成两个C—H ?键,两个py轨道和两个pz轨道分别从侧面相互重叠,形成两个相互垂直的C—C?键,形成乙炔分子。
2)空间结构是直线型:
三个σ键在一条直线上。
3.sp2杂化:一个s轨道与两个p轨道杂化,得三个sp2杂化轨道,每个杂化轨道的s成分为1/3,p成分为2/3,三个杂化轨道在空间分布是在同一平面上,互成120?
例:BF3中B的电子构型:1s22s22p1
BF3分子的形成:
BCl3、CO32–、NO3–、H2C=O、SO3、烯烃>C=C<结构中的中心原子都是以sp2杂化的。
以sp2杂化轨道构建结构骨架的中心原子必有一个垂直于sp2-骨架的未参与杂化的p轨道,如果这个轨道跟邻近原子上的平行p轨道重叠,并填入电子,就会形成π键。如,乙烯H2C=CH2、甲醛H2C=O。
石墨、苯中碳原子也是以sp2杂化的:
乙烯中的C在轨道杂化时,有一个P轨道未参与杂化,只是C的2s与两个2p轨道发生杂化,形成三个相同的sp2杂化轨道,三个sp2杂化轨道分别指向平面三角形的三个顶点。未杂化p轨道垂直于sp2杂化轨道所在平面。杂化轨道间夹角为120°。
C的sp2杂化
小结:s-p型的三种杂化比较
杂 化
类 型 sp Sp2 sp3
参与杂化的原子轨道 1个 s + 1个p 1个s + 2个p 1个s + 3个p
杂 化 轨 道 数 2个sp杂化轨道 3个sp2杂化轨道 4个sp3杂化轨道
杂化轨道
间夹角 1800 1200 1090 28’
空? 间?
构? 型 直 线 正三角形 正四面体
实? ?????例 BeCl2 , C2H2 BF3? , C2H4 CH4? , CCl4
杂化轨道数=
中心原子孤对电子对数+中心原子结合的原子数
例1:下列分子中的中心原子杂化轨道的类型相同的是 ( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H2与C2H4
B
例2:对SO2与CO2说法正确的是( )
A.都是直线形结构
B.中心原子都采取sp杂化轨道
C. S原子和C原子上都没有孤对电子
D. SO2为V形结构, CO2为直线形结构
D
例3:写出下列分子的路易斯结构式并指出中心原子可能采用的杂化轨道类型,并预测分子的几何构型。
(1) PCl3 (2)BCl3 (3)CS2 (4) C12O
第二节 分子的立体结构
(第二课时)
思考:
价层电子对互斥模型只能解释化合物分子的空间构形,却无法解释许多深层次的问题,如无法解释甲烷中四个C-H的键长、键能相同及H-C-H的键角为109?28′。因为按照我们已经学过的价键理论,甲烷的4个C-H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到四面体构型的甲烷分子。
这是为什么呢?
三、杂化理论:
1.在形成分子时,每一原子中能量相近的“轨道”会发生重组,形成新的原子轨道,这个过程称“杂化”,新的原子轨道称“杂化轨道”。
2.杂化前后原子“轨道”总数不变,但能量趋于平均化,“杂化轨道”的对称性更高,杂化后轨道伸展方向,形状发生改变,更有利于成键。
3.原子可用“杂化轨道”与其它原子的轨道(或“杂化轨道”)重叠形成共价键。
为了补充了价键理论的不足,鲍林(Pauling)在价键理论基础上提出了“杂化”假设。
三、杂化轨道理论简介
(2)要点:
(1)sp3杂化
1个S轨道和3个P轨道
基态原子
激发态原子
4个相同的SP3杂化轨道
混杂
三、杂化轨道理论简介
除sp3杂化轨道外,还有sp杂化轨道和sp2杂化轨道。sp杂化轨道由1个s轨道和1个p轨道杂化而得;sp2杂化轨道由1个s轨道和2个p轨道杂化而得。
2. sp杂化:同一原子中1个s轨道与1个p轨道杂化形成2个sp杂化轨道。每个杂化轨道的s成分为1/2,p成分为1/2,杂化轨道之间的夹角为180度。
例:4Be
sp杂化
两个sp杂化轨道
其他例子: CO2、HC≡CH
BeCl2分子的形成:
1)sp杂化
乙炔中的碳原子为sp杂化,分子呈直线构型。
两个碳原子的sp杂化轨道沿各自对称轴形成C—C ? 键,另两个sp杂化轨道分别与两个氢原子的1s轨道重叠形成两个C—H ?键,两个py轨道和两个pz轨道分别从侧面相互重叠,形成两个相互垂直的C—C?键,形成乙炔分子。
2)空间结构是直线型:
三个σ键在一条直线上。
3.sp2杂化:一个s轨道与两个p轨道杂化,得三个sp2杂化轨道,每个杂化轨道的s成分为1/3,p成分为2/3,三个杂化轨道在空间分布是在同一平面上,互成120?
例:BF3中B的电子构型:1s22s22p1
BF3分子的形成:
BCl3、CO32–、NO3–、H2C=O、SO3、烯烃>C=C<结构中的中心原子都是以sp2杂化的。
以sp2杂化轨道构建结构骨架的中心原子必有一个垂直于sp2-骨架的未参与杂化的p轨道,如果这个轨道跟邻近原子上的平行p轨道重叠,并填入电子,就会形成π键。如,乙烯H2C=CH2、甲醛H2C=O。
石墨、苯中碳原子也是以sp2杂化的:
乙烯中的C在轨道杂化时,有一个P轨道未参与杂化,只是C的2s与两个2p轨道发生杂化,形成三个相同的sp2杂化轨道,三个sp2杂化轨道分别指向平面三角形的三个顶点。未杂化p轨道垂直于sp2杂化轨道所在平面。杂化轨道间夹角为120°。
C的sp2杂化
小结:s-p型的三种杂化比较
杂 化
类 型 sp Sp2 sp3
参与杂化的原子轨道 1个 s + 1个p 1个s + 2个p 1个s + 3个p
杂 化 轨 道 数 2个sp杂化轨道 3个sp2杂化轨道 4个sp3杂化轨道
杂化轨道
间夹角 1800 1200 1090 28’
空? 间?
构? 型 直 线 正三角形 正四面体
实? ?????例 BeCl2 , C2H2 BF3? , C2H4 CH4? , CCl4
杂化轨道数=
中心原子孤对电子对数+中心原子结合的原子数
例1:下列分子中的中心原子杂化轨道的类型相同的是 ( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H2与C2H4
B
例2:对SO2与CO2说法正确的是( )
A.都是直线形结构
B.中心原子都采取sp杂化轨道
C. S原子和C原子上都没有孤对电子
D. SO2为V形结构, CO2为直线形结构
D
例3:写出下列分子的路易斯结构式并指出中心原子可能采用的杂化轨道类型,并预测分子的几何构型。
(1) PCl3 (2)BCl3 (3)CS2 (4) C12O
