沪教版(上海)初中化学九年级第二学期第六单元 常用的金属和盐检测题(含答案)
文档属性
| 名称 | 沪教版(上海)初中化学九年级第二学期第六单元 常用的金属和盐检测题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 117.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-12 16:53:46 | ||
图片预览



文档简介
《常用的金属和盐》检测题
一、单选题
1.除去下列物质中含有的少量杂质,所用试剂或方法错误的是
选项 物质(括号内为杂质) 所用试剂、方法
A CaO 粉末(CaCO3) 足量水,过滤
B NaOH 溶液(Na2CO3) 适量的氢氧化钙溶液,过滤
C Cu 粉(Fe) 足量的硫酸铜溶液,过滤
D CuCl2 溶液(HCl) 足量的氧化铜粉末,过滤
A.A B.B C.C D.D
2.向一定量CaCl2和HCl的混合溶液中,逐渐加入某浓度的Na2CO3溶液,反应过程中产生气体或沉淀的质量与加入的Na2CO3溶液的质量关系如图,下列说法错误的是
A.OE发生化学反应:Na2CO3+2HCl═2NaCl+H2O+CO2↑
B.Q点数值是P点数值的两倍
C.G点溶液的pH>7
D.E点和F点的溶液中溶质种类相同
3.下列物质混合,能发生化学反应且现象不明显的是( )
A.澄清石灰水与硫酸铜溶液 B.氢氧化钠溶液与稀盐酸
C.盐酸与纯碱溶液 D.硫酸钠溶液与氯化铜溶液
4.下列排序正确的是
A.利用金属的年代 B.铁元素质量分数
C.碳元素的化合价: D.金属的活动性
5.下列说法中正确的是( )
A.原子的质量几乎都集中在原子核上
B.生活中的“高钙牛奶”、“碘盐”中的“钙”、“碘”指的是原子
C.通常把pH<7的雨水称为酸雨
D.氯化铵可以与熟石灰混合施用
6.下列变化中,氧元素由游离态变为化合态的是( )
A.水通电生成氢气和氧气
B.二氧化碳通入水生成碳酸
C.从液态空气中分离出液氧
D.镁带燃烧生成氧化镁
7.下列离子在水中能大量共存,并形成无色溶液的是( )
A.SO42- 、 Cu2+、 Na+ B.Mg2+、OH-、NO3-
C.CO32-、K+、Ca2+ D.C1-、K+、OH-
8.下列试剂不能用来鉴别稀硫酸和氢氧化钠溶液的是
A.紫色石蕊试液 B.酚酞溶液 C.NaNO3溶液 D.BaCl2溶液
9.下列与洗涤有关的做法不合理的是( )
A.用洗洁精洗去餐具上的油污,利用了乳化原理
B.汽油可以溶解沾在衣服上的油渍
C.用白醋洗去水壶中的水垢(水垢的主要成分是碳酸钙和氢氧化镁)
D.用盐酸长时间浸泡铁制品,以除去表面的铁锈
10.下列产物可以由金属直接与酸反应而制得的是( )
A.FeCl3 B.FeSO4 C.CuSO4 D.AgCl
11.将水蒸气通过灼热的炭层可发生如下反应:H2O+CH2+CO,其中作还原剂的是 ( )
A.H2O B.C C.H2 D.CO
12.下列有关物质的化学式、名称、俗名完全一致的是( )
A.Na2CO3、碳酸钠、纯碱 B.NaOH、氢氧化钠、小苏打
C.CO、甲烷、沼气 D.Ca(OH)2、氢氧化钙、生石灰
13.2012年两会期间“航空母舰”再次成为热门词。海军副司令员徐洪猛表示:今年我国将有安排航母入役的计划。建造航母需要大量的特种钢材。钢材属于
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
二、实验题
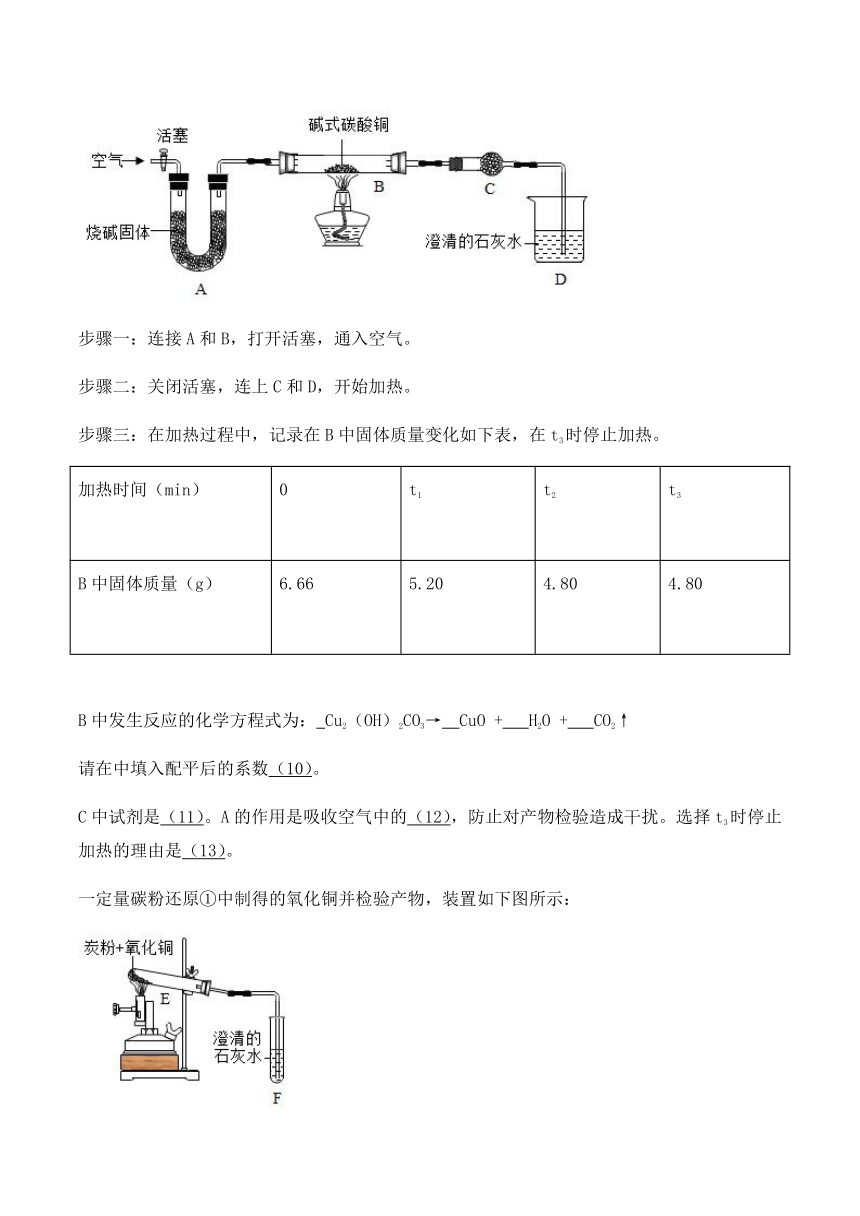
14.实验室可利用碱式碳酸铜(化学式:Cu2(OH)2CO3)制备氧化铜,并进行碳粉还原氧化铜的实验。
①制备氧化铜并检验产物,装置如下图所示(省略夹持仪器):
步骤一:连接A和B,打开活塞,通入空气。
步骤二:关闭活塞,连上C和D,开始加热。
步骤三:在加热过程中,记录在B中固体质量变化如下表,在t3时停止加热。
加热时间(min)
0
t1
t2
t3
B中固体质量(g)
6.66
5.20
4.80
4.80
B中发生反应的化学方程式为: Cu2(OH)2CO3→ CuO + H2O + CO2↑
请在中填入配平后的系数(10)。
C中试剂是(11)。A的作用是吸收空气中的(12),防止对产物检验造成干扰。选择t3时停止加热的理由是(13)。
一定量碳粉还原①中制得的氧化铜并检验产物,装置如下图所示:
实验过程中,观察到F中溶液变浑浊,E中的现象是(14)。
反应完全后,若仅撤走酒精喷灯停止加热,可能导致的后果是(15)。
分析:若①中省略步骤三,对②中反应产物判断可能产生的影响及其原因。
(16)
15.同学们利用如图所示装置进行气体的制备实验(A~F为装置编号)
(1)写出图C装置中甲仪器的名称______.
(2)用C装置用过氧化氢溶液和二氧化锰的混合物制取氧气,化学方程式为______,其中二氧化锰起______作用;收集氧气可以选择______(填装置编号)
(3)实验室制取CO2通常选择下列药品中的______(填药品序号)
a、稀盐酸 b.熟石灰 c.块状石灰石 d.稀硫酸
通常检验CO2气体的反应可用化学方程式表示为__________________.
(4)常温下,可用固体硫化亚铁(FeS)和稀硫酸反应制取硫化氢(H2S)气体,若要控制滴加液体的速率,可选择的发生装置是______(填装置编号,下同).实验室制取氢气应选择的发生和收集装置的组合可以使______.
(5)制取气体前应先检查装置的气密性,若按F图所示操作,结果在导管口未看到气泡,其可能原因与下列因素无关的是______(填序号).
a.将烧杯换成水槽 b.导管深入水中位置过深,气体无法逸出
c.将水换成冰水 d.先用手捂住试管壁,再将导管另一端插入水中.
三、推断题
16.现有一包固体粉末,可能由CaCO3、CaO、Na2CO3中的一种或几种组成。为确定其组成,进行了如下图所示的实验(假设实验过程无损耗)。
请回答:
(1)根据实验可以确定白色沉淀是________;原固体粉末中一定含有_____________,它的可能组成有____________种。
(2)若实验取固体粉末20g,生成白色沉淀10g,最后得到溶质质量分数为5.85%的X溶液200g(只含一种溶质),则X溶液中溶质的质量是____g,固体粉末由______________(填化学式,下同)组成,其中质量小于10g的是_____________________。
17.某食盐样品中含有少量泥沙、CaCl2和Na2SO4,按图方案提纯得到NaCl晶体。
(1)试剂A为_______。
(2)固体丙的主要成分是_____________。
四、计算题
18.小芳在实验室用石灰石和稀盐酸制取了二氧化碳,并对实验产生的废液进行溶质成分鉴定:取废液上层清液50克,滴加质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,洗涤,干燥,称得沉淀质量为5克,并绘制了图象,如图:
(1)图象中的a点数值___
(2)废液中含有的溶质是___(写化学式)
(3)通过计算说明,图象横坐标中b点表示的溶液的质量是____?
19.化学课外小组同学取8g石灰石(主要成分是CaCO3)样品于烧杯中,进行测定实验。现将40g稀盐酸 分四次加入烧杯中(反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O,石灰石中其他杂质不溶于水也不参与反应,反应生成的CaCl2能全部溶解在水中),充分反应后,测得有关数据如下表所示:
实验 第1次 第2次 第3次 第4次
加入稀盐酸的质量/g 10 10 10 10
烧杯中剩余固体的质量/g 5.5 3.0 m 1.2
(1)8g石灰石样品中杂质的质量为__________g;
(2)上表中m的数值是____________;
(3)高温锻烧石灰石样品可制得生石灰(CaO)和二氧化碳。如果锻烧这种石灰石样品100kg(杂质不反应),理论上最多能制得氧化钙多少____________kg?(根据化学方程式列式计算,注意格式的规范)
20.磷酸氢二铵[(NH4)2HPO4]是一种化肥,它对提高农作物的产量具有重要作用.填空:
(1)(NH4)2HPO4_____(填“属于”或“不属于”)复合肥料,它由_____(写数字)种元素组成.
(2)(NH4)2HPO4的相对分子质量是_____;
(3)(NH4)2HPO4中氮元素的质量分数为_____(精确到0.1%)
参考答案
1.A 2.D 3.B 4.C 5.A 6.D 7.D 8.C 9.D 10.B 11.B 12.A 13.A
14.(10)1 2 1 1(11)无水硫酸铜。
(12)水蒸气和二氧化碳(13)固体的质量不再减少
(14)黑色粉末变成红色。
(15)F装置内的液体通过导管倒流入E中,使试管炸裂
(16)不能确定生成物中是否有二氧化碳 因为可能有①中未分解的碱式碳酸铜在实验②分解,产生二氧化碳,干扰对炭粉还原氧化铜反应生成的判断进。
15.分液漏斗; 2H2O22H2O+O2↑; 催化; D或E; ac; Ca(OH)2+CO2═CaCO3↓+H2O. C; CE或BE; abc
16.CaCO3(或“碳酸钙”) Na2CO3(或“碳酸钠”) 3 11.7 CaCO3、CaO、Na2CO3 CaCO3、CaO
17.氯化钡溶液。碳酸钙、碳酸钡。
18.(1)1.1;(2)HCl、CaCl2;
(3)图象横坐标中b点表示的溶液的质量是30g.
19.1.2 1.2 47.6g(详见解析)
20.属于 4 132 21.2%
