苏教版高一化学必修二第三单元第一课时《化学能转化为电能》课件(20张ppt)
文档属性
| 名称 | 苏教版高一化学必修二第三单元第一课时《化学能转化为电能》课件(20张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-12 21:41:13 | ||
图片预览





文档简介
(共20张PPT)
专题2 化学反应与能量转化
第三单元 化学能与电能的转化
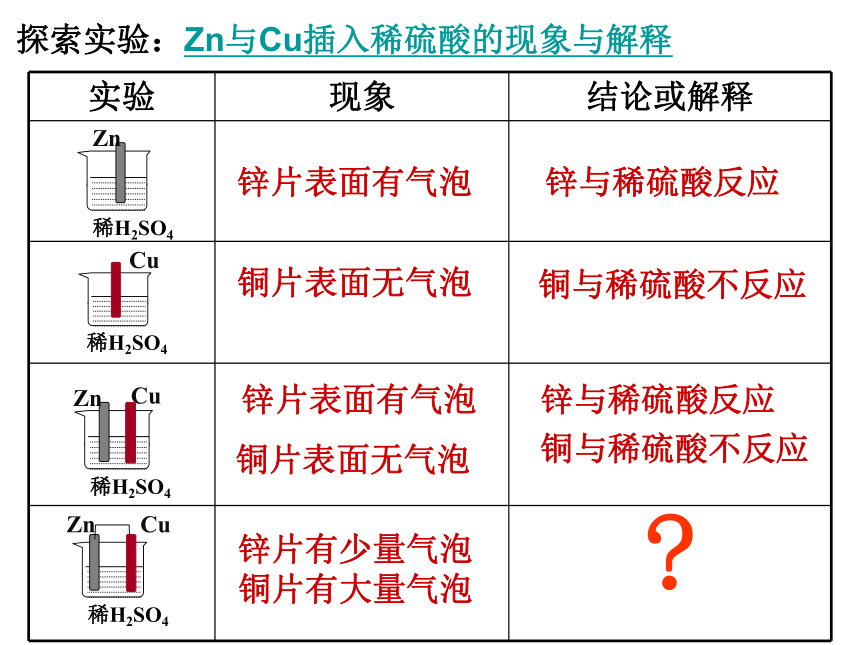
探索实验:Zn与Cu插入稀硫酸的现象与解释
锌片表面有气泡
铜片表面无气泡
铜与稀硫酸不反应
锌与稀硫酸反应
?
锌片有少量气泡铜片有大量气泡
锌片表面有气泡
铜片表面无气泡
实验 现象 结论或解释
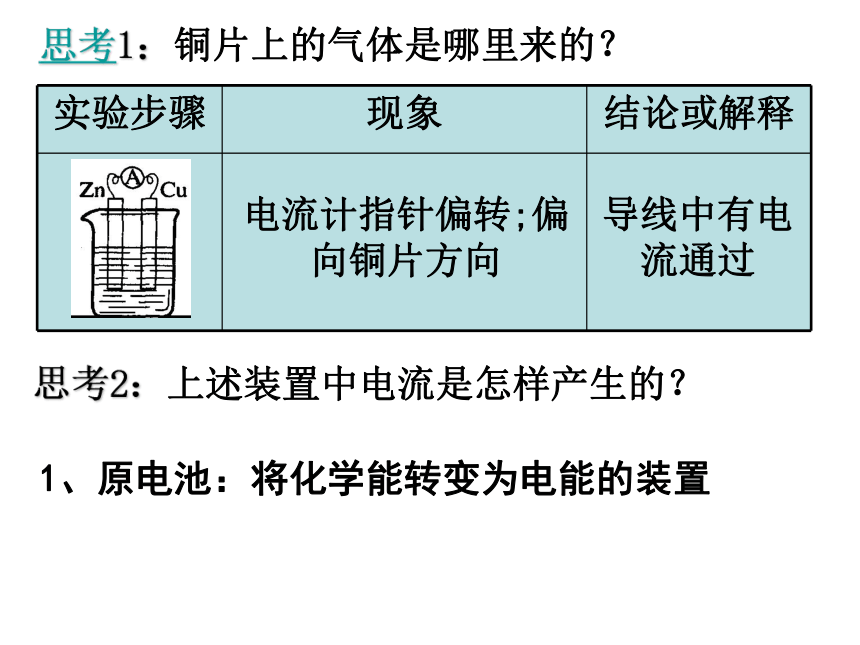
思考1:铜片上的气体是哪里来的?
电流计指针偏转;偏向铜片方向
导线中有电流通过
思考2:上述装置中电流是怎样产生的?
1、原电池:将化学能转变为电能的装置
实验步骤 现象 结论或解释
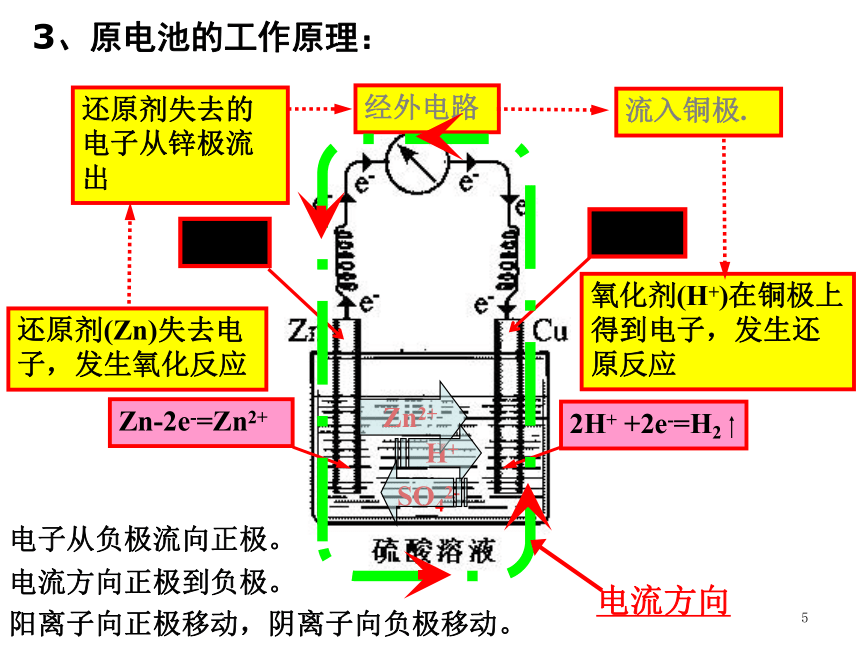
结合下图和有关物理知识确定原电池的电极名称。
负极:电子流出的电极(较活泼的金属), 失去电子,发生氧化反应
正极:电子流入的电极(较不活泼的金属、
石墨等),得到电子,发生还原反应
2、电极的判定
*
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
流入铜极.
经外电路
Zn2+
H+
SO42-
电流方向
3、原电池的工作原理:
电子从负极流向正极。
电流方向正极到负极。
阳离子向正极移动,阴离子向负极移动。
*
4、原电池的电极反应式
氧化
反应
Zn-2e-= Zn2+
2H+ + 2e-=H2↑
负极
正极
Zn+2H+=Zn2++H2↑
还原
反应
电极
材料 电极反应 反应
类型 原电池
的电极
Zn片
Cu片
电池总反应
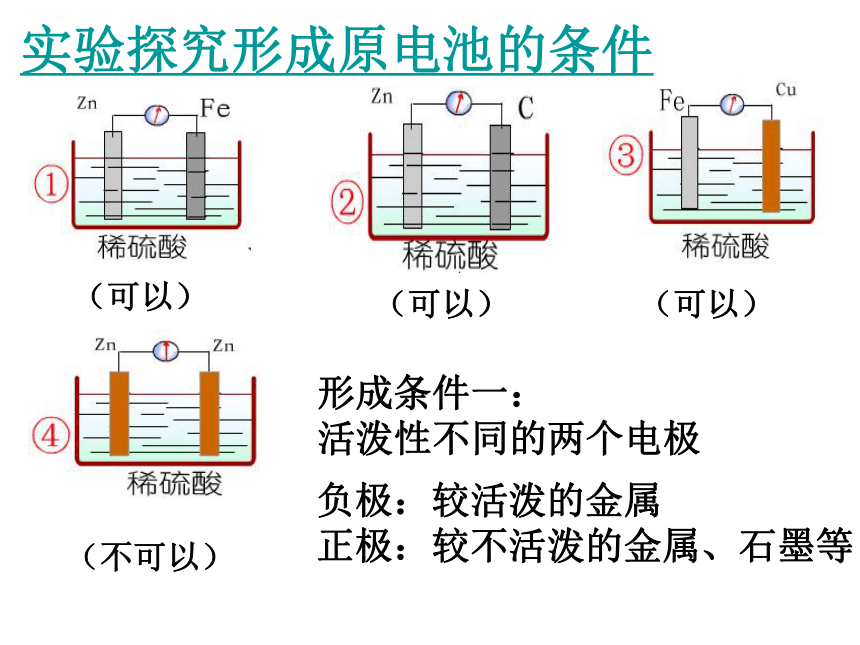
实验探究形成原电池的条件
(可以)
(可以)
(可以)
(不可以)
形成条件一:
活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属、石墨等
(可以)
(不可以)
形成条件二:电极需插进电解质溶液中
实验探究形成原电池的条件
实验探究形成原电池的条件
形成条件三:必须形成闭合回路
(不可以)
5、原电池的构成条件:
(1)有自发发生的氧化还原反应
(2)有活动性不同的两种金属【或金属与非金属导体(如石墨)】作电极。
(3)有电解质溶液
(4)形成闭合电路【两电极用导线相连接或直接相互接触】
下列哪些装置能产生电流,形成原电池?
√
√
√
×
×
×
6、 原电池原理的应用
(1).加快氧化还原反应速率
如实验室用Zn和稀H2SO4(或稀盐酸)反应制H2,常用粗锌,它产生H2的速率快。原因是粗锌中的杂质和锌、稀H2SO4形成原电池,加快了锌的腐蚀,使产生H2的速率加快。
2.比较金属的活动性强弱
原电池中,一般活动性强的金属为负极,活动性弱的金属为正极。例如有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活动性A>B。
3.设计原电池
从理论上说,所有的氧化还原反应都可设计成原电池。设计原电池时,根据已知要求,结合氧化还原反应的有关知识确定原电池的正、负极及材料,再结合原电池总反应确定电解质溶液及电极反应式。
例 现有反应:
A.NaOH+HCl===NaCl+H2O
B.Zn+H2SO4===ZnSO4+H2↑
(1)根据两反应本质,判断能否设计成原电池:__________________________________________________。
(2)如果不能,说明其原因___________________________。
(3)如果可以,则写出正、负极材料及其电极反应式、电解质溶液名称:
负极________,____________________________________;
正极________,____________________________________。
电解质溶液:______________________________________。
1.下列装置中能组成原电池形成电流的是( )
C
2.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B
3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不变 B先变大后变小
C逐渐变大 D.逐渐变小
C
4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
5.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )
C
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
阅读教材41页 资料卡 分析钢铁电化学腐蚀
的原因。
钢铁的吸氧腐蚀
原理:在潮湿空气中钢铁表面形成无数微小的原电池。
负极:Fe—2e—=Fe2+
正极:2H2O+O2+4e—=4OH—
Fe2+ +2OH— =Fe(OH)2
4Fe(OH)2 +2H20+O2 = 4Fe(OH)3
2Fe(OH)3=Fe2O3+3H2O
专题2 化学反应与能量转化
第三单元 化学能与电能的转化
探索实验:Zn与Cu插入稀硫酸的现象与解释
锌片表面有气泡
铜片表面无气泡
铜与稀硫酸不反应
锌与稀硫酸反应
?
锌片有少量气泡铜片有大量气泡
锌片表面有气泡
铜片表面无气泡
实验 现象 结论或解释
思考1:铜片上的气体是哪里来的?
电流计指针偏转;偏向铜片方向
导线中有电流通过
思考2:上述装置中电流是怎样产生的?
1、原电池:将化学能转变为电能的装置
实验步骤 现象 结论或解释
结合下图和有关物理知识确定原电池的电极名称。
负极:电子流出的电极(较活泼的金属), 失去电子,发生氧化反应
正极:电子流入的电极(较不活泼的金属、
石墨等),得到电子,发生还原反应
2、电极的判定
*
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
流入铜极.
经外电路
Zn2+
H+
SO42-
电流方向
3、原电池的工作原理:
电子从负极流向正极。
电流方向正极到负极。
阳离子向正极移动,阴离子向负极移动。
*
4、原电池的电极反应式
氧化
反应
Zn-2e-= Zn2+
2H+ + 2e-=H2↑
负极
正极
Zn+2H+=Zn2++H2↑
还原
反应
电极
材料 电极反应 反应
类型 原电池
的电极
Zn片
Cu片
电池总反应
实验探究形成原电池的条件
(可以)
(可以)
(可以)
(不可以)
形成条件一:
活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属、石墨等
(可以)
(不可以)
形成条件二:电极需插进电解质溶液中
实验探究形成原电池的条件
实验探究形成原电池的条件
形成条件三:必须形成闭合回路
(不可以)
5、原电池的构成条件:
(1)有自发发生的氧化还原反应
(2)有活动性不同的两种金属【或金属与非金属导体(如石墨)】作电极。
(3)有电解质溶液
(4)形成闭合电路【两电极用导线相连接或直接相互接触】
下列哪些装置能产生电流,形成原电池?
√
√
√
×
×
×
6、 原电池原理的应用
(1).加快氧化还原反应速率
如实验室用Zn和稀H2SO4(或稀盐酸)反应制H2,常用粗锌,它产生H2的速率快。原因是粗锌中的杂质和锌、稀H2SO4形成原电池,加快了锌的腐蚀,使产生H2的速率加快。
2.比较金属的活动性强弱
原电池中,一般活动性强的金属为负极,活动性弱的金属为正极。例如有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活动性A>B。
3.设计原电池
从理论上说,所有的氧化还原反应都可设计成原电池。设计原电池时,根据已知要求,结合氧化还原反应的有关知识确定原电池的正、负极及材料,再结合原电池总反应确定电解质溶液及电极反应式。
例 现有反应:
A.NaOH+HCl===NaCl+H2O
B.Zn+H2SO4===ZnSO4+H2↑
(1)根据两反应本质,判断能否设计成原电池:__________________________________________________。
(2)如果不能,说明其原因___________________________。
(3)如果可以,则写出正、负极材料及其电极反应式、电解质溶液名称:
负极________,____________________________________;
正极________,____________________________________。
电解质溶液:______________________________________。
1.下列装置中能组成原电池形成电流的是( )
C
2.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B
3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不变 B先变大后变小
C逐渐变大 D.逐渐变小
C
4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
5.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )
C
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
阅读教材41页 资料卡 分析钢铁电化学腐蚀
的原因。
钢铁的吸氧腐蚀
原理:在潮湿空气中钢铁表面形成无数微小的原电池。
负极:Fe—2e—=Fe2+
正极:2H2O+O2+4e—=4OH—
Fe2+ +2OH— =Fe(OH)2
4Fe(OH)2 +2H20+O2 = 4Fe(OH)3
2Fe(OH)3=Fe2O3+3H2O
