人教版高中化学选修三第二章第二节 分子的立体构型 课件(共23张PPT)
文档属性
| 名称 | 人教版高中化学选修三第二章第二节 分子的立体构型 课件(共23张PPT) | 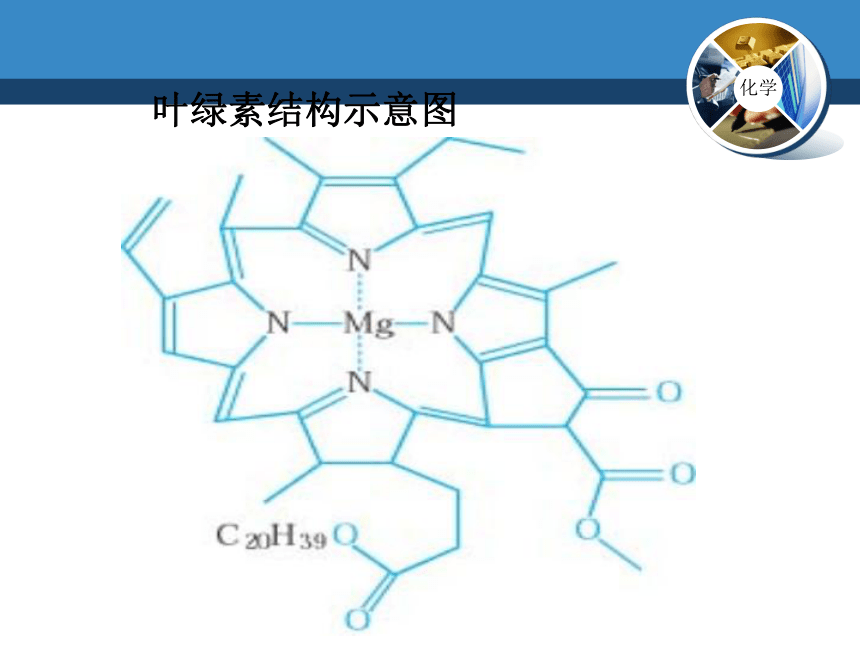 | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-13 09:59:04 | ||
图片预览







文档简介
(共23张PPT)
叶绿素结构示意图
高二选修3 物质结构与性质
第二章第二节 分子的立体构型 ——配合物理论简介
目标
为什么CuSO4 ?5H2O晶体是蓝色而无水CuSO4 是白色?
为什么CuSO4 ?5H2O晶体是蓝色而无水CuSO4 是白色?
任务:
(1)7人小组合作完成实验
(2)将实验现象以表格的形式记录于小卡上,抽小组报告结果。
(3)分工合作:操作员、声控员、记录员、计时员、发言员
时间:5分钟
约定:“ CuSO4 ?5H2O,蓝色晶体”停止实验,倒数五个数,归位并且安静。
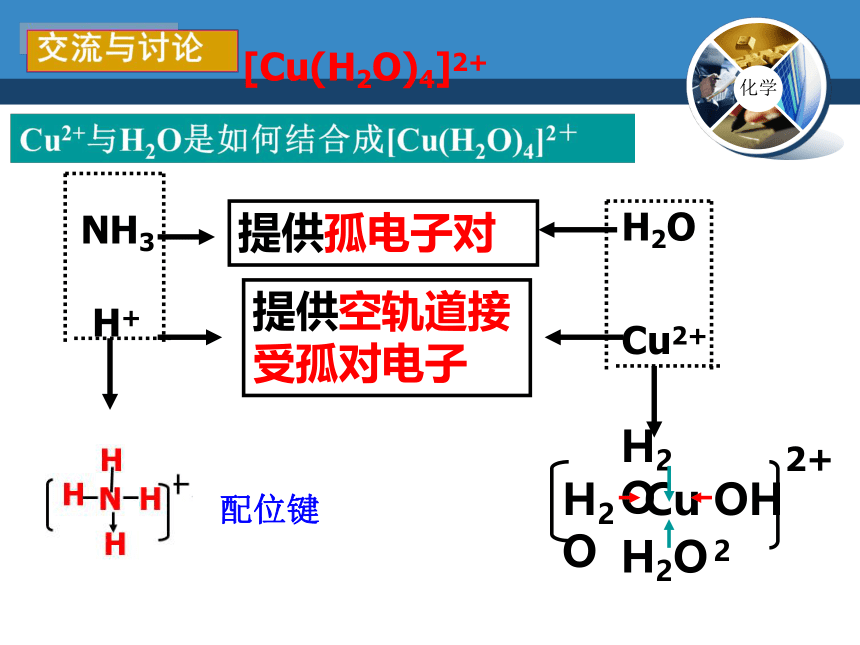
[Cu(H2O)4]2+
SO42 –
天蓝色
天蓝色
天蓝色
无色
无色
无色
Na+
Cl-
K +
Br -
K +
为什么CuSO4 ?5H2O晶体是蓝色而无水CuSO4 是白色?
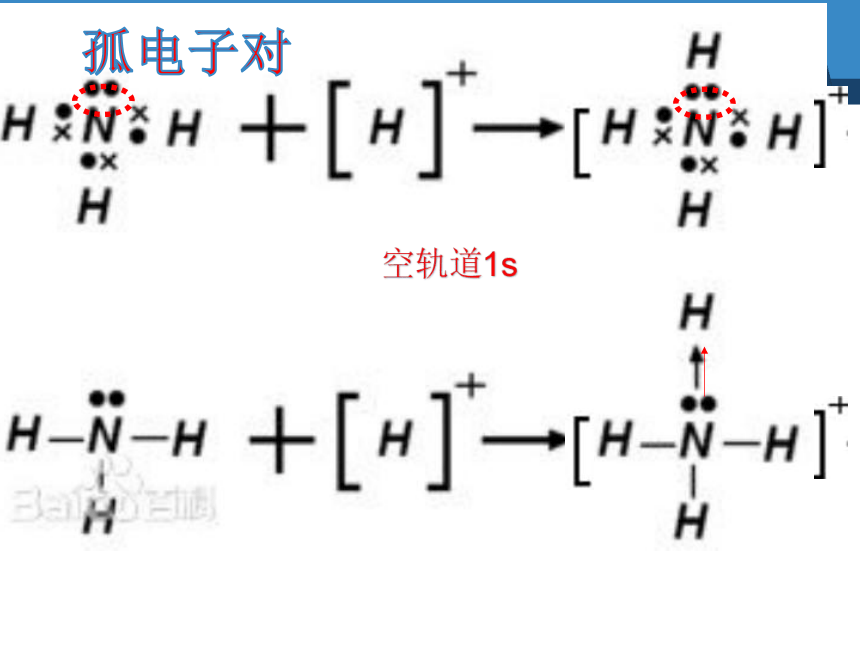
Cu2+
H+
提供空轨道接受孤对电子
NH3
提供孤电子对
H2O
配位键
[Cu(H2O)4]2+
Cu2+
空轨道接受孤电子对
提供孤电子对
H2O
分析
Cu2+与H2O是如何结合成[Cu(H2O)4]2+
配位键
1.配位键定义
提供孤电子对的原子与接受孤电子对的原子之间形成的共价键(也是一种共价键)
电子对
给予体
电子对
接受体
3.配位键表示方法
4、配合物
(2) 配合物的组成
中心离子
配体
配位数
(1) 定义
通常把接受孤电子对的金属离子(或原子)与某些提供孤电子对的分子或离子以配位键结合形成的化合物称为配位化合物,简称配合物
(配离子)
读作:硫酸四水合铜
外界
1、指出下列配合物的内界并填下表
[Ag(NH3)2]OH
[Ni(CO)4]
K[Pt(NH3)Cl3]
[Ag(NH3)2]OH
[Ni(CO)4]
K[Pt(NH3)Cl3]
OH- Ag+ NH3 2
K+ Pt2+ NH3、Cl- 4
练习
—— Ni CO 4
配 合 物 外界 中心原子 配位体 配位数
任务:
(1)7人小组合作完成实验
(2)将实验现象记录于小卡上,顺时针交流,实验报告,实验最快小组把结果写在大板卡上。
(3)分工合作:操作员、声控员、记录员、计时员、发言员
时间:5分钟
约定:“ 蓝矾苦矾,蓝色晶体”停止实验,倒数五个数,归位并且安静。
实验探究[2—2] (取实验[2-1]所得硫酸铜溶液1/3实验)根据现象分析溶液成分的变化并说明你的推断依据,记录现象和写出相关的离子方程式,找出配位键,配体?
除水外,是否有其他电子给予体?
[Cu(NH3)4 ]SO4
天蓝色溶液
蓝色沉淀
深蓝色溶液
Cu 2+ +2NH3 . H2O
实验探究2:CuSO4+NH3·H2O
+2 NH4 +
[Cu(NH3)4]2+
+2OH- +4H2O
Fe3++3SCN- = Fe(SCN)3
血红色
Fe3+是如何检验的?
配位数可为1—6
任务:
(1)个人思考1分钟
(2)二人1小组交流1分钟
常见的配位体
X-
CO
H2O
NH3
SCN-
血红素(含铁配合物)
叶绿素(含镁配合物)
维生素B12
(含钴配合物)
2、向下列配合物的水溶液中加入AgNO3溶液不能生成 AgCl沉淀的是( )
A.[Co(NH3) 4Cl2] Cl
B.[Co(NH3) 3Cl3]
C.[Co(NH3) 6] Cl3
D.[Co(NH3) 5Cl] Cl2
B
1、配位键
定义
配位键的形成条件
一方提供孤电子对
一方提供空轨道
“电子对给予—接受共价键”
2、配合物
配合物的组成
定义
配合物的应用
谈谈你学到什么?,你小组合作如何?
我们的生活 我们的未来
叶绿素结构示意图
高二选修3 物质结构与性质
第二章第二节 分子的立体构型 ——配合物理论简介
目标
为什么CuSO4 ?5H2O晶体是蓝色而无水CuSO4 是白色?
为什么CuSO4 ?5H2O晶体是蓝色而无水CuSO4 是白色?
任务:
(1)7人小组合作完成实验
(2)将实验现象以表格的形式记录于小卡上,抽小组报告结果。
(3)分工合作:操作员、声控员、记录员、计时员、发言员
时间:5分钟
约定:“ CuSO4 ?5H2O,蓝色晶体”停止实验,倒数五个数,归位并且安静。
[Cu(H2O)4]2+
SO42 –
天蓝色
天蓝色
天蓝色
无色
无色
无色
Na+
Cl-
K +
Br -
K +
为什么CuSO4 ?5H2O晶体是蓝色而无水CuSO4 是白色?
Cu2+
H+
提供空轨道接受孤对电子
NH3
提供孤电子对
H2O
配位键
[Cu(H2O)4]2+
Cu2+
空轨道接受孤电子对
提供孤电子对
H2O
分析
Cu2+与H2O是如何结合成[Cu(H2O)4]2+
配位键
1.配位键定义
提供孤电子对的原子与接受孤电子对的原子之间形成的共价键(也是一种共价键)
电子对
给予体
电子对
接受体
3.配位键表示方法
4、配合物
(2) 配合物的组成
中心离子
配体
配位数
(1) 定义
通常把接受孤电子对的金属离子(或原子)与某些提供孤电子对的分子或离子以配位键结合形成的化合物称为配位化合物,简称配合物
(配离子)
读作:硫酸四水合铜
外界
1、指出下列配合物的内界并填下表
[Ag(NH3)2]OH
[Ni(CO)4]
K[Pt(NH3)Cl3]
[Ag(NH3)2]OH
[Ni(CO)4]
K[Pt(NH3)Cl3]
OH- Ag+ NH3 2
K+ Pt2+ NH3、Cl- 4
练习
—— Ni CO 4
配 合 物 外界 中心原子 配位体 配位数
任务:
(1)7人小组合作完成实验
(2)将实验现象记录于小卡上,顺时针交流,实验报告,实验最快小组把结果写在大板卡上。
(3)分工合作:操作员、声控员、记录员、计时员、发言员
时间:5分钟
约定:“ 蓝矾苦矾,蓝色晶体”停止实验,倒数五个数,归位并且安静。
实验探究[2—2] (取实验[2-1]所得硫酸铜溶液1/3实验)根据现象分析溶液成分的变化并说明你的推断依据,记录现象和写出相关的离子方程式,找出配位键,配体?
除水外,是否有其他电子给予体?
[Cu(NH3)4 ]SO4
天蓝色溶液
蓝色沉淀
深蓝色溶液
Cu 2+ +2NH3 . H2O
实验探究2:CuSO4+NH3·H2O
+2 NH4 +
[Cu(NH3)4]2+
+2OH- +4H2O
Fe3++3SCN- = Fe(SCN)3
血红色
Fe3+是如何检验的?
配位数可为1—6
任务:
(1)个人思考1分钟
(2)二人1小组交流1分钟
常见的配位体
X-
CO
H2O
NH3
SCN-
血红素(含铁配合物)
叶绿素(含镁配合物)
维生素B12
(含钴配合物)
2、向下列配合物的水溶液中加入AgNO3溶液不能生成 AgCl沉淀的是( )
A.[Co(NH3) 4Cl2] Cl
B.[Co(NH3) 3Cl3]
C.[Co(NH3) 6] Cl3
D.[Co(NH3) 5Cl] Cl2
B
1、配位键
定义
配位键的形成条件
一方提供孤电子对
一方提供空轨道
“电子对给予—接受共价键”
2、配合物
配合物的组成
定义
配合物的应用
谈谈你学到什么?,你小组合作如何?
我们的生活 我们的未来
