人教化学选修3第三章第2节分子晶体和原子晶体(共24张PPT)
文档属性
| 名称 | 人教化学选修3第三章第2节分子晶体和原子晶体(共24张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-13 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
第二节 分子晶体
碘晶体结构
干冰晶体结构
观察与思考: 下列两种晶体有什么共同点?
NaCl晶体结构
一、分子晶体
2、组成微粒:
分子
3、粒子间作用力:
分子内原子间以共价键结合,相邻分子间靠分子间作用力或氢键相互吸引
记住
结合表格和已有知识,分析:分子晶体有哪些物理特性?为什么?
原因:分子间作用力较弱
4、物理特性:
(1)较低的熔点和沸点,易升华;
(3)一般都是绝缘体,熔融状态也不导电。有些在水溶液中可以导电.
(2)较小的硬度;
注:①分子间作用力越大,熔沸点越高 ② 分子晶体熔化时一般只破坏分子间作用力,不破坏化学键,
掌握特性及原因
5、典型的分子晶体:
(1)所有非金属氢化物:H2O,H2S,NH3, CH4,HX
(2)部分非金属单质:X2,O2,H2, S8, P4, C60
(3)部分非金属氧化物: CO2, SO2, NO2,
P4O6, P4O10
(4)几乎所有的酸:H2SO4,HNO3,H3PO4
(5)绝大多数有机物的晶体:乙醇,冰醋酸, 蔗糖
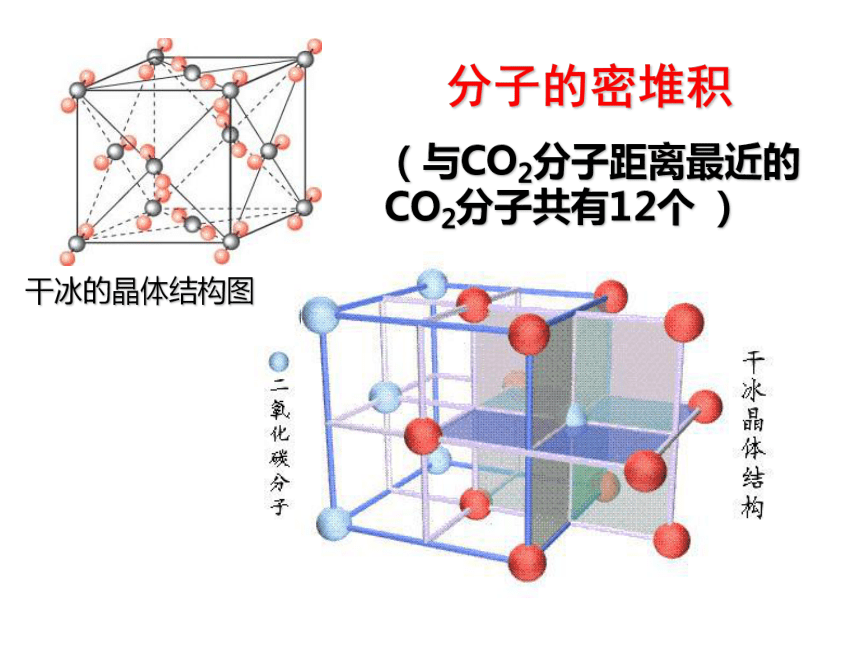
分子的密堆积
氧(O2)的晶体结构
碳60的晶胞
分子的密堆积
(与CO2分子距离最近的CO2分子共有12个 )
干冰的晶体结构图
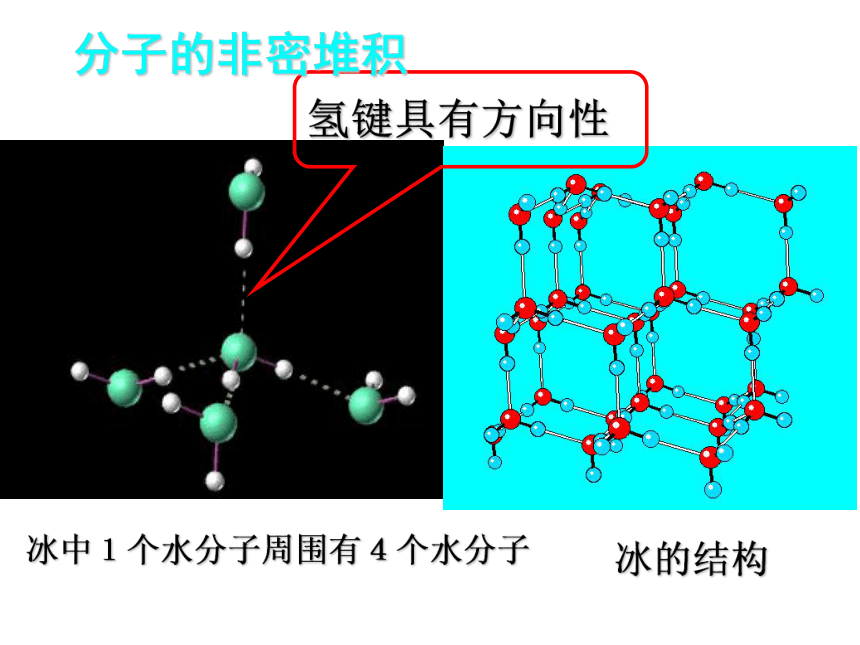
冰中1个水分子周围有4个水分子
冰的结构
氢键具有方向性
分子的非密堆积
6、分子晶体结构特征
(1)密堆积
有分子间氢键——氢键具有方向性,使晶体中的空间利率不高,留有相当大的空隙.这种晶体不具有分子密堆积特征。如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)。
(2)非密堆积
只有范德华力,无分子间氢键——分子密堆积。这类晶体每个分子周围一般有12个紧邻的分子,如:C60、干冰 、I2、O2。
了解
小结:
1、分子晶体:由分子构成。相邻分子靠分子间作用力相互吸引。
2、分子晶体特点:低熔点、升华、硬度很小等。
3、常见分子晶体分类:(1)所有非金属氢化物 (2)部分非金属单质, (3)部分非金属氧化物(4)几乎所有的酸(而碱和盐则是离子晶体 (5)绝大多数有机物的晶体。
结构特征
(1)只有范德华力,无分子间氢键-分子密堆积(每个分子周围有12个紧邻的分子,如:C60、干冰 、I2、O2
(2)有分子间氢键-不具有分子密堆积特征
(如:HF 、冰、NH3 )
练习:
下列属于分子晶体的一组物质是( )
A、CaO、NO、CO
B、CCl4、H2 O2、He
C、CO2、SO2、NaCl
D、CH4、O2、Na2 O
B
二、原子晶体
1、定义:原子间以共价键相结合而形成的空间网状结构的晶体。
2、构成微粒:
3、微粒之间的作用:
4、气化或熔化时破坏的作用力:
5、物理性质:
熔沸点高,硬度大,难溶于一般溶剂。 (共价键键能越大,熔沸点越高,硬度越大)
原子
共价键
共价键
掌握
6、常见原子晶体
(1)某些单质:硼(B)、硅(Si)、锗(Ge)、金刚石(C)等
(2)某些非金属化合物:SiC、BN等
(3)某些氧化物:SiO2等
109?28?
共价键
练习
1、金刚石(晶体硅结构与此类似)
(1)由图中观察可知:每个碳原子被相邻的4个碳原子包围,以共价键跟4个碳原子接合,形成四面体。这些四面体向空间发展,构成一个坚实的、彼此联结的空间网状晶体。每个 C-C键长相等,键角均为109。28`。
(2)晶体中最小环由____个C组成且不共面。
6
(3)晶体中C原子数与C-C 键数之比为:
1:2
SiO2的结构特征:在SiO2晶体中
①1个Si原子和4个O原子形成4个共价键,每个Si原子周围结合4个O原子;同时,每个O原子跟2个Si原子相结合。实际上,SiO2晶体是由Si原子和O原子按1:2的比例所组成的立体网状的晶体。②最小的碳环是由6个Si原子和6个O原子组成的12元环。
③1mol SiO2中含4mol Si—O键
1、怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
2.“具有共价键的晶体叫做原子晶体”。这种说法对吗?为什么?
探究思考
小结1:分子晶体与原子晶体的比较
相邻原子间以共价键相结合而形成空间网状结构
分子间以分子间作用力结合
原子
分子
共价键
分子间作用力
很大
较小
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔化状态都不导电,部分溶于水导电
晶体类型 原子晶体 分子晶体
概念
组成微粒
作用力
熔沸点
硬度
溶解性
导电性
石墨晶体结构
知识拓展-石墨
石墨
1、石墨为什么很软?
2、石墨的熔沸点为什么很高(高于金刚石)?
3、石墨属于哪类晶体?为什么?
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
石墨为混合晶体。
例、如右图所示,在石墨晶体的层状结构中,每一个最小的碳环完全拥有碳原子数为___,每个C完全拥有C-C数为___
石墨中C-C夹角为120☉, C-C键长为 1.42×10-10 m层间距
3.35× 10-10 m
2
3∕2
1、下列物质属于分子晶体的化合物是( )
A、石英 B、硫磺 C、干冰 D、食盐
C
练习
2、干冰气化时,下列所述内容发生变化的是
A、分子内共价键 B、分子间作用力
C、分子间距离 D、分子间的氢键
BC
3、冰醋酸固体中不存在的作用力是( )
A、离子键 B、极性键
C、非极性键 D、范德华力
A
4、水分子间存在着氢键的作用,使水分子彼此结合而成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构如图:试分析:
①1mol 冰中有 mol氢键?
②H2O的熔沸点比H2S高还是低?为什么?
③已知氢键也有方向性,试分析为什么冬季河水总是从水面上开始结冰?
2
氢键
由于氢键的方向性,使冰晶体中每个水分子与四面体顶点的4个分子相互吸引,形成空隙较大的网状体,密度比水小,所以结的冰会浮在水面上
第二节 分子晶体
碘晶体结构
干冰晶体结构
观察与思考: 下列两种晶体有什么共同点?
NaCl晶体结构
一、分子晶体
2、组成微粒:
分子
3、粒子间作用力:
分子内原子间以共价键结合,相邻分子间靠分子间作用力或氢键相互吸引
记住
结合表格和已有知识,分析:分子晶体有哪些物理特性?为什么?
原因:分子间作用力较弱
4、物理特性:
(1)较低的熔点和沸点,易升华;
(3)一般都是绝缘体,熔融状态也不导电。有些在水溶液中可以导电.
(2)较小的硬度;
注:①分子间作用力越大,熔沸点越高 ② 分子晶体熔化时一般只破坏分子间作用力,不破坏化学键,
掌握特性及原因
5、典型的分子晶体:
(1)所有非金属氢化物:H2O,H2S,NH3, CH4,HX
(2)部分非金属单质:X2,O2,H2, S8, P4, C60
(3)部分非金属氧化物: CO2, SO2, NO2,
P4O6, P4O10
(4)几乎所有的酸:H2SO4,HNO3,H3PO4
(5)绝大多数有机物的晶体:乙醇,冰醋酸, 蔗糖
分子的密堆积
氧(O2)的晶体结构
碳60的晶胞
分子的密堆积
(与CO2分子距离最近的CO2分子共有12个 )
干冰的晶体结构图
冰中1个水分子周围有4个水分子
冰的结构
氢键具有方向性
分子的非密堆积
6、分子晶体结构特征
(1)密堆积
有分子间氢键——氢键具有方向性,使晶体中的空间利率不高,留有相当大的空隙.这种晶体不具有分子密堆积特征。如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)。
(2)非密堆积
只有范德华力,无分子间氢键——分子密堆积。这类晶体每个分子周围一般有12个紧邻的分子,如:C60、干冰 、I2、O2。
了解
小结:
1、分子晶体:由分子构成。相邻分子靠分子间作用力相互吸引。
2、分子晶体特点:低熔点、升华、硬度很小等。
3、常见分子晶体分类:(1)所有非金属氢化物 (2)部分非金属单质, (3)部分非金属氧化物(4)几乎所有的酸(而碱和盐则是离子晶体 (5)绝大多数有机物的晶体。
结构特征
(1)只有范德华力,无分子间氢键-分子密堆积(每个分子周围有12个紧邻的分子,如:C60、干冰 、I2、O2
(2)有分子间氢键-不具有分子密堆积特征
(如:HF 、冰、NH3 )
练习:
下列属于分子晶体的一组物质是( )
A、CaO、NO、CO
B、CCl4、H2 O2、He
C、CO2、SO2、NaCl
D、CH4、O2、Na2 O
B
二、原子晶体
1、定义:原子间以共价键相结合而形成的空间网状结构的晶体。
2、构成微粒:
3、微粒之间的作用:
4、气化或熔化时破坏的作用力:
5、物理性质:
熔沸点高,硬度大,难溶于一般溶剂。 (共价键键能越大,熔沸点越高,硬度越大)
原子
共价键
共价键
掌握
6、常见原子晶体
(1)某些单质:硼(B)、硅(Si)、锗(Ge)、金刚石(C)等
(2)某些非金属化合物:SiC、BN等
(3)某些氧化物:SiO2等
109?28?
共价键
练习
1、金刚石(晶体硅结构与此类似)
(1)由图中观察可知:每个碳原子被相邻的4个碳原子包围,以共价键跟4个碳原子接合,形成四面体。这些四面体向空间发展,构成一个坚实的、彼此联结的空间网状晶体。每个 C-C键长相等,键角均为109。28`。
(2)晶体中最小环由____个C组成且不共面。
6
(3)晶体中C原子数与C-C 键数之比为:
1:2
SiO2的结构特征:在SiO2晶体中
①1个Si原子和4个O原子形成4个共价键,每个Si原子周围结合4个O原子;同时,每个O原子跟2个Si原子相结合。实际上,SiO2晶体是由Si原子和O原子按1:2的比例所组成的立体网状的晶体。②最小的碳环是由6个Si原子和6个O原子组成的12元环。
③1mol SiO2中含4mol Si—O键
1、怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
2.“具有共价键的晶体叫做原子晶体”。这种说法对吗?为什么?
探究思考
小结1:分子晶体与原子晶体的比较
相邻原子间以共价键相结合而形成空间网状结构
分子间以分子间作用力结合
原子
分子
共价键
分子间作用力
很大
较小
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔化状态都不导电,部分溶于水导电
晶体类型 原子晶体 分子晶体
概念
组成微粒
作用力
熔沸点
硬度
溶解性
导电性
石墨晶体结构
知识拓展-石墨
石墨
1、石墨为什么很软?
2、石墨的熔沸点为什么很高(高于金刚石)?
3、石墨属于哪类晶体?为什么?
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
石墨为混合晶体。
例、如右图所示,在石墨晶体的层状结构中,每一个最小的碳环完全拥有碳原子数为___,每个C完全拥有C-C数为___
石墨中C-C夹角为120☉, C-C键长为 1.42×10-10 m层间距
3.35× 10-10 m
2
3∕2
1、下列物质属于分子晶体的化合物是( )
A、石英 B、硫磺 C、干冰 D、食盐
C
练习
2、干冰气化时,下列所述内容发生变化的是
A、分子内共价键 B、分子间作用力
C、分子间距离 D、分子间的氢键
BC
3、冰醋酸固体中不存在的作用力是( )
A、离子键 B、极性键
C、非极性键 D、范德华力
A
4、水分子间存在着氢键的作用,使水分子彼此结合而成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构如图:试分析:
①1mol 冰中有 mol氢键?
②H2O的熔沸点比H2S高还是低?为什么?
③已知氢键也有方向性,试分析为什么冬季河水总是从水面上开始结冰?
2
氢键
由于氢键的方向性,使冰晶体中每个水分子与四面体顶点的4个分子相互吸引,形成空隙较大的网状体,密度比水小,所以结的冰会浮在水面上
