人教化学选修3第三章第四节 离子晶体(共16张PPT)
文档属性
| 名称 | 人教化学选修3第三章第四节 离子晶体(共16张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-13 10:08:35 | ||
图片预览




文档简介
(共16张PPT)
第四节 离子晶体
学习目标:
1.掌握离子晶体的概念,能识别氯化钠、氯化铯、氟化钙的晶胞结构。
2..通过探究知道离子晶体的配位数与离子半径比的关系。
1.离子晶体 定义:
由阳离子和阴离子通过离子键结合而成的晶体
离子晶体
2.晶体中存在的微粒
3.微粒间的相互作用
4.离子晶体的物理性质
熔沸点较高,硬度较大,固态时不导电,熔融状态才导电
氯化钠晶体
粉末状氯化钠
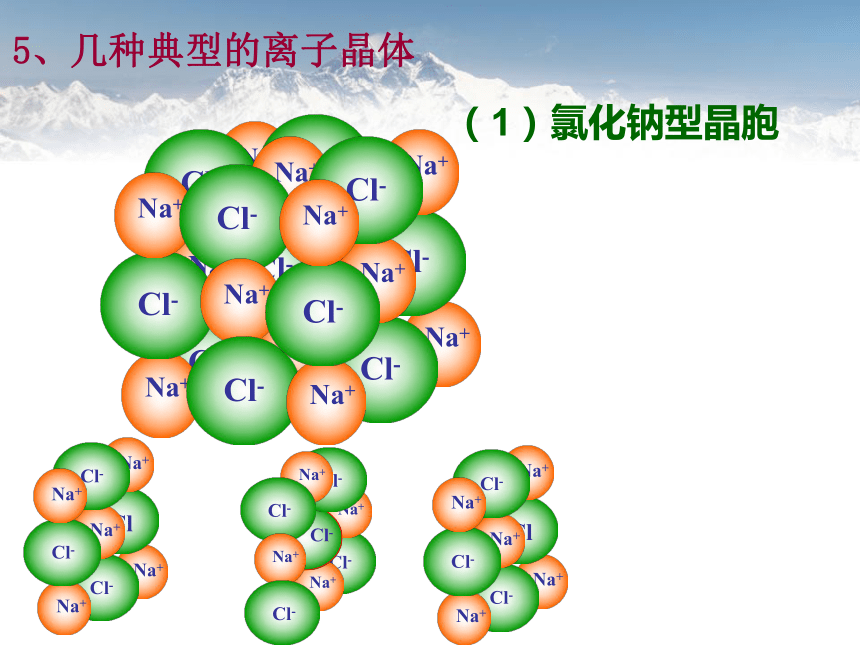
(1)氯化钠型晶胞
5、几种典型的离子晶体
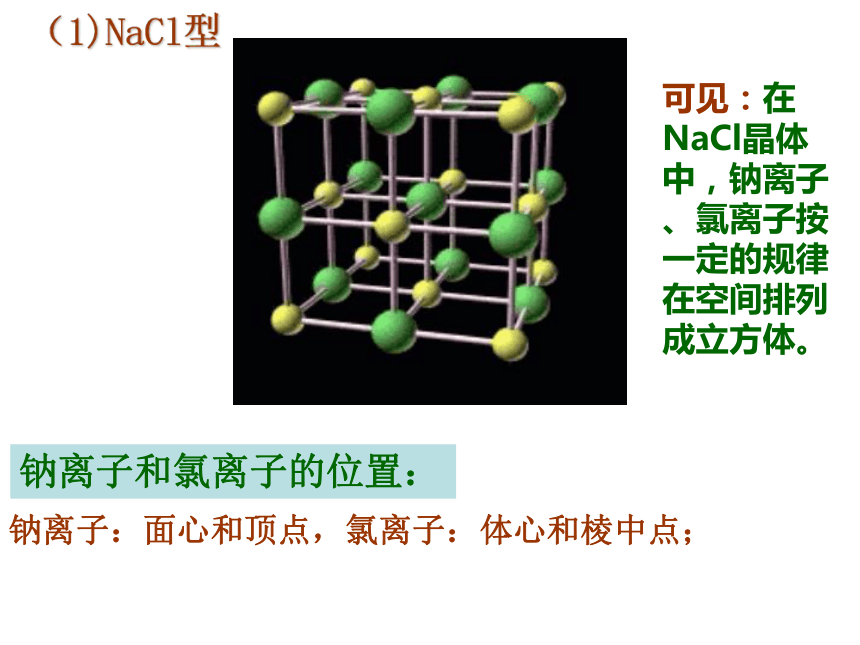
(1)NaCl型
钠离子和氯离子的位置:
钠离子:面心和顶点,氯离子:体心和棱中点;
可见:在NaCl晶体中,钠离子、氯离子按一定的规律在空间排列成立方体。
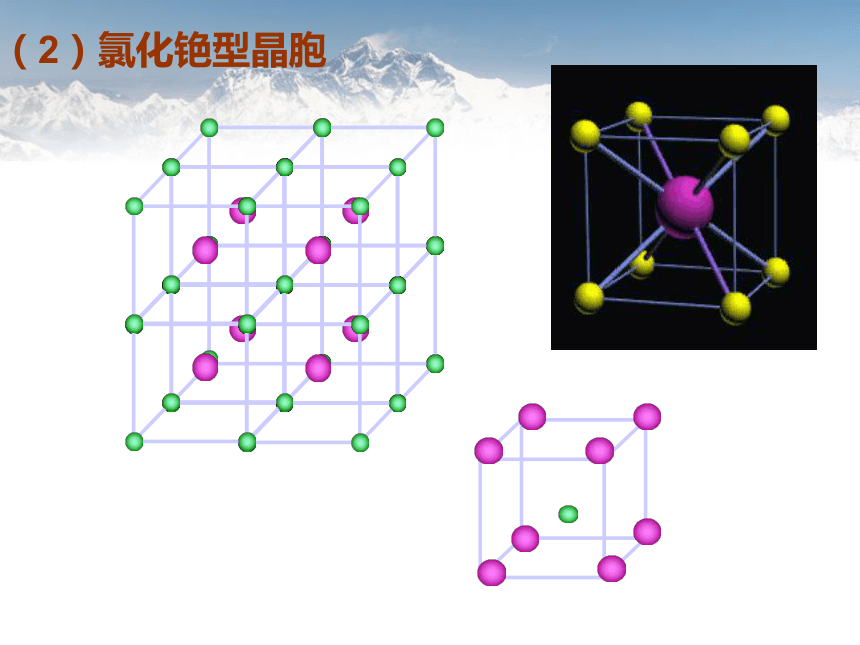
(2)氯化铯型晶胞
(1)NaCl型
科学探究(一):
找出CsCl、NaCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?
6
6
8
8
为什么它们的配位数不同呢?
离子晶体 阴离子的配位数 阳离子的配位数
NaCl
CsCl
科学探究(二):
你认为是什么因素决定了离子晶体中离子的配位数?根据表3—5、表3—6分析影响离子晶体中离子配位数的因素。
0.525
0.934
NaCl.CsCl中正负离子半径比
晶体中离子的半径
决定离子晶体结构(即配位数)的因素
离子 Na+ Cs+ Cl-
离子半径/pm 95 169 181
NaCl CsCl
r+/r- = r+/r- =
C.N.=6 C.N.=8
决定离子晶体结构(即配位数)的因素
A.晶体中正负离子的的半径比(r+/r- )是决定离子晶体结构的重要因素,简称几何因素。
思考:
CaF2的晶胞
是否所有离子晶体的阴阳离子的配位数都相同呢?
Ca2+
F-
1个CaF2的晶胞中,Ca2+的数为_____和F-数为_____
4
8
Ca2+
F-
图示为CaF2晶胞的1/8,观察点为上左前方
晶胞面心上
CaF2的晶体中,Ca2+和F-的个数之比____,电荷数之比_____,Ca2+配位数是_____,F-的配位数是_______。
1:2
2:1
8
4
晶体中正负离子的电荷比也是决定离子晶体结构的重要因素即电荷因素
6.决定离子晶体结构(即配位数)的因素
B.晶体中正负离子的电荷比也是决定离子晶体结构的重要因素即电荷因素
C.离子晶体的结构类型还与离子键的纯粹程度(简称键性因素),即与晶体中正负离子的相互极化程度有关。
A.晶体中正负离子的的半径比(r+/r- )是决定离子晶体结构的重要因素,简称几何因素。
小结
1.根据离子晶体的晶胞结构,判断下列离子
晶体的化学式:(A表示阳离子)
A
B
化学式:
AB
2. 写出下列离子晶体的化学式
Y
X
Ca
O
Ti
该晶体的化学式为
XY2(或Y2X)
该晶体的化学式为
CaTiO3
第四节 离子晶体
学习目标:
1.掌握离子晶体的概念,能识别氯化钠、氯化铯、氟化钙的晶胞结构。
2..通过探究知道离子晶体的配位数与离子半径比的关系。
1.离子晶体 定义:
由阳离子和阴离子通过离子键结合而成的晶体
离子晶体
2.晶体中存在的微粒
3.微粒间的相互作用
4.离子晶体的物理性质
熔沸点较高,硬度较大,固态时不导电,熔融状态才导电
氯化钠晶体
粉末状氯化钠
(1)氯化钠型晶胞
5、几种典型的离子晶体
(1)NaCl型
钠离子和氯离子的位置:
钠离子:面心和顶点,氯离子:体心和棱中点;
可见:在NaCl晶体中,钠离子、氯离子按一定的规律在空间排列成立方体。
(2)氯化铯型晶胞
(1)NaCl型
科学探究(一):
找出CsCl、NaCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?
6
6
8
8
为什么它们的配位数不同呢?
离子晶体 阴离子的配位数 阳离子的配位数
NaCl
CsCl
科学探究(二):
你认为是什么因素决定了离子晶体中离子的配位数?根据表3—5、表3—6分析影响离子晶体中离子配位数的因素。
0.525
0.934
NaCl.CsCl中正负离子半径比
晶体中离子的半径
决定离子晶体结构(即配位数)的因素
离子 Na+ Cs+ Cl-
离子半径/pm 95 169 181
NaCl CsCl
r+/r- = r+/r- =
C.N.=6 C.N.=8
决定离子晶体结构(即配位数)的因素
A.晶体中正负离子的的半径比(r+/r- )是决定离子晶体结构的重要因素,简称几何因素。
思考:
CaF2的晶胞
是否所有离子晶体的阴阳离子的配位数都相同呢?
Ca2+
F-
1个CaF2的晶胞中,Ca2+的数为_____和F-数为_____
4
8
Ca2+
F-
图示为CaF2晶胞的1/8,观察点为上左前方
晶胞面心上
CaF2的晶体中,Ca2+和F-的个数之比____,电荷数之比_____,Ca2+配位数是_____,F-的配位数是_______。
1:2
2:1
8
4
晶体中正负离子的电荷比也是决定离子晶体结构的重要因素即电荷因素
6.决定离子晶体结构(即配位数)的因素
B.晶体中正负离子的电荷比也是决定离子晶体结构的重要因素即电荷因素
C.离子晶体的结构类型还与离子键的纯粹程度(简称键性因素),即与晶体中正负离子的相互极化程度有关。
A.晶体中正负离子的的半径比(r+/r- )是决定离子晶体结构的重要因素,简称几何因素。
小结
1.根据离子晶体的晶胞结构,判断下列离子
晶体的化学式:(A表示阳离子)
A
B
化学式:
AB
2. 写出下列离子晶体的化学式
Y
X
Ca
O
Ti
该晶体的化学式为
XY2(或Y2X)
该晶体的化学式为
CaTiO3
