人教化学选修3第三章复习(共19张PPT)
文档属性
| 名称 | 人教化学选修3第三章复习(共19张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-13 15:10:04 | ||
图片预览




文档简介
(共19张PPT)
《物质结构与性质》
-归纳与整理
本节课复习内容:
1、各晶体晶胞中微粒间的距离与晶胞
边长的关系。
2、晶胞边长与原子半径的关系以及密
度的相关计算。
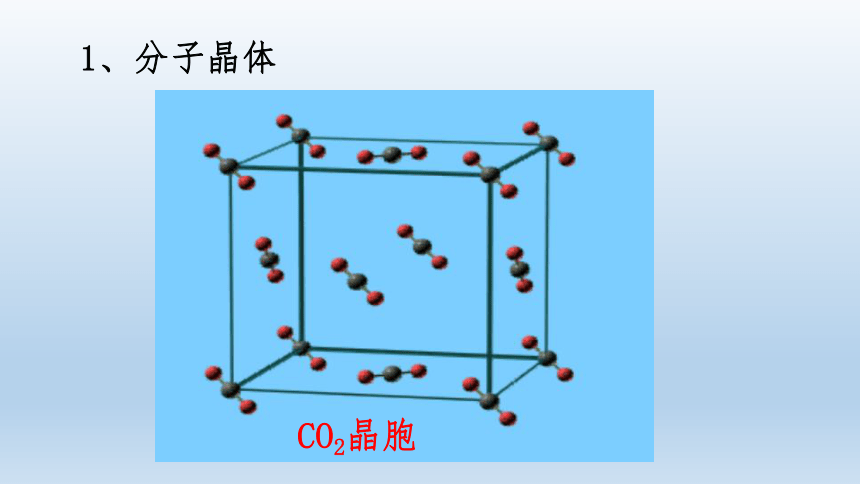
1、分子晶体
(1)二氧化碳分子的位置:
二氧化碳分子位于:面心和顶点
(2)每个晶胞含二氧化碳分子的个数
二氧化碳分子的个数: 4 个
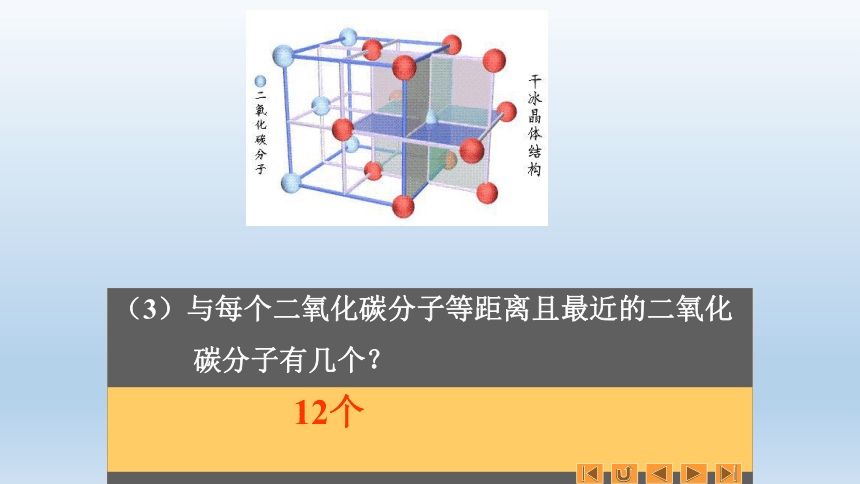
(3)与每个二氧化碳分子等距离且最近的二氧化
碳分子有几个?
12个
若分子间只有范德华力,则它们的配位数均为12,与CO2具有相似的晶体结构。比如O2、C60等。
分子晶体结构特点:
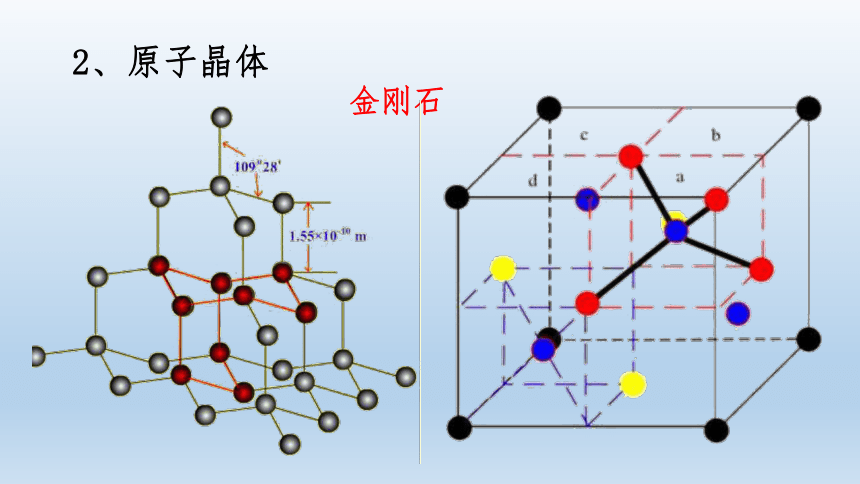
2、原子晶体
SiO2
问题:
1、在金刚石晶体中C:C-C =
2、在SiO2晶体中Si:Si-O =
1:2
1:4
石墨晶体
3、在石墨晶体中C:C-C =
2:3
例题:Si(s) + O2(g) = SiO2(s);ΔH = ?
已知:Si-Si为a KJ/mol;O=O为b KJ/mol;
Si-O为c KJ/mol,求该反应的ΔH。
ΔH=(2a+b-4c) KJ/mol
3、离子晶体
NaCl晶体中Na+和Cl-的配位数均为6
CsCl晶体中Cs+和Cl-的配位数均为8
晶胞边长为a pm
A
B
距离最近的Zn2+、S2-为图中A、B的距离,为 pm
晶胞边长为a pm
例题:有一种具有储氢功能的铜金合金晶体,具有面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,氢原子可进入晶胞的空隙中,若将Cu和Au原子等同看待,该晶体储氢后的晶胞结构与CaF2晶胞结构相似,该晶体储氢后的化学式为__________。
Cu3AuH8
4、金属晶体
堆积模型 典型代表 空间利用率 配位数 晶胞
简单立方堆积 Po(钋) 52% 6
体心立方堆积 Na、K、Fe(钾型) 68% 8
面心立方最密堆积 Zn、Mg、Ti(镁型) 74% 12
六方最密堆积 Cu、Ag、Au(铜型) 74% 12
★ 体心立方堆积
A
B
C
→
→
面心立方最密堆积
关于晶体密度的有关计算
注:M-晶胞微粒的摩尔质量;N-晶胞中所含该微粒的个数;a-晶胞的边长
单位的换算:
1pm = 10-12m = 10-10cm
1nm = 10-9m = 10-7cm
晶体密度的练习:
1、铈晶体为面心立方堆积,其晶胞参数为a pm,摩尔质量
为Mg/mol,NA为阿伏伽德罗常数,求①铈原子半径r=?
cm;②密度为?g/cm3。
2、已知金属钾为体心立方最密堆积,摩尔质量为Mg/mol,其
原子半径为r pm,NA为阿伏伽德罗常数。
求密度ρ为多少g/cm3?。
谢谢!本节课到此结束,如还没有听过瘾,欢迎来307或308班,我等你。也可以加我QQ:54874549相互交流。
《物质结构与性质》
-归纳与整理
本节课复习内容:
1、各晶体晶胞中微粒间的距离与晶胞
边长的关系。
2、晶胞边长与原子半径的关系以及密
度的相关计算。
1、分子晶体
(1)二氧化碳分子的位置:
二氧化碳分子位于:面心和顶点
(2)每个晶胞含二氧化碳分子的个数
二氧化碳分子的个数: 4 个
(3)与每个二氧化碳分子等距离且最近的二氧化
碳分子有几个?
12个
若分子间只有范德华力,则它们的配位数均为12,与CO2具有相似的晶体结构。比如O2、C60等。
分子晶体结构特点:
2、原子晶体
SiO2
问题:
1、在金刚石晶体中C:C-C =
2、在SiO2晶体中Si:Si-O =
1:2
1:4
石墨晶体
3、在石墨晶体中C:C-C =
2:3
例题:Si(s) + O2(g) = SiO2(s);ΔH = ?
已知:Si-Si为a KJ/mol;O=O为b KJ/mol;
Si-O为c KJ/mol,求该反应的ΔH。
ΔH=(2a+b-4c) KJ/mol
3、离子晶体
NaCl晶体中Na+和Cl-的配位数均为6
CsCl晶体中Cs+和Cl-的配位数均为8
晶胞边长为a pm
A
B
距离最近的Zn2+、S2-为图中A、B的距离,为 pm
晶胞边长为a pm
例题:有一种具有储氢功能的铜金合金晶体,具有面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,氢原子可进入晶胞的空隙中,若将Cu和Au原子等同看待,该晶体储氢后的晶胞结构与CaF2晶胞结构相似,该晶体储氢后的化学式为__________。
Cu3AuH8
4、金属晶体
堆积模型 典型代表 空间利用率 配位数 晶胞
简单立方堆积 Po(钋) 52% 6
体心立方堆积 Na、K、Fe(钾型) 68% 8
面心立方最密堆积 Zn、Mg、Ti(镁型) 74% 12
六方最密堆积 Cu、Ag、Au(铜型) 74% 12
★ 体心立方堆积
A
B
C
→
→
面心立方最密堆积
关于晶体密度的有关计算
注:M-晶胞微粒的摩尔质量;N-晶胞中所含该微粒的个数;a-晶胞的边长
单位的换算:
1pm = 10-12m = 10-10cm
1nm = 10-9m = 10-7cm
晶体密度的练习:
1、铈晶体为面心立方堆积,其晶胞参数为a pm,摩尔质量
为Mg/mol,NA为阿伏伽德罗常数,求①铈原子半径r=?
cm;②密度为?g/cm3。
2、已知金属钾为体心立方最密堆积,摩尔质量为Mg/mol,其
原子半径为r pm,NA为阿伏伽德罗常数。
求密度ρ为多少g/cm3?。
谢谢!本节课到此结束,如还没有听过瘾,欢迎来307或308班,我等你。也可以加我QQ:54874549相互交流。
