人教化学选修3第三章第2节分子晶体和原子晶体第1课时(共26张PPT)
文档属性
| 名称 | 人教化学选修3第三章第2节分子晶体和原子晶体第1课时(共26张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-14 09:23:34 | ||
图片预览







文档简介
(共26张PPT)
第二节 分子晶体和原子晶体
第一课时 分子晶体
分子晶体
自主学习:
一、分子晶体
1、概念:分子间以分子间作用力(范德华力,氢
键)相结合的晶体叫分子晶体。
2、构成粒子:
分子(构成分子的原子间以共价键结合)。
3、构成粒子间的相互作用:分子间作用力。
4、气化或熔化时破坏的作用力:分子间作用力。
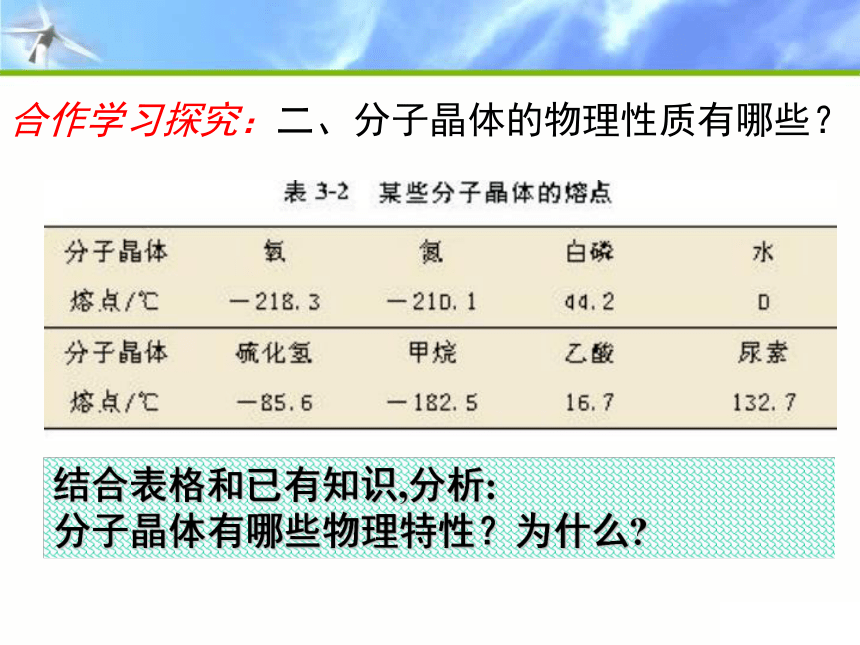
结合表格和已有知识,分析:
分子晶体有哪些物理特性?为什么?
合作学习探究:二、分子晶体的物理性质有哪些?
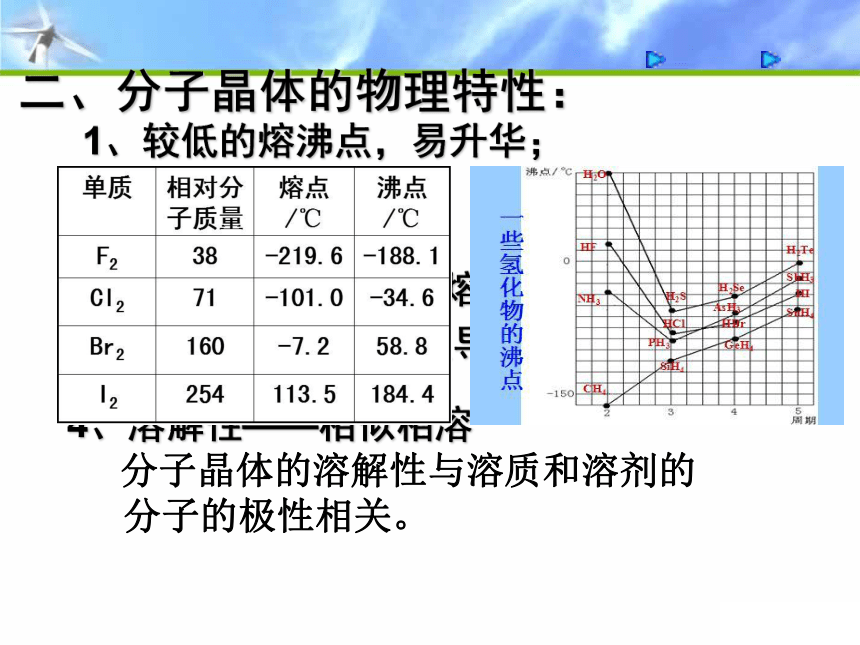
二、分子晶体的物理特性:
1、较低的熔沸点,易升华;
3、一般都是绝缘体,熔融状态也不导电,
有些在水溶液中可以导电。
2、较小的硬度;
4、溶解性——相似相溶
分子晶体的溶解性与溶质和溶剂的
分子的极性相关。
练习:下列属于分子晶体的性质的是( )
A、熔点1070℃,易溶于水,水溶液能导电
B、能溶于CS2,熔点112.8 ℃ ,沸点444.6 ℃
C、熔点1400 ℃ ,可做半导体材料,难溶于水
D、熔点97.81 ℃ ,质软,导电,密度
0.97g/cm3
B
合作学习探究: 三、典型的分子晶体有哪些?
三、典型的分子晶体:
1、所有非金属氢化物:如水、硫化氢、氨、
氯化氢、甲烷等
2、部分非金属单质: 如卤素(X2)、氧(O2)、硫(S8)、
氮(N2)、白磷(P4)、碳60(C60)、
稀有气体等
3、部分非金属氧化物: 如CO2、 SO2、 NO2、P4O6、
P4O10等
4、所有的酸:如H2SO4、HNO3、H3PO4、H2SiO3、
H2SO3等
5、绝大多数有机物:如苯、乙醇、冰醋酸、蔗糖等
练习:下列属于分子晶体的一组物质是( )
A、CaO、NO、乙醇
B、CCl4、H2 O2、He
C、CO2、HNO3、NaCl
D、CH4、O2、Na2 O
B
合作学习探究:干冰和冰晶体的结构特点
1、构成干冰晶体的微粒是什么?微粒间的作用力是什么?
2、从结构模型看,干冰属于哪种晶胞类型?
3、每个CO2分子周围有几个等距近邻的CO2分子?
CO2分子 范德华力
面心立方
CO2 分子:
干冰晶体结构分析图
(与CO2分子距离最近的
CO2分子共有12个 )
合作学习探究:干冰和冰晶体的结构特点
1、构成冰晶体的结构微粒是什么?
2、微粒间的相互作用力是什么?
3、每个H2O分子与几个相邻水分子相互结合?呈现什么结构?
水分子
范德华力和氢键
四、分子晶体结构特征
1、密堆积
只有范德华力,无分子间氢键——分子密堆积。这类晶体每个分子周围一般有12个紧邻的分子,如:C60、干冰 、I2、O2。
2、非密堆积
有分子间氢键——氢键具有方向性,使晶体中的空间利率不高,留有相当大的空隙.这种晶体不具有分子密堆积特征。如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)。
碘的晶胞结构图
练习:每个碘分子周围有 个碘分子
12
练习:HF分子晶体、NH3分子晶体与冰的结
构极为相似,在HF分子晶体中,与F原子
距离最近的HF分子有几个( )
A.3 B.4 C.5 D.6
B
解释现象:(1)为什么冰的密度比水的小?
(2)为什么水4。C时密度最大?
5、分子晶体熔、沸点高低的比较规律
比较以下物质的熔沸点:
(1) HBr HI CH3COOH CH3CH2OH
(2) H2O H2S HF HCl
(3)
(4)N2 CO
合作学习探究点:分子晶体熔沸点的比较
5、分子晶体熔、沸点高低的比较规律
(1)组成和结构相似的物质,相对分子量越
大,熔沸点越高
(2)分子间有氢键的物质熔、沸点反常增大。
(3)分子内氢键的物质,其熔、沸点低于形成分
子间氢键的物质。
(4) 相对分子质量相近的(组成和结构不相似的)
物质极性越大,熔沸点越高
(5)在烷烃的同分异构体中,一般来说,支链数越多,______________。如沸点:正戊烷 > 异戊烷 > 新戊烷;芳香烃及其衍生物苯环上的同分异构体一般按照“____________________”的顺序。
熔沸点越低
邻位 > 间位 > 对位
【重点内容】:
1、分子晶体:由分子构成。相邻分子靠分子间作用力相
互吸引。
2、分子晶体的物理特点:低熔点、升华、硬度很小等。
3、常见分子晶体分类:
(1)所有非金属氢化物
(2)部分非金属单质
(3)部分非金属氧化物
(4)几乎所有的酸
(5)绝大多数有机物的晶体
4、晶体分子结构特征:
(1)只有范德华力,无分子间氢键-分子密堆积。
(2)有分子间氢键-不具有分子密堆积特征。
1、下列有关分子晶体的说法正确的是 ( )
A、分子内均存在共价键
B、分子内一定存在氢键
C、晶体结构一定为分子密堆积
D、晶体熔化时一定破坏分子间作用力
D
课堂检测
2、科学家应用电子计算机模拟出类似C60的物质N60,试推测下列说法正确的是______
① N60是一种新型的化合物;
② N60和N2都是同一类型的晶体;
③ N60中含有离子键;
④ N60的相对分子质量是840g;
⑤ 在N60晶体中,每个N60 周围有12个紧
邻的N60 分子;
② ⑤
3.右图为冰晶体的结构模型,大球代表O原子
小球代表H原子。下列有关说法正确的是( )
A.冰晶体中每个水分子与另外四个水分子形
成四面体
B.水分子之间只存在氢键
C.水分子间通过H-O键形成冰晶体
D.冰晶体熔化时,水分子之间的空隙增大
A
一、书面作业:
1、课本P72页:第4、7 题
2、能力提升
二、预习任务:
原子晶体
作 业 布 置
祝同学们学习进步,
天天有个好心情。
第二节 分子晶体和原子晶体
第一课时 分子晶体
分子晶体
自主学习:
一、分子晶体
1、概念:分子间以分子间作用力(范德华力,氢
键)相结合的晶体叫分子晶体。
2、构成粒子:
分子(构成分子的原子间以共价键结合)。
3、构成粒子间的相互作用:分子间作用力。
4、气化或熔化时破坏的作用力:分子间作用力。
结合表格和已有知识,分析:
分子晶体有哪些物理特性?为什么?
合作学习探究:二、分子晶体的物理性质有哪些?
二、分子晶体的物理特性:
1、较低的熔沸点,易升华;
3、一般都是绝缘体,熔融状态也不导电,
有些在水溶液中可以导电。
2、较小的硬度;
4、溶解性——相似相溶
分子晶体的溶解性与溶质和溶剂的
分子的极性相关。
练习:下列属于分子晶体的性质的是( )
A、熔点1070℃,易溶于水,水溶液能导电
B、能溶于CS2,熔点112.8 ℃ ,沸点444.6 ℃
C、熔点1400 ℃ ,可做半导体材料,难溶于水
D、熔点97.81 ℃ ,质软,导电,密度
0.97g/cm3
B
合作学习探究: 三、典型的分子晶体有哪些?
三、典型的分子晶体:
1、所有非金属氢化物:如水、硫化氢、氨、
氯化氢、甲烷等
2、部分非金属单质: 如卤素(X2)、氧(O2)、硫(S8)、
氮(N2)、白磷(P4)、碳60(C60)、
稀有气体等
3、部分非金属氧化物: 如CO2、 SO2、 NO2、P4O6、
P4O10等
4、所有的酸:如H2SO4、HNO3、H3PO4、H2SiO3、
H2SO3等
5、绝大多数有机物:如苯、乙醇、冰醋酸、蔗糖等
练习:下列属于分子晶体的一组物质是( )
A、CaO、NO、乙醇
B、CCl4、H2 O2、He
C、CO2、HNO3、NaCl
D、CH4、O2、Na2 O
B
合作学习探究:干冰和冰晶体的结构特点
1、构成干冰晶体的微粒是什么?微粒间的作用力是什么?
2、从结构模型看,干冰属于哪种晶胞类型?
3、每个CO2分子周围有几个等距近邻的CO2分子?
CO2分子 范德华力
面心立方
CO2 分子:
干冰晶体结构分析图
(与CO2分子距离最近的
CO2分子共有12个 )
合作学习探究:干冰和冰晶体的结构特点
1、构成冰晶体的结构微粒是什么?
2、微粒间的相互作用力是什么?
3、每个H2O分子与几个相邻水分子相互结合?呈现什么结构?
水分子
范德华力和氢键
四、分子晶体结构特征
1、密堆积
只有范德华力,无分子间氢键——分子密堆积。这类晶体每个分子周围一般有12个紧邻的分子,如:C60、干冰 、I2、O2。
2、非密堆积
有分子间氢键——氢键具有方向性,使晶体中的空间利率不高,留有相当大的空隙.这种晶体不具有分子密堆积特征。如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)。
碘的晶胞结构图
练习:每个碘分子周围有 个碘分子
12
练习:HF分子晶体、NH3分子晶体与冰的结
构极为相似,在HF分子晶体中,与F原子
距离最近的HF分子有几个( )
A.3 B.4 C.5 D.6
B
解释现象:(1)为什么冰的密度比水的小?
(2)为什么水4。C时密度最大?
5、分子晶体熔、沸点高低的比较规律
比较以下物质的熔沸点:
(1) HBr HI CH3COOH CH3CH2OH
(2) H2O H2S HF HCl
(3)
(4)N2 CO
合作学习探究点:分子晶体熔沸点的比较
5、分子晶体熔、沸点高低的比较规律
(1)组成和结构相似的物质,相对分子量越
大,熔沸点越高
(2)分子间有氢键的物质熔、沸点反常增大。
(3)分子内氢键的物质,其熔、沸点低于形成分
子间氢键的物质。
(4) 相对分子质量相近的(组成和结构不相似的)
物质极性越大,熔沸点越高
(5)在烷烃的同分异构体中,一般来说,支链数越多,______________。如沸点:正戊烷 > 异戊烷 > 新戊烷;芳香烃及其衍生物苯环上的同分异构体一般按照“____________________”的顺序。
熔沸点越低
邻位 > 间位 > 对位
【重点内容】:
1、分子晶体:由分子构成。相邻分子靠分子间作用力相
互吸引。
2、分子晶体的物理特点:低熔点、升华、硬度很小等。
3、常见分子晶体分类:
(1)所有非金属氢化物
(2)部分非金属单质
(3)部分非金属氧化物
(4)几乎所有的酸
(5)绝大多数有机物的晶体
4、晶体分子结构特征:
(1)只有范德华力,无分子间氢键-分子密堆积。
(2)有分子间氢键-不具有分子密堆积特征。
1、下列有关分子晶体的说法正确的是 ( )
A、分子内均存在共价键
B、分子内一定存在氢键
C、晶体结构一定为分子密堆积
D、晶体熔化时一定破坏分子间作用力
D
课堂检测
2、科学家应用电子计算机模拟出类似C60的物质N60,试推测下列说法正确的是______
① N60是一种新型的化合物;
② N60和N2都是同一类型的晶体;
③ N60中含有离子键;
④ N60的相对分子质量是840g;
⑤ 在N60晶体中,每个N60 周围有12个紧
邻的N60 分子;
② ⑤
3.右图为冰晶体的结构模型,大球代表O原子
小球代表H原子。下列有关说法正确的是( )
A.冰晶体中每个水分子与另外四个水分子形
成四面体
B.水分子之间只存在氢键
C.水分子间通过H-O键形成冰晶体
D.冰晶体熔化时,水分子之间的空隙增大
A
一、书面作业:
1、课本P72页:第4、7 题
2、能力提升
二、预习任务:
原子晶体
作 业 布 置
祝同学们学习进步,
天天有个好心情。
