人教化学选修3第三章四种晶体类型的判断及其熔沸点的比较(共15张PPT)
文档属性
| 名称 | 人教化学选修3第三章四种晶体类型的判断及其熔沸点的比较(共15张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 707.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-14 08:55:55 | ||
图片预览






文档简介
(共15张PPT)
学习目标
1.掌握判断晶体类型的方法
2.掌握每种晶体熔沸点高低判断依据
3.了解判断晶体类型与晶体熔沸点高低判断的做题技巧
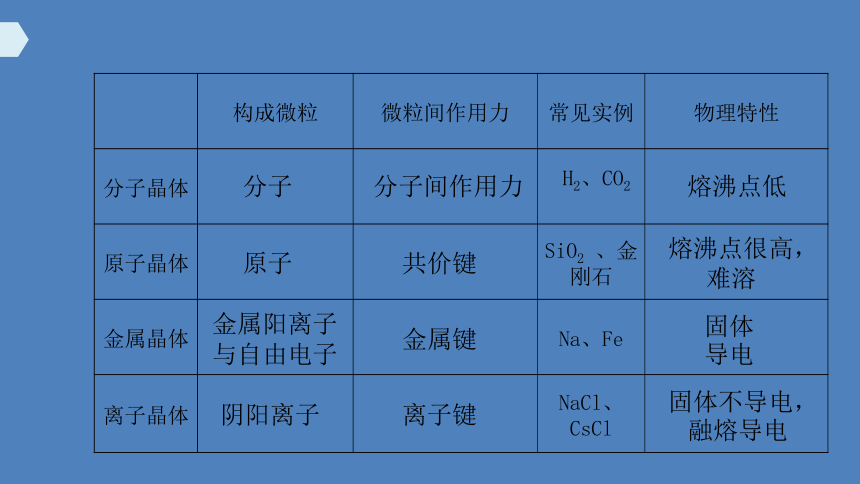
分子
原子
金属阳离子
与自由电子
阴阳离子
分子间作用力
共价键
离子键
金属键
熔沸点低
熔沸点很高, 难溶
固体导电
固体不导电,融熔导电
构成微粒 微粒间作用力 常见实例 物理特性
分子晶体 H2、CO2
原子晶体 SiO2 、金刚石
金属晶体 Na、Fe
离子晶体 NaCl、CsCl
先独立完成自测试题
时间:10min
自学自测
组内讨论
小组探究合作学习
组长认真组织讨论
时间:5min
展示规范三步曲:
1.我代表第X小组发言,……,请质疑。
2.质疑人举手,发言人指定质疑人。
3.质疑人发言。
谨记:声音洪亮,板演规范,动作紧凑。
1、把下列物质按要求分类
H2 Ne SiO2 CO2 SiC NaCl AlCl3 MgO SiBr4
Mg Pt 铝合金 CaF2 CH4 CH3COONa 苯 金刚石 石墨
金属晶体: ;
离子晶体: ;
原子晶体: ;
分子晶体: 。
总结判断晶体类型的规律:
Mg Pt 铝合金
NaCl MgO CaF2 CH3COONa
SiO2 SiC 金刚石
H2 Ne CO2 AlCl3 CH4 SiBr4 苯
金属晶体好识别,离子晶体也易辩,原子晶体记一记,剩下的就是分子晶体。
2、比较下列物质的熔沸点
(1)CO2 CS2 NH3 PH3 CO N2
总结规律: ;
(2)SiC 金刚石 SiC Si3N4
总结规律: ;
?组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高;
?具有分子间氢键的分子晶体熔沸点反常高;
?组成和结构相似的物质(相对分子质量相近),分子极性越大,其熔沸点越高。
原子半径越小→键长越短→键能越大→熔、沸点越高
<
>
>
<
<
(3)Na Mg Al Li Na K Fe Hg
总结规律: ;
(4)NaCl CsCl MgO BaO
总结规律: ;
(5)下列物质按沸点从大到小的顺序排列
CO2 H2O MgCl2 Na 金刚石 Si ;
总结规律: 。
<
>
>
一般地说,阴、阳离子的电荷数越多,离子半径越小,则晶体的晶格能就越大,其离子晶体的熔、沸点就越高。
>
>
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
金刚石 Si MgCl2 Na H2O CO2
原子晶体>离子晶体>分子晶体
<
>
当堂检测
1、D
2、A
3、C
4、B
1.下列物质所属晶体类型分类正确的是( )
2.下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
A.碘与干冰分别受热变为气体
B.硝酸铵与硝酸分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中
D.晶体钠与冰分别受热熔化
3.支持固体氨是分子晶体的事实是( )
A. 氮原子不能形成阳离子
B. 氮离子不能单独存在
C. 常温下氨是气态物质
D. 氨极易溶于水
4.下面的排序错误的是( )
A. 晶体熔点由高到低:MgO>H2O>NH3
B. 熔点由高到低:金刚石>铝合金>铝>钠
C. 硬度由大到小:金刚石>碳化硅>晶体硅 D. 沸点由高到低:HF>HI>HCl
5、在(NH4)2SO4、SiO2、CO2、HF、Na、Hg中,由极性键形成的非极性分子有 ,熔融态可以导电的有 ,能形成分子晶体的物质是 ,含有氢键的晶体的化学式是 ,属于离子晶体的是 ,属于原子晶体的是 ,五种物质的熔点由高到低的顺序是 。
课后作业
课后完成记忆清单内容,各组组长负责
学习目标
1.掌握判断晶体类型的方法
2.掌握每种晶体熔沸点高低判断依据
3.了解判断晶体类型与晶体熔沸点高低判断的做题技巧
分子
原子
金属阳离子
与自由电子
阴阳离子
分子间作用力
共价键
离子键
金属键
熔沸点低
熔沸点很高, 难溶
固体导电
固体不导电,融熔导电
构成微粒 微粒间作用力 常见实例 物理特性
分子晶体 H2、CO2
原子晶体 SiO2 、金刚石
金属晶体 Na、Fe
离子晶体 NaCl、CsCl
先独立完成自测试题
时间:10min
自学自测
组内讨论
小组探究合作学习
组长认真组织讨论
时间:5min
展示规范三步曲:
1.我代表第X小组发言,……,请质疑。
2.质疑人举手,发言人指定质疑人。
3.质疑人发言。
谨记:声音洪亮,板演规范,动作紧凑。
1、把下列物质按要求分类
H2 Ne SiO2 CO2 SiC NaCl AlCl3 MgO SiBr4
Mg Pt 铝合金 CaF2 CH4 CH3COONa 苯 金刚石 石墨
金属晶体: ;
离子晶体: ;
原子晶体: ;
分子晶体: 。
总结判断晶体类型的规律:
Mg Pt 铝合金
NaCl MgO CaF2 CH3COONa
SiO2 SiC 金刚石
H2 Ne CO2 AlCl3 CH4 SiBr4 苯
金属晶体好识别,离子晶体也易辩,原子晶体记一记,剩下的就是分子晶体。
2、比较下列物质的熔沸点
(1)CO2 CS2 NH3 PH3 CO N2
总结规律: ;
(2)SiC 金刚石 SiC Si3N4
总结规律: ;
?组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高;
?具有分子间氢键的分子晶体熔沸点反常高;
?组成和结构相似的物质(相对分子质量相近),分子极性越大,其熔沸点越高。
原子半径越小→键长越短→键能越大→熔、沸点越高
<
>
>
<
<
(3)Na Mg Al Li Na K Fe Hg
总结规律: ;
(4)NaCl CsCl MgO BaO
总结规律: ;
(5)下列物质按沸点从大到小的顺序排列
CO2 H2O MgCl2 Na 金刚石 Si ;
总结规律: 。
<
>
>
一般地说,阴、阳离子的电荷数越多,离子半径越小,则晶体的晶格能就越大,其离子晶体的熔、沸点就越高。
>
>
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
金刚石 Si MgCl2 Na H2O CO2
原子晶体>离子晶体>分子晶体
<
>
当堂检测
1、D
2、A
3、C
4、B
1.下列物质所属晶体类型分类正确的是( )
2.下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
A.碘与干冰分别受热变为气体
B.硝酸铵与硝酸分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中
D.晶体钠与冰分别受热熔化
3.支持固体氨是分子晶体的事实是( )
A. 氮原子不能形成阳离子
B. 氮离子不能单独存在
C. 常温下氨是气态物质
D. 氨极易溶于水
4.下面的排序错误的是( )
A. 晶体熔点由高到低:MgO>H2O>NH3
B. 熔点由高到低:金刚石>铝合金>铝>钠
C. 硬度由大到小:金刚石>碳化硅>晶体硅 D. 沸点由高到低:HF>HI>HCl
5、在(NH4)2SO4、SiO2、CO2、HF、Na、Hg中,由极性键形成的非极性分子有 ,熔融态可以导电的有 ,能形成分子晶体的物质是 ,含有氢键的晶体的化学式是 ,属于离子晶体的是 ,属于原子晶体的是 ,五种物质的熔点由高到低的顺序是 。
课后作业
课后完成记忆清单内容,各组组长负责
