人教版九年级下册化学 11.1 生活中常见的盐课件(共39张PPT)
文档属性
| 名称 | 人教版九年级下册化学 11.1 生活中常见的盐课件(共39张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-14 10:31:32 | ||
图片预览









文档简介
(共39张PPT)
第十一单元 盐 化肥
课题 1 生活中常见的盐
成份:氢氧化铝、碘甲基蛋氨酸等
3HCl + Al(OH)3 == AlCl3 + 3H2O
1、用化学方程式表示斯达舒治疗胃酸过多症的原理:
一、创设情境
2、实验室中的澄清石灰水保存时间长了以后,试剂瓶上会有一层白色固体,请用化学方程式表示其中的原因 ,你能用什么方法来清洗,请用化学方程式表示其中的原理 。
Ca(OH)2+CO2==CaCO3↓+H2O
CaCO3+2HCl=CaCl2+H2O+CO2↑
3、常见的盐
由金属离子和酸根离子构成的化合物。
盐的定义:
明矾晶体
KAl(SO4)2· 12H2O
五水硫酸铜晶体
CuSO4· 5H2O
食盐
NaCl
用钡餐观察
肠内情况
BaSO4
亚硝酸钠
?亚硝酸钠是工业用盐,形状很像食盐。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
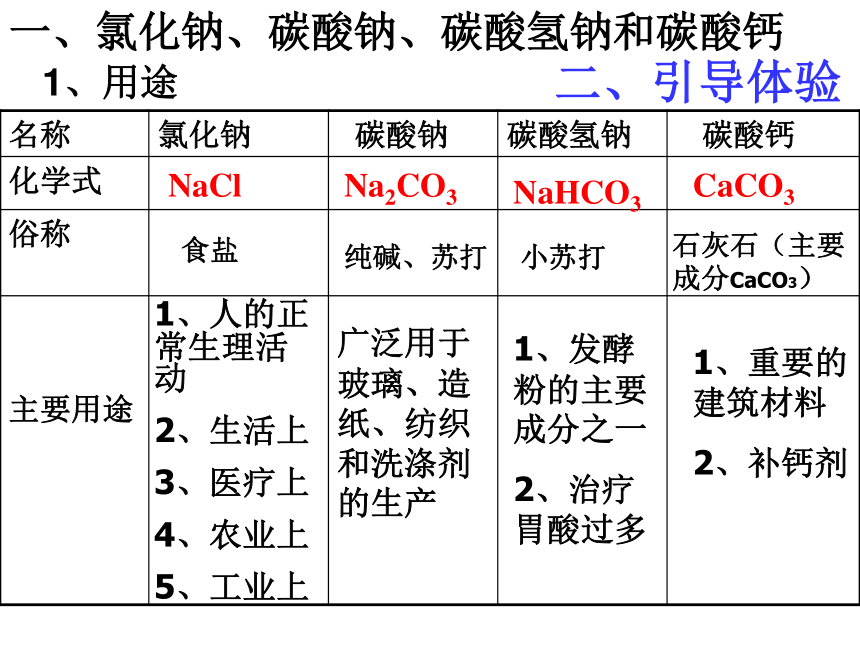
名称 氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
俗称
主要用途
NaCl
Na2CO3
NaHCO3
CaCO3
食盐
纯碱、苏打
小苏打
石灰石(主要成分CaCO3)
1、人的正常生理活动
2、生活上
3、医疗上
4、农业上
5、工业上
广泛用于玻璃、造纸、纺织和洗涤剂的生产
1、发酵粉的主要成分之一
2、治疗胃酸过多
1、重要的建筑材料
2、补钙剂
一、氯化钠、碳酸钠、碳酸氢钠和碳酸钙
1、用途
二、引导体验
海水里含有3%的食盐,把海水引进晒盐池,经过风吹日晒、水份蒸发,白花花的食盐就析出来了。其它还有用盐井水,盐湖水熬盐,使食盐溶液达到饱和,再继续蒸发,食盐就成晶体析出,得到粗盐。
食盐的制取
海南省东方盐场晒盐一景
食盐
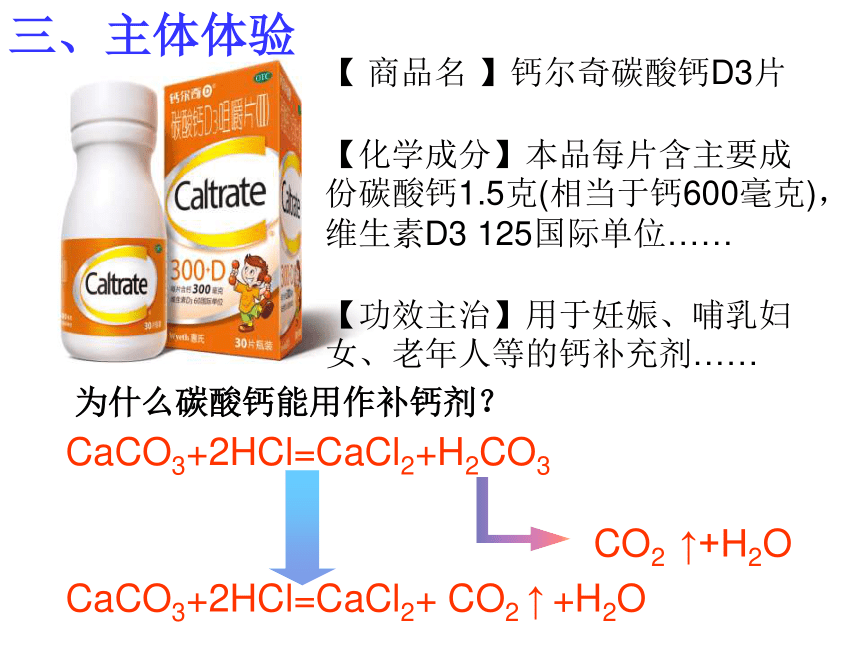
【 商品名 】钙尔奇碳酸钙D3片
【化学成分】本品每片含主要成份碳酸钙1.5克(相当于钙600毫克),维生素D3 125国际单位……
【功效主治】用于妊娠、哺乳妇女、老年人等的钙补充剂……
为什么碳酸钙能用作补钙剂?
三、主体体验
CaCO3+2HCl=CaCl2+H2CO3
CO2 ↑+H2O
CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
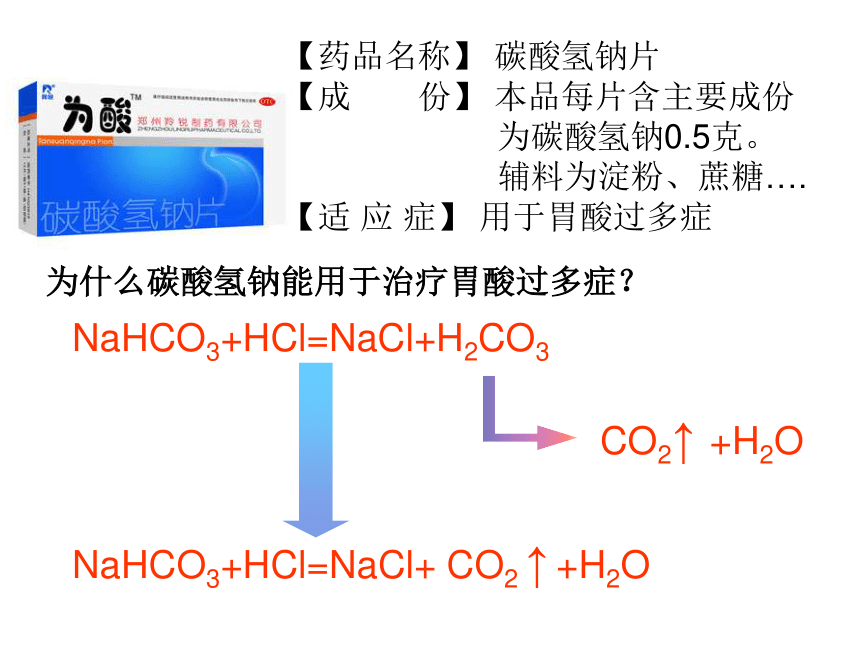
【药品名称】 碳酸氢钠片
【成 份】 本品每片含主要成份
为碳酸氢钠0.5克。
辅料为淀粉、蔗糖….
【适 应 症】 用于胃酸过多症
为什么碳酸氢钠能用于治疗胃酸过多症?
NaHCO3+HCl=NaCl+H2CO3
CO2↑ +H2O
NaHCO3+HCl=NaCl+ CO2 ↑ +H2O
制作面条时,需加入碱性的
Na2CO3 ,用来防止面粉因发酵
而产生酸味。
松花蛋加工的主要原料:
食盐、纯碱、生石灰、水等。
上述两种食品食用时,可添加什么佐料,使食品更健康、味道也更为可口?
我国制碱工业的先驱——侯德榜
他成功地摸索和改进了西方的制碱方法,发明了联合制碱法(又称侯式制碱法)。他为纯碱和氮肥工业技术的发展做出了杰出的贡献。
碳酸钠也能发生类似的反应吗?
Na2CO3+2HCl=2NaCl+H2CO3
CO2 ↑ +H2O
Na2CO3+2HCl=2NaCl+ CO2 ↑ +H2O
实验步骤 实验现象 实验结论
取样,加入稀盐酸,将产生的气体通入澄清石灰水。
有气泡产生,
澄清石灰水变浑浊。
草木灰的主要成分是碳酸钾。
四、内化体验
1、运用学过的知识解决实际问题。
植物燃烧后的残余物,称草木灰。草木灰肥料
因草木灰为植物燃烧后的灰烬,所以是凡植物所含
的矿质元素,草木灰中几乎都含有。它是一种来源
广泛、成本低廉、养分齐全、肥效明显的农家肥。
草木灰的主要成分是一种钾盐,请你设计实验证明
草木灰的主要成分是碳酸钾。
碳 酸 根离子 的 检 验
碳 酸 钙:
碳 酸 钠:
碳 酸 钾:
Ca CO3
Na2 CO3
K2 CO3
CO3
CO3
CO3
这类物质
统称碳酸盐
步骤:
现象:
结论:
取样,加入稀盐酸,将生成的气体
通入澄清石灰水中。
有气泡产生,石灰水变浑浊。
样品中含碳酸根离子。
2、化学性质
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现 象
分 析
(1)能与酸反应
Na2CO3 + 2 HCl === 2NaCl +CO2↑+H2O
NaHCO3 + HCl === NaCl +CO2↑+H2O
碳酸根离子或碳酸氢根离子的检验
取样品于试管中,加入适量的稀盐酸,若有气体生成, 将产生的气体通入澄清的石灰水,若石灰水变浑浊,则证明含有碳酸根离子或碳酸氢根离子。
CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
白色固体溶解,放出使澄清石灰水变浑浊的无色气体
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
Na2CO3+Ca(OH)2=CaCO3 +2NaOH
实验11-2 碳酸钠溶液+澄清石灰水
现象
分析
出现白色沉淀
二者发生反应,生成一种难溶物
(2)能与碱反应
Na2CO3 + Ca(OH)2
1、交换成分:
OH+ CO3
Na Ca
2、定化学式:(价不变)
化学方程式书写小窍门:
3、配 平:
Na2CO3+ Ca(OH)2
Na Ca
Na2CO3+ Ca(OH)2
OH+ CO3
Na2CO3+ Ca(OH)2
OH+ CO3
Na Ca
2
↓
二、复分解反应:由两种化合物相互交换成分,
生成另外两种化合物的反应。
表达式:AB + CD→ AD+ CB
NaOH+ HCl ===
Na2CO3 + Ca(OH)2 === CaCO3 ↓+ 2 NaOH
NaCl + H2O
CuO+H2SO4 =
CuSO4+H2O
Na2CO3 + 2 HCl === 2NaCl + H2CO3
CO2↑+H2O
NaHCO3 + HCl === NaCl + H2CO3
CO2↑+H2O
练习
A、Fe2O3+6HCl =2FeCl3+3H2O
B、CaO + H2O = Ca(OH)2
C、CuO+CO = Cu + CO2 D、SO2+ 2NaOH = Na2SO3 + H2O
下列化学反应属于复分解反应的是( )
A
三、复分解反应发生的条件
实验11-3 硫酸铜溶液+氢氧化钠溶液
现象
化学方程式
硫酸铜溶液+氯化钡溶液
现象
化学方程式
讨论:
1、上述两个反应是否属于复分解反应?观察到的现象
有什么共同之处?
产生蓝色沉淀,溶液由蓝色变成无色。
产生白色沉淀
CuSO4+ 2NaOH = Cu(OH)2 + Na2SO4
CuSO4+ BaCl2 = CuCl2 +BaSO4
是,都有沉淀生成。
2、前面学过的酸碱中和反应是否也属复分解反应?中和反应的生成物中,相同的生成物是什么?
答:属于复分解反应。因为“酸+碱→盐+水”符合复分解反应的概念,两种化合物相互交换成分,生成另外两种化合物。
都有水生成。
讨论
3、碳酸钠、碳酸钙等含有碳酸根的盐溶液与盐酸发生复分解反应时,可观察到的共同现象是什么?
答:都有气体生成。
讨论
Na2CO3 + 2 HCl === 2NaCl + H2CO3
CO2↑+H2O
NaHCO3 + HCl === NaCl + H2CO3
CO2↑+H2O
CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
三、复分解反应发生的条件
两种化合物相互交换成分,生成物中有沉淀、水或气体生成。
特殊要求:
⑴ 盐跟碱反应时,反应物中盐和碱必须是可溶的。
⑵ 盐跟盐反应时,反应物中盐和盐必须是可溶的。
为了正确书写复分解反应的化学方程式,必须熟记常见酸、碱、盐的溶解性表,正确地运用物质的溶解性。
钾盐、钠盐、铵盐、硝酸盐都溶
氯化物除氯化银(AgCl)外都溶
硫酸盐除硫酸钡(BaSO4)外都溶
碳酸盐除碳酸钾、碳酸钠、碳酸铵外都不溶
溶碱有四位NaOH、KOH、Ba(OH)2、氨水,
Ca(OH)2 微溶。
酸一般都溶。
另外:AgCl、BaSO4既不溶于水,也不溶于酸。
探究:
H2SO4 与NaOH、NaCl、K2CO3、Ba(NO3)2
四种溶液之间是否能发生反应 ?
第1组: H2SO4 + NaOH-----
第2组:H2SO4 + NaCl -----
第3组: H2SO4 + K2CO3 -----
第4组:H2SO4 + Ba(NO3)2 -----
有水生成,能反应。
无水、气体或沉淀生成,不能反应。
有气体生成,能反应。
有沉淀生成,能反应。
BaSO4↓+ HNO3
K2SO4 + H2O+CO2
Na2SO4 + H2O
设计实验:
(1)如何证明 H2SO4和NaOH 发生了反应?
(2)如何证明H2SO4 和NaCl不能发生反应?
取少量 NaOH 溶液于试管中,滴加几滴酚酞,然后逐滴滴加 H2SO4溶液,若红色消失,则可证明发生了反应。
取少量H2SO4溶液于试管中,滴加 NaCl溶液,若无明显变化,则可证明没有发生反应。
练习
下列物质间能否发生复分解反应?如能发生反应,写出有关反应的化学方程式。不能反应说明理由 。
??? (1)硫酸和硝酸钠溶液
(2)氢氧化钾溶液和硝酸
(3)氯化钠溶液和硝酸银溶液
(4)碳酸钾溶液和盐酸
化学反应速率的比较
??? 如图所示,在两试管中分别加入4 mL相同质量分数的稀盐酸,然后把等质量的碳酸钠粉末和碳酸氢钠粉末放在气球内,并用线把气球固定在试管上,同时把气球内的粉末倒入试管中,观察气球鼓起大小。
??? (1)鼓得更大的是??????????????? 。
??? (2)有关的化学反应方程式:
小实验
厨房里的两只调料瓶中都放有白色固体,只知道它们分别是精盐(NaCl)和碱面(Na2CO3)中的某一种。请你利用家中现有的条件将它们区分开来。简要叙述实验的步骤、现象和结论。
练习
在下列物质中:a食盐;b纯碱;c碳酸氢钠;d碳酸钙;
(1)可用作洗涤剂的是(填序号,下同) ;
(2)可用作调味剂的 ;
(3)可用作补钙剂和牙膏填充剂的是 ;
(4)可用于生产玻璃的是 ;
(5)可用作发酵粉和治疗胃酸过多症的是 ;
(6)既是钙盐又是碳酸盐的是????????????????????????? 。
解释和说明
馒头、面包等发面食品的一个特点是面团中有许多小孔,它们使发央食品松软可口。根据发酵粉(含碳酸钠、碳酸氢钠和有机酸)可与面粉、水混合直接制作发面食品的事实,说明碳酸钠、碳酸氢钠在其中的作用。
推断
已知:①在化工生产中,原料往往不能全部转化成产品;②工业上常用电解纯净的饱和食盐水的方法来得到烧碱溶液,再经过浓缩、蒸发等步骤制造固体烧碱;③氯化银不溶于稀硝酸。现要分析一种仓库里的固体烧碱样品。
??? (1)推测一下,该烧碱样品中可能含有哪些杂质。
??? (2)设计一个实验方案,来验证你的推测。
1、碳酸镁和盐酸
2、生石灰和水
3、硝酸银和氯化钠
4、硫酸和氢氧化钾
5、石灰水和二氧化碳
6、氢氧化钠和硫酸
7、氯化钡和硫酸铜
8、碳酸钾和硝酸钡
9、氢氧化铜和硫酸
10、白磷自燃
11、盐酸和碳酸钙
12、加热高锰酸钾
13、氯化钡和硝酸银
14、氢氧化钠和氯化铁
15、硫酸和碳酸钾
16、碳酸钡和盐酸
17、铜和硝酸银
18、硫酸铜和氢氧化钠
19、硫酸和氯化钡
20、盐酸和硝酸银
实验活动8
粗盐中难溶性杂质的去除
粗盐中含有较多的可溶性杂质,(氯化镁、氯化钙)和不溶性杂质(泥沙等)。可通过哪些步骤除去难溶性杂质,制取精盐?
过滤器的准备和过滤操作时应注意哪些问题?
粗盐的提纯
1、溶解
2、过滤
3、蒸发
4、计算产率
一贴二低三靠,观察滤纸上剩余物及滤液颜色!
用玻璃棒不断搅拌,待蒸发皿中出现较多固体,停止加热!
把固体转移到纸上并称量
讨论:实验中用到了几次玻璃棒?分别的作用?
观察是否全部溶解!
图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:
(1)写出标号的仪器名称:①????????????????,②??????????????。
???(2)漏斗中液体的液面应该(填“高”或“低”)???????? 于滤纸的边缘。
??? (3)蒸发滤液时,用玻璃棒不断搅拌滤液的目的是?????????????;等到蒸发皿中出现???????????????????时,停止加热,利用蒸发皿的余热使滤液蒸干,移去蒸发皿时应使用的仪器是??????????????????。
粗盐提纯实验操作步骤
1、溶解 2、过滤 3、蒸发 4、计算产率
第十一单元 盐 化肥
课题 1 生活中常见的盐
成份:氢氧化铝、碘甲基蛋氨酸等
3HCl + Al(OH)3 == AlCl3 + 3H2O
1、用化学方程式表示斯达舒治疗胃酸过多症的原理:
一、创设情境
2、实验室中的澄清石灰水保存时间长了以后,试剂瓶上会有一层白色固体,请用化学方程式表示其中的原因 ,你能用什么方法来清洗,请用化学方程式表示其中的原理 。
Ca(OH)2+CO2==CaCO3↓+H2O
CaCO3+2HCl=CaCl2+H2O+CO2↑
3、常见的盐
由金属离子和酸根离子构成的化合物。
盐的定义:
明矾晶体
KAl(SO4)2· 12H2O
五水硫酸铜晶体
CuSO4· 5H2O
食盐
NaCl
用钡餐观察
肠内情况
BaSO4
亚硝酸钠
?亚硝酸钠是工业用盐,形状很像食盐。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
名称 氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
俗称
主要用途
NaCl
Na2CO3
NaHCO3
CaCO3
食盐
纯碱、苏打
小苏打
石灰石(主要成分CaCO3)
1、人的正常生理活动
2、生活上
3、医疗上
4、农业上
5、工业上
广泛用于玻璃、造纸、纺织和洗涤剂的生产
1、发酵粉的主要成分之一
2、治疗胃酸过多
1、重要的建筑材料
2、补钙剂
一、氯化钠、碳酸钠、碳酸氢钠和碳酸钙
1、用途
二、引导体验
海水里含有3%的食盐,把海水引进晒盐池,经过风吹日晒、水份蒸发,白花花的食盐就析出来了。其它还有用盐井水,盐湖水熬盐,使食盐溶液达到饱和,再继续蒸发,食盐就成晶体析出,得到粗盐。
食盐的制取
海南省东方盐场晒盐一景
食盐
【 商品名 】钙尔奇碳酸钙D3片
【化学成分】本品每片含主要成份碳酸钙1.5克(相当于钙600毫克),维生素D3 125国际单位……
【功效主治】用于妊娠、哺乳妇女、老年人等的钙补充剂……
为什么碳酸钙能用作补钙剂?
三、主体体验
CaCO3+2HCl=CaCl2+H2CO3
CO2 ↑+H2O
CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
【药品名称】 碳酸氢钠片
【成 份】 本品每片含主要成份
为碳酸氢钠0.5克。
辅料为淀粉、蔗糖….
【适 应 症】 用于胃酸过多症
为什么碳酸氢钠能用于治疗胃酸过多症?
NaHCO3+HCl=NaCl+H2CO3
CO2↑ +H2O
NaHCO3+HCl=NaCl+ CO2 ↑ +H2O
制作面条时,需加入碱性的
Na2CO3 ,用来防止面粉因发酵
而产生酸味。
松花蛋加工的主要原料:
食盐、纯碱、生石灰、水等。
上述两种食品食用时,可添加什么佐料,使食品更健康、味道也更为可口?
我国制碱工业的先驱——侯德榜
他成功地摸索和改进了西方的制碱方法,发明了联合制碱法(又称侯式制碱法)。他为纯碱和氮肥工业技术的发展做出了杰出的贡献。
碳酸钠也能发生类似的反应吗?
Na2CO3+2HCl=2NaCl+H2CO3
CO2 ↑ +H2O
Na2CO3+2HCl=2NaCl+ CO2 ↑ +H2O
实验步骤 实验现象 实验结论
取样,加入稀盐酸,将产生的气体通入澄清石灰水。
有气泡产生,
澄清石灰水变浑浊。
草木灰的主要成分是碳酸钾。
四、内化体验
1、运用学过的知识解决实际问题。
植物燃烧后的残余物,称草木灰。草木灰肥料
因草木灰为植物燃烧后的灰烬,所以是凡植物所含
的矿质元素,草木灰中几乎都含有。它是一种来源
广泛、成本低廉、养分齐全、肥效明显的农家肥。
草木灰的主要成分是一种钾盐,请你设计实验证明
草木灰的主要成分是碳酸钾。
碳 酸 根离子 的 检 验
碳 酸 钙:
碳 酸 钠:
碳 酸 钾:
Ca CO3
Na2 CO3
K2 CO3
CO3
CO3
CO3
这类物质
统称碳酸盐
步骤:
现象:
结论:
取样,加入稀盐酸,将生成的气体
通入澄清石灰水中。
有气泡产生,石灰水变浑浊。
样品中含碳酸根离子。
2、化学性质
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现 象
分 析
(1)能与酸反应
Na2CO3 + 2 HCl === 2NaCl +CO2↑+H2O
NaHCO3 + HCl === NaCl +CO2↑+H2O
碳酸根离子或碳酸氢根离子的检验
取样品于试管中,加入适量的稀盐酸,若有气体生成, 将产生的气体通入澄清的石灰水,若石灰水变浑浊,则证明含有碳酸根离子或碳酸氢根离子。
CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
白色固体溶解,放出使澄清石灰水变浑浊的无色气体
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
Na2CO3+Ca(OH)2=CaCO3 +2NaOH
实验11-2 碳酸钠溶液+澄清石灰水
现象
分析
出现白色沉淀
二者发生反应,生成一种难溶物
(2)能与碱反应
Na2CO3 + Ca(OH)2
1、交换成分:
OH+ CO3
Na Ca
2、定化学式:(价不变)
化学方程式书写小窍门:
3、配 平:
Na2CO3+ Ca(OH)2
Na Ca
Na2CO3+ Ca(OH)2
OH+ CO3
Na2CO3+ Ca(OH)2
OH+ CO3
Na Ca
2
↓
二、复分解反应:由两种化合物相互交换成分,
生成另外两种化合物的反应。
表达式:AB + CD→ AD+ CB
NaOH+ HCl ===
Na2CO3 + Ca(OH)2 === CaCO3 ↓+ 2 NaOH
NaCl + H2O
CuO+H2SO4 =
CuSO4+H2O
Na2CO3 + 2 HCl === 2NaCl + H2CO3
CO2↑+H2O
NaHCO3 + HCl === NaCl + H2CO3
CO2↑+H2O
练习
A、Fe2O3+6HCl =2FeCl3+3H2O
B、CaO + H2O = Ca(OH)2
C、CuO+CO = Cu + CO2 D、SO2+ 2NaOH = Na2SO3 + H2O
下列化学反应属于复分解反应的是( )
A
三、复分解反应发生的条件
实验11-3 硫酸铜溶液+氢氧化钠溶液
现象
化学方程式
硫酸铜溶液+氯化钡溶液
现象
化学方程式
讨论:
1、上述两个反应是否属于复分解反应?观察到的现象
有什么共同之处?
产生蓝色沉淀,溶液由蓝色变成无色。
产生白色沉淀
CuSO4+ 2NaOH = Cu(OH)2 + Na2SO4
CuSO4+ BaCl2 = CuCl2 +BaSO4
是,都有沉淀生成。
2、前面学过的酸碱中和反应是否也属复分解反应?中和反应的生成物中,相同的生成物是什么?
答:属于复分解反应。因为“酸+碱→盐+水”符合复分解反应的概念,两种化合物相互交换成分,生成另外两种化合物。
都有水生成。
讨论
3、碳酸钠、碳酸钙等含有碳酸根的盐溶液与盐酸发生复分解反应时,可观察到的共同现象是什么?
答:都有气体生成。
讨论
Na2CO3 + 2 HCl === 2NaCl + H2CO3
CO2↑+H2O
NaHCO3 + HCl === NaCl + H2CO3
CO2↑+H2O
CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
三、复分解反应发生的条件
两种化合物相互交换成分,生成物中有沉淀、水或气体生成。
特殊要求:
⑴ 盐跟碱反应时,反应物中盐和碱必须是可溶的。
⑵ 盐跟盐反应时,反应物中盐和盐必须是可溶的。
为了正确书写复分解反应的化学方程式,必须熟记常见酸、碱、盐的溶解性表,正确地运用物质的溶解性。
钾盐、钠盐、铵盐、硝酸盐都溶
氯化物除氯化银(AgCl)外都溶
硫酸盐除硫酸钡(BaSO4)外都溶
碳酸盐除碳酸钾、碳酸钠、碳酸铵外都不溶
溶碱有四位NaOH、KOH、Ba(OH)2、氨水,
Ca(OH)2 微溶。
酸一般都溶。
另外:AgCl、BaSO4既不溶于水,也不溶于酸。
探究:
H2SO4 与NaOH、NaCl、K2CO3、Ba(NO3)2
四种溶液之间是否能发生反应 ?
第1组: H2SO4 + NaOH-----
第2组:H2SO4 + NaCl -----
第3组: H2SO4 + K2CO3 -----
第4组:H2SO4 + Ba(NO3)2 -----
有水生成,能反应。
无水、气体或沉淀生成,不能反应。
有气体生成,能反应。
有沉淀生成,能反应。
BaSO4↓+ HNO3
K2SO4 + H2O+CO2
Na2SO4 + H2O
设计实验:
(1)如何证明 H2SO4和NaOH 发生了反应?
(2)如何证明H2SO4 和NaCl不能发生反应?
取少量 NaOH 溶液于试管中,滴加几滴酚酞,然后逐滴滴加 H2SO4溶液,若红色消失,则可证明发生了反应。
取少量H2SO4溶液于试管中,滴加 NaCl溶液,若无明显变化,则可证明没有发生反应。
练习
下列物质间能否发生复分解反应?如能发生反应,写出有关反应的化学方程式。不能反应说明理由 。
??? (1)硫酸和硝酸钠溶液
(2)氢氧化钾溶液和硝酸
(3)氯化钠溶液和硝酸银溶液
(4)碳酸钾溶液和盐酸
化学反应速率的比较
??? 如图所示,在两试管中分别加入4 mL相同质量分数的稀盐酸,然后把等质量的碳酸钠粉末和碳酸氢钠粉末放在气球内,并用线把气球固定在试管上,同时把气球内的粉末倒入试管中,观察气球鼓起大小。
??? (1)鼓得更大的是??????????????? 。
??? (2)有关的化学反应方程式:
小实验
厨房里的两只调料瓶中都放有白色固体,只知道它们分别是精盐(NaCl)和碱面(Na2CO3)中的某一种。请你利用家中现有的条件将它们区分开来。简要叙述实验的步骤、现象和结论。
练习
在下列物质中:a食盐;b纯碱;c碳酸氢钠;d碳酸钙;
(1)可用作洗涤剂的是(填序号,下同) ;
(2)可用作调味剂的 ;
(3)可用作补钙剂和牙膏填充剂的是 ;
(4)可用于生产玻璃的是 ;
(5)可用作发酵粉和治疗胃酸过多症的是 ;
(6)既是钙盐又是碳酸盐的是????????????????????????? 。
解释和说明
馒头、面包等发面食品的一个特点是面团中有许多小孔,它们使发央食品松软可口。根据发酵粉(含碳酸钠、碳酸氢钠和有机酸)可与面粉、水混合直接制作发面食品的事实,说明碳酸钠、碳酸氢钠在其中的作用。
推断
已知:①在化工生产中,原料往往不能全部转化成产品;②工业上常用电解纯净的饱和食盐水的方法来得到烧碱溶液,再经过浓缩、蒸发等步骤制造固体烧碱;③氯化银不溶于稀硝酸。现要分析一种仓库里的固体烧碱样品。
??? (1)推测一下,该烧碱样品中可能含有哪些杂质。
??? (2)设计一个实验方案,来验证你的推测。
1、碳酸镁和盐酸
2、生石灰和水
3、硝酸银和氯化钠
4、硫酸和氢氧化钾
5、石灰水和二氧化碳
6、氢氧化钠和硫酸
7、氯化钡和硫酸铜
8、碳酸钾和硝酸钡
9、氢氧化铜和硫酸
10、白磷自燃
11、盐酸和碳酸钙
12、加热高锰酸钾
13、氯化钡和硝酸银
14、氢氧化钠和氯化铁
15、硫酸和碳酸钾
16、碳酸钡和盐酸
17、铜和硝酸银
18、硫酸铜和氢氧化钠
19、硫酸和氯化钡
20、盐酸和硝酸银
实验活动8
粗盐中难溶性杂质的去除
粗盐中含有较多的可溶性杂质,(氯化镁、氯化钙)和不溶性杂质(泥沙等)。可通过哪些步骤除去难溶性杂质,制取精盐?
过滤器的准备和过滤操作时应注意哪些问题?
粗盐的提纯
1、溶解
2、过滤
3、蒸发
4、计算产率
一贴二低三靠,观察滤纸上剩余物及滤液颜色!
用玻璃棒不断搅拌,待蒸发皿中出现较多固体,停止加热!
把固体转移到纸上并称量
讨论:实验中用到了几次玻璃棒?分别的作用?
观察是否全部溶解!
图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:
(1)写出标号的仪器名称:①????????????????,②??????????????。
???(2)漏斗中液体的液面应该(填“高”或“低”)???????? 于滤纸的边缘。
??? (3)蒸发滤液时,用玻璃棒不断搅拌滤液的目的是?????????????;等到蒸发皿中出现???????????????????时,停止加热,利用蒸发皿的余热使滤液蒸干,移去蒸发皿时应使用的仪器是??????????????????。
粗盐提纯实验操作步骤
1、溶解 2、过滤 3、蒸发 4、计算产率
同课章节目录
