人教版九年级下册 第九单元 溶 液 单元测试题
文档属性
| 名称 | 人教版九年级下册 第九单元 溶 液 单元测试题 |  | |
| 格式 | zip | ||
| 文件大小 | 214.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-14 21:02:20 | ||
图片预览




文档简介
第九单元 溶 液
(基础训练建议时间:45分钟)
一、选择题
1. (2019青岛)向下列物质中分别加入适量水,充分搅拌,不能得到溶液的是( )
A. 硝酸钾
B. 蔗糖
C. 花生油
D. 酒精
2. (2019重庆B)用硫酸钠固体配制质量分数为5%的硫酸钠溶液时,一般不会用到的仪器是( )
3. (2019青岛)下列与洗涤有关的做法不合理的是( )
A. 用洗洁精洗去餐具上的油污
B. 用汽油洗去沾在衣服上的油渍
C. 用白醋洗去水壶中的水垢(水垢的主要成分是碳酸钙和氢氧化镁)
D. 用纯碱溶液洗去铁制品表面的铁锈
4. (2019眉山)下列有关溶液的说法正确的是( )
A. 长期放置不分层的液体一定是溶液
B. 溶质可以是固体,也可以是液体或气体
C. 降低饱和溶液的温度,一定有晶体析出
D. 配制好的6%的NaCl溶液,装入试剂瓶中时不慎撒漏一部分,浓度减小
5. (2019郴州)将下列物质放入水中,其中一种物质的能量变化与其他三种物质不同的是( )
A. CaO B. NaOH
C. 浓H2SO4 D. NH4NO3
6. (2019温州)如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是( )
第6题图
A. 砂糖水颜色很深 B. 砂糖水味道很甜
C. 砂糖溶解得很快 D. 砂糖固体有剩余
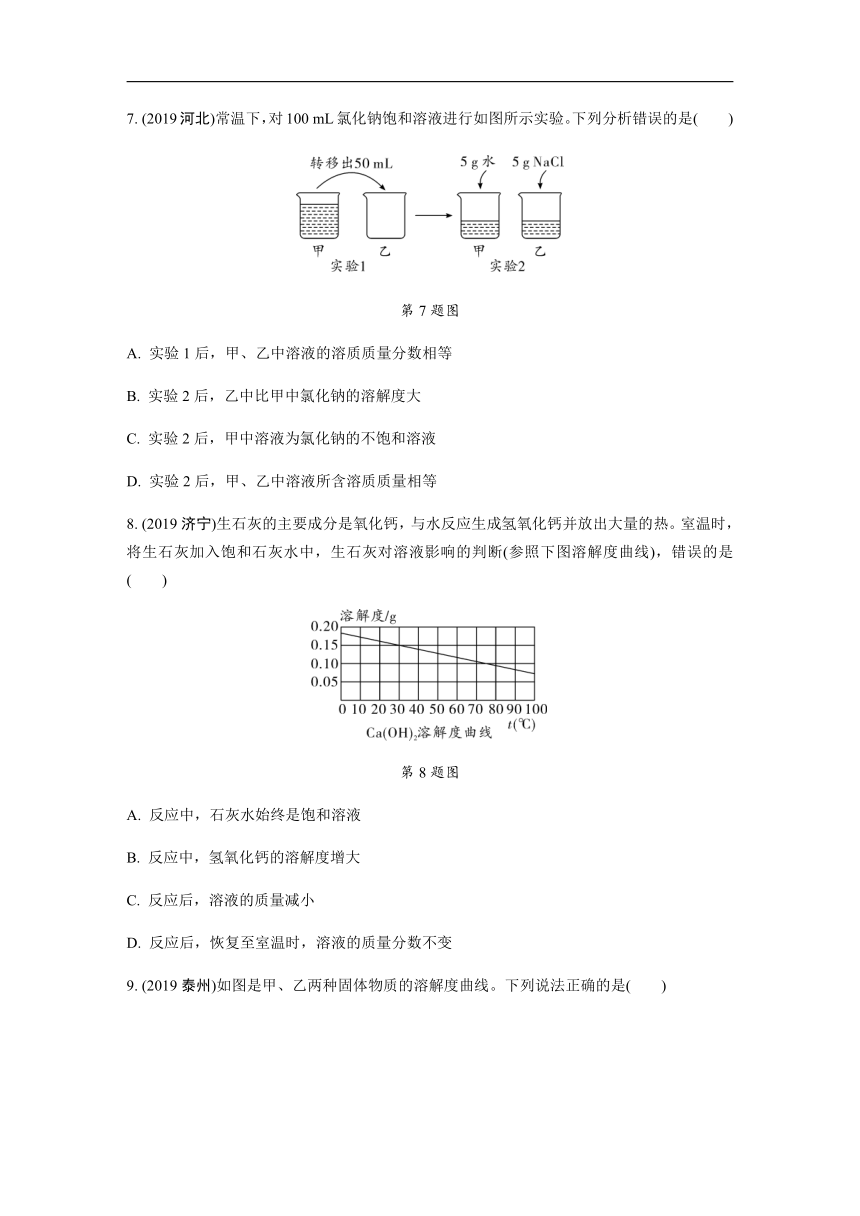
7. (2019河北)常温下,对100 mL氯化钠饱和溶液进行如图所示实验。下列分析错误的是( )
第7题图
A. 实验1后,甲、乙中溶液的溶质质量分数相等
B. 实验2后,乙中比甲中氯化钠的溶解度大
C. 实验2后,甲中溶液为氯化钠的不饱和溶液
D. 实验2后,甲、乙中溶液所含溶质质量相等
8. (2019济宁)生石灰的主要成分是氧化钙,与水反应生成氢氧化钙并放出大量的热。室温时,将生石灰加入饱和石灰水中,生石灰对溶液影响的判断(参照下图溶解度曲线),错误的是( )
第8题图
A. 反应中,石灰水始终是饱和溶液
B. 反应中,氢氧化钙的溶解度增大
C. 反应后,溶液的质量减小
D. 反应后,恢复至室温时,溶液的质量分数不变
9. (2019泰州)如图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是( )
第9题图
A. t1 ℃时,甲、乙两物质的溶解度大小关系:甲>乙
B. t2 ℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
C. t3 ℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D. 将t1 ℃时甲、乙的饱和溶液升温至t3 ℃,所得甲、乙的溶液仍都是饱和溶液
10. (2019南充)如图为甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线。下列相关说法中正确的是( )
第10题图
A. 甲和乙两物质的饱和溶液温度从t3 ℃降至t2 ℃时,析出晶体质量甲>乙
B. 将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法
C. 甲中含少量乙时,采用蒸发溶剂的方法提纯甲
D. t1 ℃时,30 g丙物质加入到50 g水中形成溶液的质量为80 g
11. (2019安徽)压强为101 kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是( )
温度/℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A. 两种物质的溶解度均随温度升高而增大
B. 20 ℃时,KNO3饱和溶液中溶质的质量分数为31.6%
C. 60 ℃的KNO3饱和溶液降温至30 ℃,有晶体析出
D. NH3的溶解度与压强大小无关
二、填空题
12. (2019宜昌)如图1是通过实验测得两种固体物质在不同温度时的溶解度,图2是市售果味型汽水配料表。请据图回答问题:
温度/℃ 0 20 40 60 80
溶解度/g 氯化钠 35.7 36.0 36.6 37.3 38.4
氯化钾 27.6 34.0 40.0 45.5 51.1
第12题图1
(1)20 ℃时,氯化钠的溶解度是________g。
(2)40 ℃时,将50 g氯化钾放入100 g水中,充分搅拌,所得溶液的质量为________g。
(3)60 ℃时,将45 g氯化钠和45 g氯化钾分别放入100 g水中充分搅拌,所得氯化钠溶液溶质的质量分数____氯化钾溶液溶质的质量分数(选填“<”“>”或“=”)。
第12题图2
(4)打开图2所示果味型汽水瓶盖时,观察到汽水中有大量气泡产生,结合配料成分可知,此时汽水是______的饱和溶液(填配料表中的具体物质)。
13. 如图是几种物质的溶解度曲线,根据图示回答:
第13题图
(1)在图1中,t2 ℃时甲物质的溶解度为______g。
(2)甲、丙在________℃时溶解度相同。
(3)图1中,t3℃时,要配制等质量的甲、乙、丙三种物质的饱和溶液,所需溶剂质量的大小关系是__________。
(4)气体的溶解度也有一定的变化规律。不同温度下,氧气的溶解度随压强而变化的情况如图2所示。若t1对应的温度为40 ℃,则t2对应的温度______(填字母序号)。
A. 小于40 ℃ B. 等于40 ℃ C. 大于40 ℃ D. 无法确定
三、实验题
14. (2019郴州)配制一定溶质质量分数的氯化钠溶液的过程如图所示:
第14题图
(1)写出图中标号a仪器的名称:________。
(2)配制50 g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠________g,水________g。
(3)称量氯化钠时,氯化钠应放在托盘天平的________盘。(填“左”或“右”)
(4)溶解过程中玻璃棒的作用是________________________________。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有________。(填序号)
A. 称量时,药品与砝码放反了
B. 量取水的体积时,仰视读数
C. 装瓶时,有少量溶液洒出
(6)把50 g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是______g。
四、计算题
15. (2018毕节改编)化学与生活息息相关,如图为氯化钠注射液的标签说明,请计算:(本题只要求写出计算结果)
第15题图
(1)氯化钠中氯元素与钠元素的质量比。
(2)若要配制1000 mL该氯化钠注射液,需称量的氯化钠质量是多少?
16. (2019云南改编)某化学兴趣小组的同学到化学实验室,用铝和氢氧化钠溶液反应来制备氢气。同学们取了3 g纯铝片和40 g一定质量分数的氢氧化钠溶液,充分反应后,铝片有剩余,称得反应后剩余物质的总质量为42.7 g。试计算:所用氢氧化钠溶液的溶质质量分数。
[提示: 2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑]
17. (2019山西)配制50 g质量分数5%的KNO3溶液,作为无土栽培所需的营养液。溶解过程中KNO3的质量分数随时间的变化关系如图表示,观察图像,分析形成这种结果的原因是( )
第17题图
A. 所用KNO3固体中含有水分
B. 量筒量水时俯视刻度线
C. KNO3固体溶解前所用烧杯内有水
D. 配好的溶液装瓶时部分液体洒落到试剂瓶外
18. (2019昆明)PbO能溶解在不同浓度的NaOH溶液中,其溶解度曲线如图所示。下列叙述错误的是( )
第18题图
A. 100 ℃时,PbO在35%NaOH溶液中的溶解度为100 g·L-1
B. 60 ℃时,PbO在35%NaOH溶液中的溶解度大于在10%NaOH溶液中的溶解度
C. 20 ℃时,PbO在10%NaOH溶液中所溶解的质量,一定小于在35%NaOH溶液中所溶解的质量
D. 80 ℃时,将PbO溶解在10%NaOH溶液中达到饱和,然后降温至40 ℃,该过程中一定析出固体
19. (2019襄阳)曼曼用盛有150 g水的烧杯进行如图甲操作,得到相应的溶液①~③。下列说法正确的是( )
第19题图
A. 固体W的溶解度曲线是图乙中的b
B. ①~③溶液中,只有②是饱和溶液
C. ①~③溶液中,溶质质量分数的大小关系是③>②>①
D. 若将②升温至t2℃,固体不能全部溶解
20. (2019重庆B)我国制碱工业的先驱——侯德榜成功地摸索和改进了西方的制碱方法。下表为侯氏制碱法中部分物质的溶解度。
温度/℃ 10 20 30 40
溶解度/g Na2CO3 12.2 21.8 39.7 48.8
NaCl 35.8 36.0 36.3 36.6
NaHCO3 8.2 9.6 11.1 12.7
(1)由上表可知,在10 ℃~40 ℃之间溶解度随温度变化最小的物质是________(填名称)。
(2)40 ℃时,将等质量的三种表中物质的饱和溶液降温至20 ℃,所得溶液中溶质的质量分数由大到小的顺序是__________________________(用化学式表示)。
(3)侯氏制碱法制得的碱为纯碱,纯碱的化学式为________________。
(4)制碱原理为向饱和的NaCl溶液中通入足量NH3和CO2生成NaHCO3晶体和NH4Cl,NaHCO3加热分解即制得纯碱。
①生成NaHCO3的化学方程式为____________________________。
②结合上表分析,析出NaHCO3晶体的原因可能有________(填序号)。
A. 溶剂质量减少
B. 同温下NaHCO3溶解度小于NaCl
C. 生成的NaHCO3质量大于消耗的NaCl质量
1. C 2. B 3. D 4. B 5. D 6. D 7. B 8. B 9. C 10. B 11. C
12. (1)36.0 (2)140 (3)< (4)CO2(或二氧化碳)
13. (1)60 (2)t1 (3)丙>甲=乙 (4)C
14. (1)量筒 (2)7.5 42.5 (3)左 (4)搅拌,加速氯化钠的溶解 (5)AB (6)100
15. (1)35.5∶23(或71∶46)
(2)需要氯化钠的质量为1000 mL×1.0 g/cm3×0.9%=9 g
16. 解:生成氢气的质量为40 g+3 g-42.7 g=0.3 g,设参加反应的氢氧化钠的质量为x
2Al+2H2O+2NaOH=== 2NaAlO2+3H2↑
80 6
x 0.3 g
= x=4 g
所用氢氧化钠溶液的溶质质量分数为×100%=10%
答:所用氢氧化钠溶液的溶质质量分数为10%。
17. B 18. C 19. D
20. (1)氯化钠 (2)NaCl、Na2CO3、 NaHCO3
(3)Na2CO3 (4)①NaCl+H2O+ NH3+CO2===NaHCO3↓+NH4Cl ②AB
(基础训练建议时间:45分钟)
一、选择题
1. (2019青岛)向下列物质中分别加入适量水,充分搅拌,不能得到溶液的是( )
A. 硝酸钾
B. 蔗糖
C. 花生油
D. 酒精
2. (2019重庆B)用硫酸钠固体配制质量分数为5%的硫酸钠溶液时,一般不会用到的仪器是( )
3. (2019青岛)下列与洗涤有关的做法不合理的是( )
A. 用洗洁精洗去餐具上的油污
B. 用汽油洗去沾在衣服上的油渍
C. 用白醋洗去水壶中的水垢(水垢的主要成分是碳酸钙和氢氧化镁)
D. 用纯碱溶液洗去铁制品表面的铁锈
4. (2019眉山)下列有关溶液的说法正确的是( )
A. 长期放置不分层的液体一定是溶液
B. 溶质可以是固体,也可以是液体或气体
C. 降低饱和溶液的温度,一定有晶体析出
D. 配制好的6%的NaCl溶液,装入试剂瓶中时不慎撒漏一部分,浓度减小
5. (2019郴州)将下列物质放入水中,其中一种物质的能量变化与其他三种物质不同的是( )
A. CaO B. NaOH
C. 浓H2SO4 D. NH4NO3
6. (2019温州)如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是( )
第6题图
A. 砂糖水颜色很深 B. 砂糖水味道很甜
C. 砂糖溶解得很快 D. 砂糖固体有剩余
7. (2019河北)常温下,对100 mL氯化钠饱和溶液进行如图所示实验。下列分析错误的是( )
第7题图
A. 实验1后,甲、乙中溶液的溶质质量分数相等
B. 实验2后,乙中比甲中氯化钠的溶解度大
C. 实验2后,甲中溶液为氯化钠的不饱和溶液
D. 实验2后,甲、乙中溶液所含溶质质量相等
8. (2019济宁)生石灰的主要成分是氧化钙,与水反应生成氢氧化钙并放出大量的热。室温时,将生石灰加入饱和石灰水中,生石灰对溶液影响的判断(参照下图溶解度曲线),错误的是( )
第8题图
A. 反应中,石灰水始终是饱和溶液
B. 反应中,氢氧化钙的溶解度增大
C. 反应后,溶液的质量减小
D. 反应后,恢复至室温时,溶液的质量分数不变
9. (2019泰州)如图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是( )
第9题图
A. t1 ℃时,甲、乙两物质的溶解度大小关系:甲>乙
B. t2 ℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
C. t3 ℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D. 将t1 ℃时甲、乙的饱和溶液升温至t3 ℃,所得甲、乙的溶液仍都是饱和溶液
10. (2019南充)如图为甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线。下列相关说法中正确的是( )
第10题图
A. 甲和乙两物质的饱和溶液温度从t3 ℃降至t2 ℃时,析出晶体质量甲>乙
B. 将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法
C. 甲中含少量乙时,采用蒸发溶剂的方法提纯甲
D. t1 ℃时,30 g丙物质加入到50 g水中形成溶液的质量为80 g
11. (2019安徽)压强为101 kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是( )
温度/℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A. 两种物质的溶解度均随温度升高而增大
B. 20 ℃时,KNO3饱和溶液中溶质的质量分数为31.6%
C. 60 ℃的KNO3饱和溶液降温至30 ℃,有晶体析出
D. NH3的溶解度与压强大小无关
二、填空题
12. (2019宜昌)如图1是通过实验测得两种固体物质在不同温度时的溶解度,图2是市售果味型汽水配料表。请据图回答问题:
温度/℃ 0 20 40 60 80
溶解度/g 氯化钠 35.7 36.0 36.6 37.3 38.4
氯化钾 27.6 34.0 40.0 45.5 51.1
第12题图1
(1)20 ℃时,氯化钠的溶解度是________g。
(2)40 ℃时,将50 g氯化钾放入100 g水中,充分搅拌,所得溶液的质量为________g。
(3)60 ℃时,将45 g氯化钠和45 g氯化钾分别放入100 g水中充分搅拌,所得氯化钠溶液溶质的质量分数____氯化钾溶液溶质的质量分数(选填“<”“>”或“=”)。
第12题图2
(4)打开图2所示果味型汽水瓶盖时,观察到汽水中有大量气泡产生,结合配料成分可知,此时汽水是______的饱和溶液(填配料表中的具体物质)。
13. 如图是几种物质的溶解度曲线,根据图示回答:
第13题图
(1)在图1中,t2 ℃时甲物质的溶解度为______g。
(2)甲、丙在________℃时溶解度相同。
(3)图1中,t3℃时,要配制等质量的甲、乙、丙三种物质的饱和溶液,所需溶剂质量的大小关系是__________。
(4)气体的溶解度也有一定的变化规律。不同温度下,氧气的溶解度随压强而变化的情况如图2所示。若t1对应的温度为40 ℃,则t2对应的温度______(填字母序号)。
A. 小于40 ℃ B. 等于40 ℃ C. 大于40 ℃ D. 无法确定
三、实验题
14. (2019郴州)配制一定溶质质量分数的氯化钠溶液的过程如图所示:
第14题图
(1)写出图中标号a仪器的名称:________。
(2)配制50 g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠________g,水________g。
(3)称量氯化钠时,氯化钠应放在托盘天平的________盘。(填“左”或“右”)
(4)溶解过程中玻璃棒的作用是________________________________。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有________。(填序号)
A. 称量时,药品与砝码放反了
B. 量取水的体积时,仰视读数
C. 装瓶时,有少量溶液洒出
(6)把50 g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是______g。
四、计算题
15. (2018毕节改编)化学与生活息息相关,如图为氯化钠注射液的标签说明,请计算:(本题只要求写出计算结果)
第15题图
(1)氯化钠中氯元素与钠元素的质量比。
(2)若要配制1000 mL该氯化钠注射液,需称量的氯化钠质量是多少?
16. (2019云南改编)某化学兴趣小组的同学到化学实验室,用铝和氢氧化钠溶液反应来制备氢气。同学们取了3 g纯铝片和40 g一定质量分数的氢氧化钠溶液,充分反应后,铝片有剩余,称得反应后剩余物质的总质量为42.7 g。试计算:所用氢氧化钠溶液的溶质质量分数。
[提示: 2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑]
17. (2019山西)配制50 g质量分数5%的KNO3溶液,作为无土栽培所需的营养液。溶解过程中KNO3的质量分数随时间的变化关系如图表示,观察图像,分析形成这种结果的原因是( )
第17题图
A. 所用KNO3固体中含有水分
B. 量筒量水时俯视刻度线
C. KNO3固体溶解前所用烧杯内有水
D. 配好的溶液装瓶时部分液体洒落到试剂瓶外
18. (2019昆明)PbO能溶解在不同浓度的NaOH溶液中,其溶解度曲线如图所示。下列叙述错误的是( )
第18题图
A. 100 ℃时,PbO在35%NaOH溶液中的溶解度为100 g·L-1
B. 60 ℃时,PbO在35%NaOH溶液中的溶解度大于在10%NaOH溶液中的溶解度
C. 20 ℃时,PbO在10%NaOH溶液中所溶解的质量,一定小于在35%NaOH溶液中所溶解的质量
D. 80 ℃时,将PbO溶解在10%NaOH溶液中达到饱和,然后降温至40 ℃,该过程中一定析出固体
19. (2019襄阳)曼曼用盛有150 g水的烧杯进行如图甲操作,得到相应的溶液①~③。下列说法正确的是( )
第19题图
A. 固体W的溶解度曲线是图乙中的b
B. ①~③溶液中,只有②是饱和溶液
C. ①~③溶液中,溶质质量分数的大小关系是③>②>①
D. 若将②升温至t2℃,固体不能全部溶解
20. (2019重庆B)我国制碱工业的先驱——侯德榜成功地摸索和改进了西方的制碱方法。下表为侯氏制碱法中部分物质的溶解度。
温度/℃ 10 20 30 40
溶解度/g Na2CO3 12.2 21.8 39.7 48.8
NaCl 35.8 36.0 36.3 36.6
NaHCO3 8.2 9.6 11.1 12.7
(1)由上表可知,在10 ℃~40 ℃之间溶解度随温度变化最小的物质是________(填名称)。
(2)40 ℃时,将等质量的三种表中物质的饱和溶液降温至20 ℃,所得溶液中溶质的质量分数由大到小的顺序是__________________________(用化学式表示)。
(3)侯氏制碱法制得的碱为纯碱,纯碱的化学式为________________。
(4)制碱原理为向饱和的NaCl溶液中通入足量NH3和CO2生成NaHCO3晶体和NH4Cl,NaHCO3加热分解即制得纯碱。
①生成NaHCO3的化学方程式为____________________________。
②结合上表分析,析出NaHCO3晶体的原因可能有________(填序号)。
A. 溶剂质量减少
B. 同温下NaHCO3溶解度小于NaCl
C. 生成的NaHCO3质量大于消耗的NaCl质量
1. C 2. B 3. D 4. B 5. D 6. D 7. B 8. B 9. C 10. B 11. C
12. (1)36.0 (2)140 (3)< (4)CO2(或二氧化碳)
13. (1)60 (2)t1 (3)丙>甲=乙 (4)C
14. (1)量筒 (2)7.5 42.5 (3)左 (4)搅拌,加速氯化钠的溶解 (5)AB (6)100
15. (1)35.5∶23(或71∶46)
(2)需要氯化钠的质量为1000 mL×1.0 g/cm3×0.9%=9 g
16. 解:生成氢气的质量为40 g+3 g-42.7 g=0.3 g,设参加反应的氢氧化钠的质量为x
2Al+2H2O+2NaOH=== 2NaAlO2+3H2↑
80 6
x 0.3 g
= x=4 g
所用氢氧化钠溶液的溶质质量分数为×100%=10%
答:所用氢氧化钠溶液的溶质质量分数为10%。
17. B 18. C 19. D
20. (1)氯化钠 (2)NaCl、Na2CO3、 NaHCO3
(3)Na2CO3 (4)①NaCl+H2O+ NH3+CO2===NaHCO3↓+NH4Cl ②AB
同课章节目录
