20192019-2020学年九年级化学人教版(新)下册同步小练:金属的化学性质(解析版)
文档属性
| 名称 | 20192019-2020学年九年级化学人教版(新)下册同步小练:金属的化学性质(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 216.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-14 21:38:07 | ||
图片预览


文档简介
2019-2020学年九年级化学人教版下册同步小练
金属的化学性质
1、下列有关金属与氧气的说法正确的是( )
A.金属与氧气反应必须要加热或点燃
B.“真金不怕火炼”说明高温下金也不与氧气反应
C.铁丝在氧气中剧烈燃烧、火星四射,生成三氧化二铁
D.金属与氧气反应的剧烈程度,与金属的活动性强弱无关
2、苹果、梨等多种水果的细胞中都含有鞣酸。鞣酸能和铁反应,生成黑色的鞣酸铁与氢气,所以 苹果、梨用铁刀切开以后,表面会变黑。下列四种金属 中,能与鞣酸反应生成氢气的是( )
A.Cu B. Ag C.Zn D.Hg
3、把一枚无锈铁钉放在硫 酸铜溶液中,一段时间后,可出现的是( )
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
4、下列反应属于置换反应的是( )
A. H2CO3 =H2O+CO2 ↑
B.CO2+C2CO
C.Fe+H2SO4=FeSO4+H2↑
D.4P+5O22P2O5
5、铝制品比铁制品抗腐蚀能力强的原因是( )
A.铝的密度小于铁的密度
B.铝的熔点低于铁的熔点
C.铝的导电性比铁强
D.铝的表面有一层致密的氧化膜,而铁没有
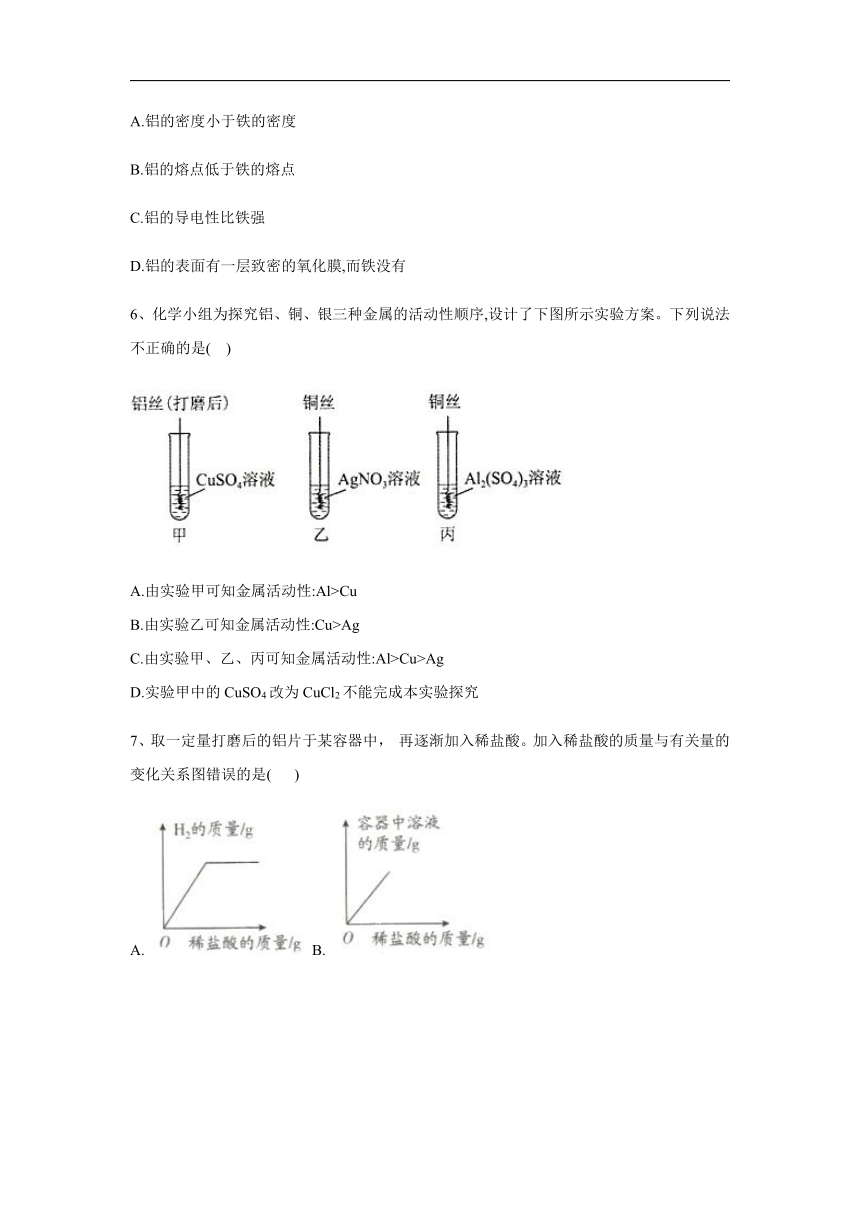
6、化学小组为探究铝、铜、银三种金属的活动性顺序,设计了下图所示实验方案。下列说法不正确的是(?? )
A.由实验甲可知金属活动性:Al>Cu
B.由实验乙可知金属活动性:Cu>Ag
C.由实验甲、乙、丙可知金属活动性:Al>Cu>Ag
D.实验甲中的CuSO4改为CuCl2不能完成本实验探究
7、取一定量打磨后的铝片于某容器中, 再逐渐加入稀盐酸。加入稀盐酸的质量与有关量的变化关系图错误的是( )
A. B.
C. D.
8、已知化学反应:X+YSO4 =Y+XSO4,根据此反应信息判断,正确的是( )
A.X—定是金属铁 B.Y—定是金属铜
C.X的金属活动性比Y强 D.Y的金属活动性比X强
9、某溶液中有Cu(NO3)2和Fe(NO3)2,加入一定量的Zn粉充分反应后过滤,向滤渣中滴加稀盐酸,有气泡产生下列关于 滤液的判断正确的是( )
A.—定不会是无色的
B.—定不会是蓝色的
C.一定不会是浅绿色的
D.以上判断皆不正确
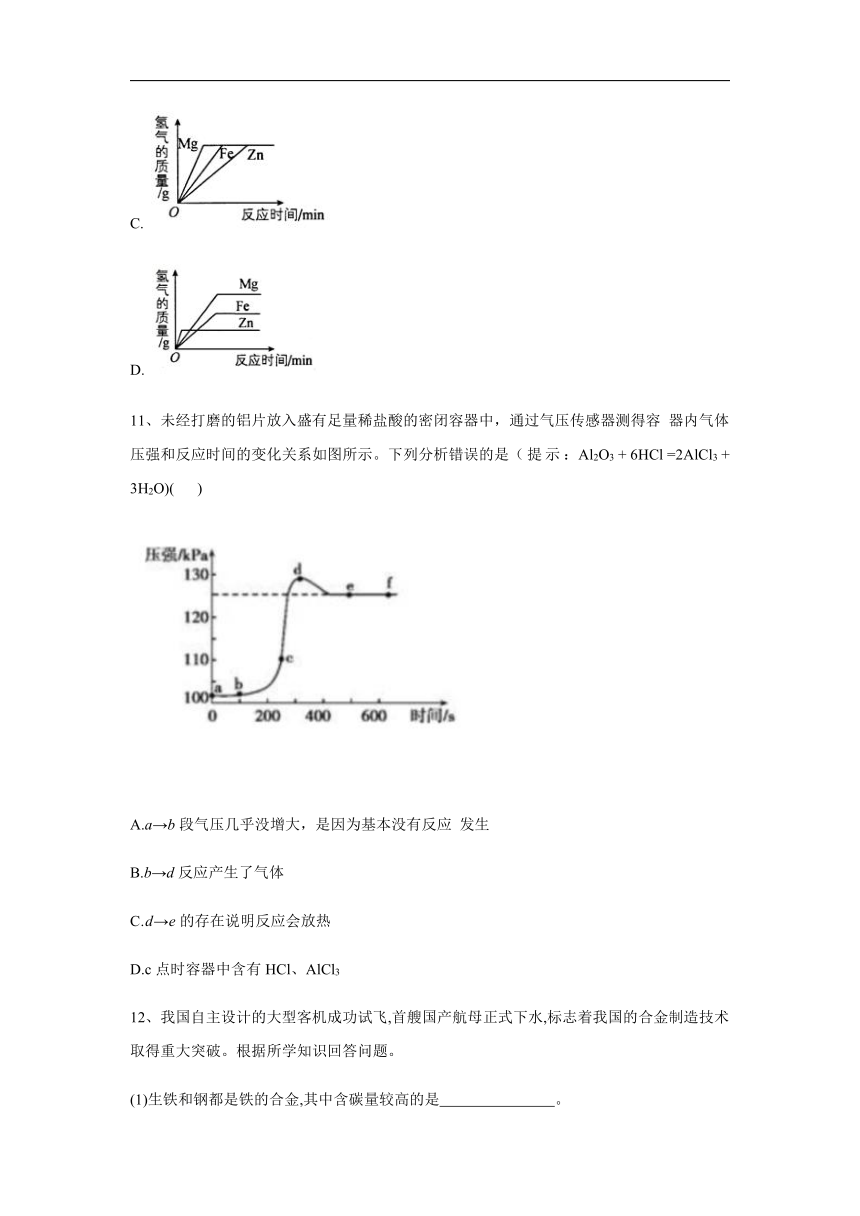
10、等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应,下列图像能正确反映生成氢气质量与反应时间之间关系的是( )
A.
B.
C.
D.
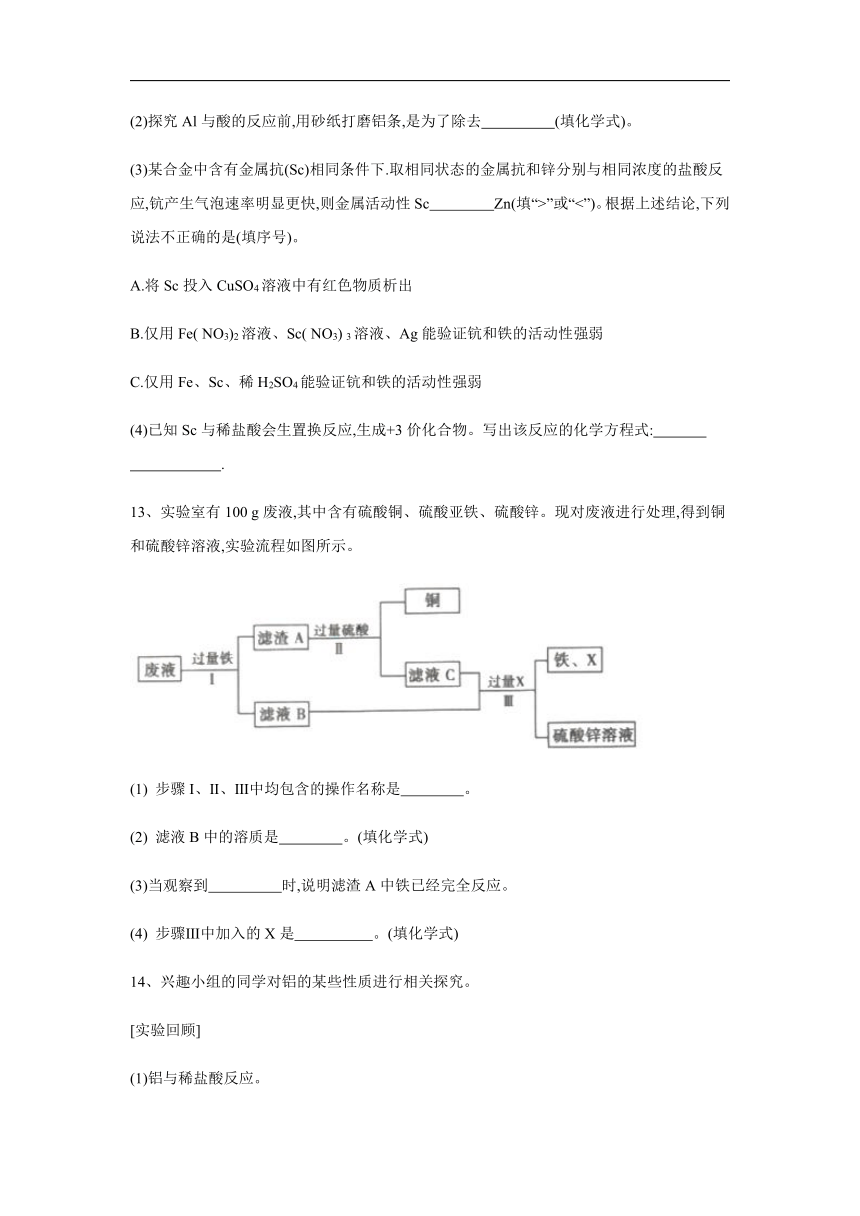
11、未经打磨的铝片放入盛有足量稀盐酸的密闭容器中,通过气压传感器测得容 器内气体压强和反应时间的变化关系如图所示。下列分析错误的是(提示:Al2O3 + 6HCl =2AlCl3 + 3H2O)( )
A.a→b段气压几乎没增大,是因为基本没有反应 发生
B.b→d反应产生了气体
C.d→e的存在说明反应会放热
D.c点时容器中含有HCl、AlCl3
12、我国自主设计的大型客机成功试飞,首艘国产航母正式下水,标志着我国的合金制造技术取得重大突破。根据所学知识回答问题。
(1)生铁和钢都是铁的合金,其中含碳量较高的是 。
(2)探究Al与酸的反应前,用砂纸打磨铝条,是为了除去 (填化学式)。
(3)某合金中含有金属抗(Sc)相同条件下.取相同状态的金属抗和锌分别与相同浓度的盐酸反应,钪产生气泡速率明显更快,则金属活动性Sc Zn(填“>”或“<”)。根据上述结论,下列说法不正确的是(填序号)。
A.将Sc投入CuSO4溶液中有红色物质析出
B.仅用Fe( NO3)2溶液、Sc( NO3) 3溶液、Ag能验证钪和铁的活动性强弱
C.仅用Fe、Sc、稀H2SO4能验证钪和铁的活动性强弱
(4)已知Sc与稀盐酸会生置换反应,生成+3价化合物。写出该反应的化学方程式: .
13、实验室有100 g废液,其中含有硫酸铜、硫酸亚铁、硫酸锌。现对废液进行处理,得到铜和硫酸锌溶液,实验流程如图所示。
(1) 步骤I、Ⅱ、Ⅲ中均包含的操作名称是 。
(2) 滤液B中的溶质是 。(填化学式)
(3)当观察到 时,说明滤渣A中铁已经完全反应。
(4) 步骤Ⅲ中加入的X是 。(填化学式)
14、兴趣小组的同学对铝的某些性质进行相关探究。
[实验回顾]
(1)铝与稀盐酸反应。
①用如图1所示装置制取氢气。
铝与稀盐酸反应的化学方程式为 。
②用B装置收集氢气的原因是 。
(2)在金属活动性顺序里,金属能否置换出盐酸和稀硫酸中的氢,判断的依据是 。
[提出问题]铝能否与水反应生成氢气?
[查阅资料]
物质 钠与水 铝与水 汞与水
能否发生反应 能反应 能反应 不反应
[交流与讨论]
(1)铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,起到保护膜的作用,如生活中可用铝壶烧水。铝与氧气反应的化学方程式为 。
(2) 除去铝表面氧化铝薄膜的方法(举一例) 。
除上述方法外,还可以将铝片浸入氯化汞(HgCl2)溶液中,形成铝汞齐(铝汞合金)破坏铝表面致密的氧化膜且防止其重新生成。
[实验探究]
(1)将铝片完全浸入氯化汞(HgCl2)溶液中]分钟左右,取出,立即用流水冲洗干净后加入到蒸馏水中 (如图2),其表面生成大量气泡、周围出现白色沉淀。 铝与氯化汞溶液发生置换反应的化学方程式为 。
图2
(2)在导管口 a处涂肥皂水,发现导管口有气泡形成,当气泡离开导管后,气泡 (填“下沉”或“上升”),用燃着的木条点燃气泡,发出爆鸣声。
[实验结论]
铝能与水反应生成氢气。
写出铝与水反应生成氢氧化铝和氢气的化学方程式: 。
[实验反思]
(1)图2装置内,在铝与水反应的过程中,若关闭导管上的活塞K,反应停止,其原理是 。当再次打开活塞K,反应继续,产生气泡。铝未能生成氧化铝,其原因是 。
(2)汞有毒,会污染环境,兴趣小组的同学用硫粉处理单质汞,用饱和硫化钠溶液处理使用过的氯化汞废液。
答案以及解析
1答案及解析:
答案:B
解析:很多金属能与氧气反应,但是反应条件不同.如Mg、Al在常温下就能与氧气反应,有的则需要点燃或加热,如Fe、 Cu,且反应的剧烈程度也不相同,这些都与金属的活动性强 弱有关;还有一些金属如Au,即使在高温的条件下也不与氧 气反应;铁丝在氧气中燃烧生成四氧化三铁。
2答案及解析:
答案:C
解析:金属活动性顺序中,排在氢前面的金属,能与酸反应牛成 氢气,四种金属中只有锌能与酸反应生成氢气。
3答案及解析:
答案:B
解析:铁能与硫酸铜反应生成硫酸亚铁和铜,溶液由蓝色变为浅绿色,无气泡产生,同时铁钉表面析出红色物质;每56份质 量的铁可置换出64份质量的铜,所以溶液的质量会减小。
4答案及解析:
答案:C
解析:
5答案及解析:
答案:D
解析:铝被氧化生成一层致密的氧化物薄膜,而铁表面不会生 成结构致密的氧化物,所以铝制品比铁制品抗腐蚀能力强。
6答案及解析:
答案:D
解析:A项,由实验甲可知金属活动性:Al>Cu,正确;B项,由 实验乙可知金属活动性:Cu>Ag,正确;C项,由实验甲、 乙、丙可知金属活动性:Al>Cu>Ag,正确;D项,实验甲中 的CuSO4改为CuCl2也能完成本实验探究,错误。
7答案及解析:
答案:B
解析:生成氯化铝溶液的质量大于稀盐酸的质量,因此反应 过程中溶液质量不断增大,当反应结束后,加入盐酸的质量使溶液 的质量增加,但增加幅度小于与铝反应时质量的增加,B错误。
8答案及解析:
答案:C
解析:由化学方程式可知金属活动性X>Y.但不能判断金属X 和Y的具体物质。
9答案及解析:
答案:B
解析:向含有Cu(NO3)2和Fe(NO3)2的溶液中加入一定量的Zn 粉,Zn先与反应,再与Fe(NO3)2反应向滤渣中滴加稀盐酸,有气泡户生,说明滤渣中一定有铁和铜,可能有 锌当锌过量时,能把铁全部置换出来,溶液呈无色;由于滤渣中有铁,则溶液中的铜全部被置换出来,所以滤液一定不会是 蓝色的;当锌的量不足以把铁全部置换出来时,溶液呈浅绿色。
10答案及解析:
答案:B
解析:等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应, 根据质量守恒定律可知生成氢气质量相等。金属活动性不 同导致反应速率不同,金属活动性越强,其反应速率越大, 导致反应时间越短,金属活动性:Mg>Zn>Fe,所以反应速 率:Mg>Zn>Fe,则反应时间:Fe>Zn>Mg,由以上分析可 知B正确。
11答案及解析:
答案:A
解析:a→b段是盐酸和铝表面的氧化铝反应生成氯化铝和 水,因此气压无明显变化,A错误;段盐酸和铝反应生成了氢 气,该段气压明显增大,B正确;d→e段的存在说明铝与盐酸反应 会放热,反应结束后溫度降低,气压减小,C正确;c点处于铝与盐 酸反应过程中,此时容器中溶液的溶质是过量的HC1、反应生成 的A1C13,D正确.
12答案及解析:
答案:(1)生铁(2)Al2O3(3)>; B
(4)2Sc+6HCl=2ScC13+3H2 ↑
解析:(1)生铁的含碳量高于钢。(2)铝的表面有一层致密 的氧化铝保护膜,用砂纸能将其打磨掉。(3)相同条件下,取相同状态的金属 Sc和Zn分别与相同浓度的盐酸反应,Sc产 生气泡速率明显更快,则金属活动性Sc大于Zn 。Sc的金属 活动性强于Zn,故一定强于Cu,将Sc投入CuSO4溶液中有红 色物质析出;仅用Fe( NO3)2溶液、Sc( NO3)3溶液、Ag不能验证Sc和Fe的活动性强弱;反用Fe、Sc、稀H2SO4,根据反应产 生气泡的快慢,能验证Sc和Fe的活动性强弱(4)Sc与稀盐酸 发生置换反应,生成ScCl3和氢气。
13答案及解析:
答案:(1)过滤(2)ZnSO4、FeSO4 (3)气泡不再产生(4)Zn
解析:本题结合对实验室废液的处理,考查了对工艺流程中信 息的处理的核心素养. (1)步骤Ⅰ、Ⅱ、Ⅲ中均包含的操作名称是过滤,通过过滤把固体和液体分离。(2)滤液B中的溶质是没有 反应的硫酸锌和反应生成的硫酸亚铁(3)当观察到气泡不 再产生时,说明滤渣A中铁已经完全反应。(4)步骤Ⅲ中加 入的X是锌,锌和硫酸亚铁反应生成硫酸锌和铁。
14答案及解析:
答案:[实验回顾](1)①2Al+ 6HCl=2AlCl3 + 3H2↑ ②氢气难溶于水,不与水反应
(2)金属是否位于氢前面,位于氢前面的金属(钾、钙、钠除 外)能置换出盐酸和稀硫酸中的氢,位于氢后面的金属不能 置换出盐酸和稀硫酸中的氢
[交流与讨论](1) 4Al+3O2=2Al2O3 (2)用砂纸打磨
[实验探究](1) 2Al + 3HgCl2=2AlCl3+3Hg (2)上升
[实验结论] 2Al+ 6H2O=2Al(OH)3↓+ 3H2↑
[实验反思](1)关闭活塞K,容器内压强増大,把液体压回 烧杯,固体与液体分离,反应停止容器内充满氢气,铝无 法与氧气接触
解析:[实验回顾](1)①铝与稀盐酸反应生成氯化铝和 氢气,反应的化学方程式为2Al+ 6HCl=2AlCl3 + 3H2↑。②用B装置收集氢气的原因是氢气难溶于水,不与 水反应。(2)在金属活动性顺序里,金属能否置换出盐酸和 稀较酸中的氢。判断的依据是金属是否位于氢前面,位于氢 前面的金属(钾、钙、钠除外)能置换出盐酸和稀硫酸中的 氢,位于氢后面的金属不能置换出盐酸和稀硫酸中的氢。
[交流与讨论](1)铝与氧气反应生成氧化铝,反应的化学方 程式为4Al+3O2=2Al2O3。(2)除去铝表面氧化铝薄膜 时,可以用砂纸打磨。
[实验探究](1)铝与氯化汞溶液发生 置换反应生成氯化铝和汞,反应的化学方程式为2Al + 3HgCl2=2AlCl3+3Hg。(2)在导管口 a处涂肥皂水,发 现导管口有气泡形成,当气泡离开导管后,气泡上升,用燃 着的木条点燃气泡,发出爆鸣声,说明生成的气体是氢气。
[实验结论]铝与水反应生成氢氧化铝和氢气的化学方程式 为 2Al+ 6H2O=2Al(OH)3↓+ 3H2↑。
[实验反 思](1)图2装置内,在铝与水反应的过程中,若关闭导管上 的活塞K,反应停止,其原理是关闭活塞K,容器内压强增 大,把液体压回烧杯,固体与液体分离,反应停止;当再次打 开活塞K,反应继续,产生气泡。铝未能生成氧化铝,其原 因是容器内充满氢气.铝无法与氧气接触。
同课章节目录
