2019-2020学年九年级化学人教版(新)下册同步小练:溶液的浓度(解析版)
文档属性
| 名称 | 2019-2020学年九年级化学人教版(新)下册同步小练:溶液的浓度(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 303.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-14 21:40:58 | ||
图片预览


文档简介
2019-2020学年九年级化学人教版下册同步小练
溶液的浓度
1、下列关于“10%的硝酸钾溶液”含义的说法中,错误的是( )
A.100 g水中溶解了 10 g硝酸钾
B.100 g硝酸钾溶液中有10 g硝酸钾
C.将10 g硝酸钾溶于90 g水中所得的溶液
D.将硝酸钾与水按1 : 9的质量比配制的溶液
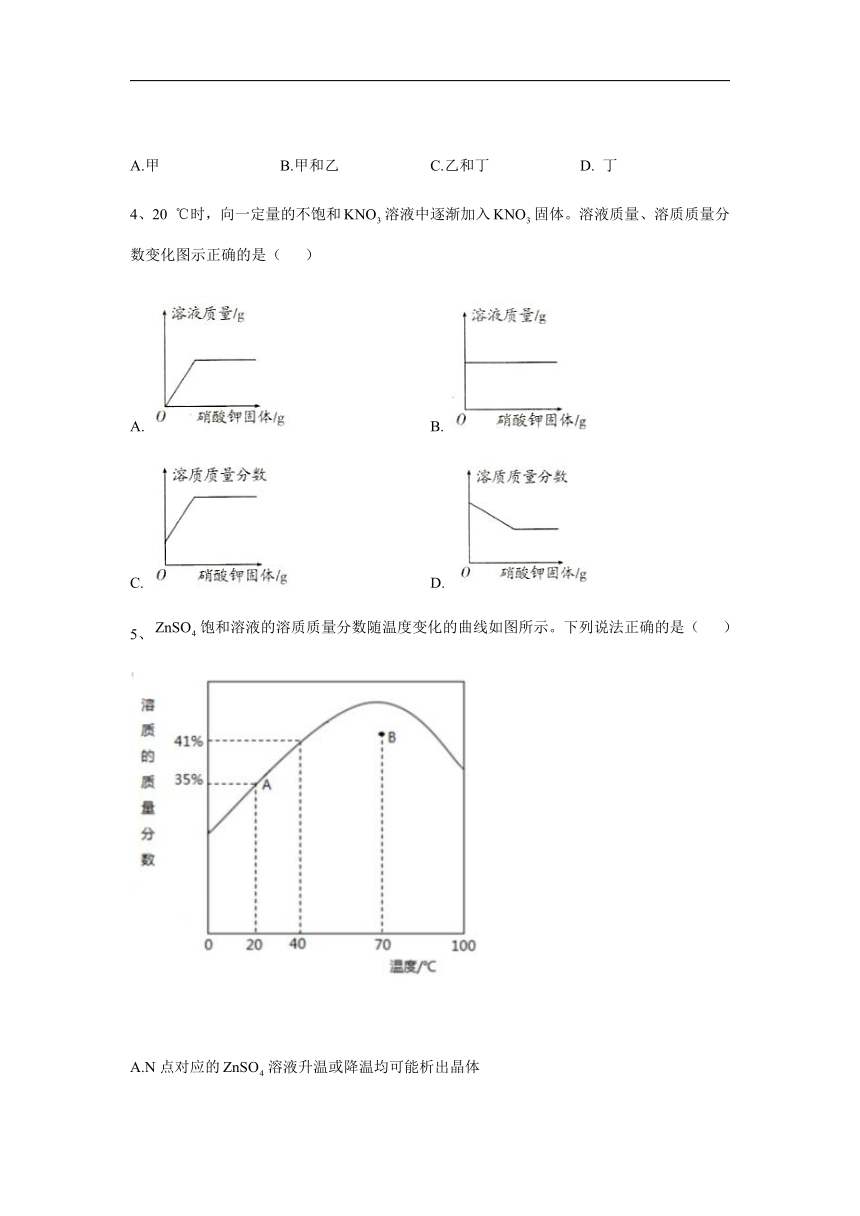
2、关于如图所示过氧化氢溶液的说法错误的是( )
A.500 g溶液中含溶质30 g
B.500 mL溶液的质量为550 g
C.500 mL溶液中溶质与溶剂的质量比为3:7
D.取出50 mL溶液,溶质质量分数仍为30%
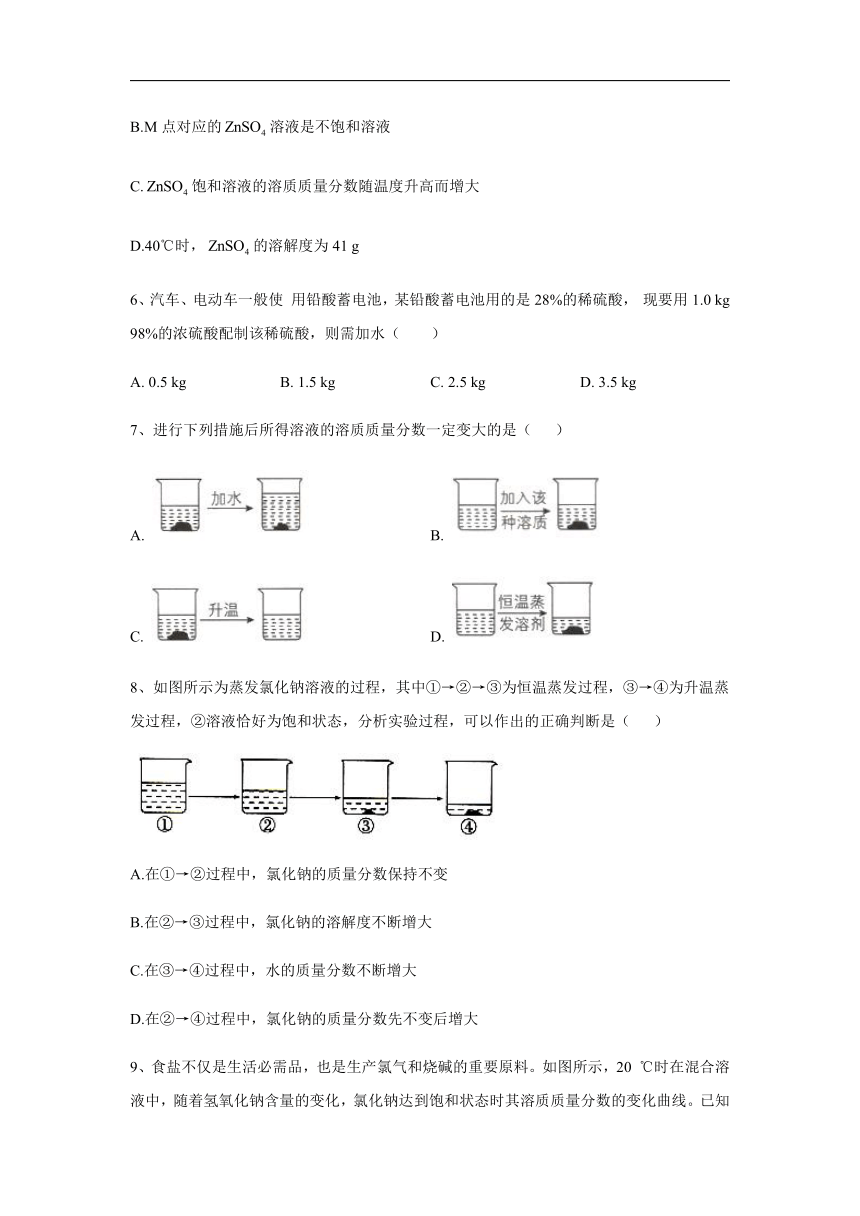
3、溶解度与溶质质量分数的区别和联系如图是恒温下模拟海水晒盐过程的示意图,与丙烧杯溶液的溶质质量分数一定相同的是( )
A.甲 B.甲和乙 C.乙和丁 D. 丁
4、20 ℃时,向一定量的不饱和溶液中逐渐加入固体。溶液质量、溶质质量分数变化图示正确的是( )
B.
C. D.
5、饱和溶液的溶质质量分数随温度变化的曲线如图所示。下列说法正确的是( )
A.N点对应的溶液升温或降温均可能析出晶体
B.M点对应的溶液是不饱和溶液
C.饱和溶液的溶质质量分数随温度升高而增大
D.40℃时,的溶解度为41 g
6、汽车、电动车一般使 用铅酸蓄电池,某铅酸蓄电池用的是28%的稀硫酸, 现要用1.0 kg 98%的浓硫酸配制该稀硫酸,则需加水( )
A. 0.5 kg B. 1.5 kg C. 2.5 kg D. 3.5 kg
7、进行下列措施后所得溶液的溶质质量分数一定变大的是( )
A. B.
C. D.
8、如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( )
A.在①→②过程中,氯化钠的质量分数保持不变
B.在②→③过程中,氯化钠的溶解度不断增大
C.在③→④过程中,水的质量分数不断增大
D.在②→④过程中,氯化钠的质量分数先不变后增大
9、食盐不仅是生活必需品,也是生产氯气和烧碱的重要原料。如图所示,20 ℃时在混合溶液中,随着氢氧化钠含量的变化,氯化钠达到饱和状态时其溶质质量分数的变化曲线。已知曲线上四个点的坐标分别为A(0,26.5)、B(14.0,15.0)、C( 18.8,11.7)、D(38.0,2.0)。下列说法正确的是( )
A.现有20℃时满足曲线上B点指标的溶液,可用蒸发水分降低氯化钠的质量分数
B.氯化钠的溶解度随温度升高而减小
C.c点处溶液中存在的粒子有Na+、Cl-、H2O
D. 20℃时,氯化钠在水中溶解度为26.5 g
10、压强为101k Pa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是( )
温度/℃ 10 20 30 60
溶解度/g 20.9 31.6 45.8 110
70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时,饱和溶液中溶质的质量分数为31.6%
C.60℃的饱和溶液降温至30℃,有晶体析出
D.的溶解度与压强大小无关
11、室温时,分别向盛有100 mL水的M、N两个烧杯中加入5 g、10 g硫酸铜均全部溶解,如图所示。则下列说法正确的是( )
A.M烧杯中溶液的颜色浅,溶质质量分数大
B.M烧杯中溶液的颜色深,溶质质量分数小
C.N烧杯中溶液的颜色深,溶质质量分数大
D.N烧杯中溶液的颜色浅,溶质质量分数小
12、根据下表回答问题。某物质在不同温度下的溶解度数据见下表:
温度/ 0 20 40 60 80
溶解度/g 12.6 15.3 20.0 25.0 42.0
(1)40时,150 g水最多能溶解该物质的质量是 g。
(2)如果要配制该物质溶质质量分数为20%的饱和溶液200 g,需要水 g,此时溶液的温度应为 。
(3)在20 时,将40 g该物质加人100 g水中,能形成溶液 g,再将此溶液升温到80 ,此时溶液成为 (填“饱和”或“不饱和”)溶液。
13、农业上常用质量分数为16%的NaCl溶液选种。实验室配制100 g该浓度溶液的过程如图所示。
请回答下列问题:
(1)配制该溶液正确的操作顺序为 (填步骤序号)。
(2)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 。
A增加适量氯化钠固体
B减少适量氯化钠固体
C.调节游码
D添加砝码
(3)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 。
(4)在配制一定浓度的氯化钠溶液时,下列操作会造成溶液的浓度偏小的是 。
①用量筒量取水时,俯视读数
②试剂、砝码的左右位置颠倒且使用游码
③用量筒量取水时,仰视读数
④用于溶解的烧杯中有少量的蒸馏水
⑤转移溶液时有部分液体溅出
14、将一种盐溶于水时,会使水的冰点(凝固点)降低,冰点降低多少与盐在溶 液中的质量分数有关。如果将此盐溶液降温,则在零度以下某温度会析出冰;但当盐在溶液中的质量分数比较大时,在将溶液冷却的过程中先析出的固体不是冰而是盐的晶体。如图所示,横坐标为氯化钙溶液中溶质的质量分数,纵坐标为温度。试填空或简答:
(1)氯化钙溶液可用作冷冻剂,当无水氯化钙与水混合的质量比为 时,冷却效果最好(填写最简整数比)。
(2)将10℃时38%的氯化钙溶液降温到-40℃时,下列有关说法正确的是 (填序号)。
A.此时溶液处于不饱和状态
B.溶液中已经有冰析出
C.溶液中析出了氯化钙晶体
D.此时氯化钙晶体和氯化钙饱和溶液共存
E此时冰、氯化钙晶体和氯化钙饱和溶液共存
答案以及解析
1答案及解析:
答案:A
解析:
2答案及解析:
答案:A
解析:500 g溶液中含溶质的质量为;500 mL溶液的质量为;溶质的质量分数为30%,溶液中溶质的质量与溶剂的质量之比为;溶液具有均一性,所以取出50 mL溶液,溶质质量分数仍为30%。
3答案及解析:
答案:D
解析:恒温说明NaCl的溶解度保持不变,如图所示,只有丙和 丁两只烧杯内有不溶物.说明丙和丁都是饱和溶液,因此,其 溶质质量分数一定相等。
4答案及解析:
答案:C
解析:在一定温度下,在一定量的溶剂里,硝酸钾的溶解能力是有一定的限度的,且根据“向一定量的不饱和溶液中逐渐加入固体”,溶液的质量不可能从0开始。
5答案及解析:
答案:A
解析:通过分析溶解度曲线可知,N点对应的溶液升温或降温均可能析出晶体,故A正确。M点在溶解度曲线上,对应的溶液是饱和溶液,故B错误。通过分析溶解度曲线可知,0~70℃,的溶解度随温度升高而增大;大于70℃时,的溶解度随温度升高而减小,故C错误。40℃时,饱和溶液的溶质质量分数为41%,溶解度大于41 g,故D错误。
6答案及解析:
答案:C
解析:设要加水的质量为x,根据溶液稀释前后溶质的质量不变,得 1.0 kg×98%=( 1.0 kg+x)×28%,解得:x = 2.5 kg。
7答案及解析:
答案:C
解析:过程中加水,溶液始终饱和,如果温度不变,溶质的质量分数不变,A错误;向溶液中加溶质,如果原溶液不饱和,溶质的质量分数变大,如果原溶液饱和,温度不变,溶质的质量分数 不变,B错误;过程中温度升高,溶质溶解,但是溶剂的质量不变, 溶质的质量分数变大,C正确;过程中恒温蒸发溶剂,如果原溶液 不饱和,溶质的质量分数变大,如果原溶液饱和,溶质的质量分数不变,D错误。
8答案及解析:
答案:D
解析:①溶液变为②溶液,没有晶体析出,所以①和②中溶质质量相等,在①→②过程中,溶剂质量减少,所以溶质质量分数②>①,故A说法错误;②③都是恒温蒸发得到的氯化钠的饱和溶液,所以②和③中溶液的温度不变,溶解度不变故B说法错误;在③→④过程中,升温蒸发水分,此时溶解度变大溶质的质量分数④>③,所以溶剂(水)的质量分数③④即溶剂质量分数减小,故C说法错误;②→③过程中氯化钠的溶解度不变,溶质质量分数不变,在③→④过程中,升温蒸发水分,溶解度变大,溶质的质量分数④③,故D说法正确。
9答案及解析:
答案:A
解析:根据曲线可知,当蒸发水分时,氢氧化钠的质量分数增大,則点氯化钠溶液中溶质质量分数减小,A正确;氯化钠的溶解度随着温度的升高而增大,B错误;C点处溶液中存在氯化 钠、氢氧化钠和水,故存在的粒子有:,C错误; 由点坐标可知,20℃时氯化钠饱和溶液的溶质质量分数为26.5%,设此时氯化钠的溶解度为x,则,解得x= 36.1g,D错误。
10答案及解析:
答案:C
解析:据题表可知,氨气的溶解度随温度升高而减小故A错误:20℃时,饱和溶液中溶质的质量分数为,故B错误;60℃的饱和溶液降温至30℃硝酸钾溶解度降低,有晶体析出,故正确:是气体气体的溶解度与压强大小有关,故D错误。
11答案及解析:
答案:C
解析:分别向盛有100 mL水的M、N两个烧杯中加入5 g、10 g硫酸铜均全部溶解,M中含有的溶质少,则溶液颜色浅,溶质质量分数小;N中含有的溶质多,溶液颜色深溶质质量分数大。
12答案及解析:
答案:(1)30 (2)160 ;60 (3)115.3;不饱和
解析:(1)40 时.该物质的溶解度为20. 0 g.即40 时.100 g水中最多溶解20 g溶质.則150 g水最多能溶解该物质的质量为。(2)200 g饱和溶液中溶质的质量为200 g×20% = 40g.配制该物盾的溶质质量分数为20%的饱和溶液200 g,需要 水的质量为200 g-40 g= 160 g;
设200 g 20%的饱和溶液在某溫度下的溶解度为s,
,s=25 g,
根据图表可知.在60时该物质的溶解度为25 g。
(3)20时.将40 g该物廣加入100 g水中,因为此溫度下 溶解度为15. 3 g,能形成溶液的质量= 100 g+15. 3 g = 115. 3 g.将该溶液升溫到80,此溫度下,其溶解度为 42 g.則得到的是不饱和溶液。
13答案及解析:
答案:(1)CBDEA
(2)B
(3)加速溶解
(4)②③④
解析:(1)配制一定溶质质量分数的氯化钠溶液的步骤:计算、称量、溶解、装瓶,所以正确的操作顺序为 CBDEA。
(2)用天平称量固体时,应遵循“左物右码的原则,托盘天平的指针偏向左盘,说明氯化钠固体多了,该减少适量氯化钠固体。
(3)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,目的是加速溶解。
(4)①用量筒量取水时俯视读数,实际量取的水的体积偏小,所得溶液的溶质质量分数偏大;②试剂、砝码的左右位置颠倒且使用游码,称取的氯化钠的质量偏小,所得溶液的溶质质量分数偏小;③用量筒量取水时,仰视读数,实际量取的水的体积偏大,所得溶液的溶质质量分数偏小;④用于溶解的烧杯中有少量的蒸馏水,水的体积偏大,所得溶液的溶质质量分数偏小;⑤溶液具有均一性,转移溶液时有部分液体溅出,溶液的溶质质量分数不变。
14答案及解析:
答案:(1)3: 7
(2)CD
解析: (1)用氯化钙溶液作冷冻剂,冷却效果最好的应该是使水凝固点最小的,由图可知,当氯化钙的质量分数为30%时水的凝固点最小,所以当氯化钙的质量分数为30%时溶液的冷却效果最好,此时无水氯化钙与水混合的质量比30% : 70% = 3 : 7。
(2)由图示可知,将10 ℃时38%的氯化钙溶液降温到-40℃时, 氯化钙溶液的溶质的质量分数减小,说明溶液中有氯化钙晶体析出,此时溶液处于饱和状态,此时氯化钙晶体和氯化钙饱和溶液共存;由图可知,-55℃时,才有冰析出,故此时溶液中没有冰析出;故CD正确。
同课章节目录
