人教化学选修3第三章第一节 晶体的常识----均摊法(共17张PPT)
文档属性
| 名称 | 人教化学选修3第三章第一节 晶体的常识----均摊法(共17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-14 08:51:08 | ||
图片预览





文档简介
(共62张PPT)
高二化学(选修3)第三章
请各组同学们用涂有不同颜色的小立方体作为晶胞,将其构建成为晶体。
要求:将立方体摆在化学书上,便于向
同学展示。
限时3min
NaCl晶体结构和晶胞
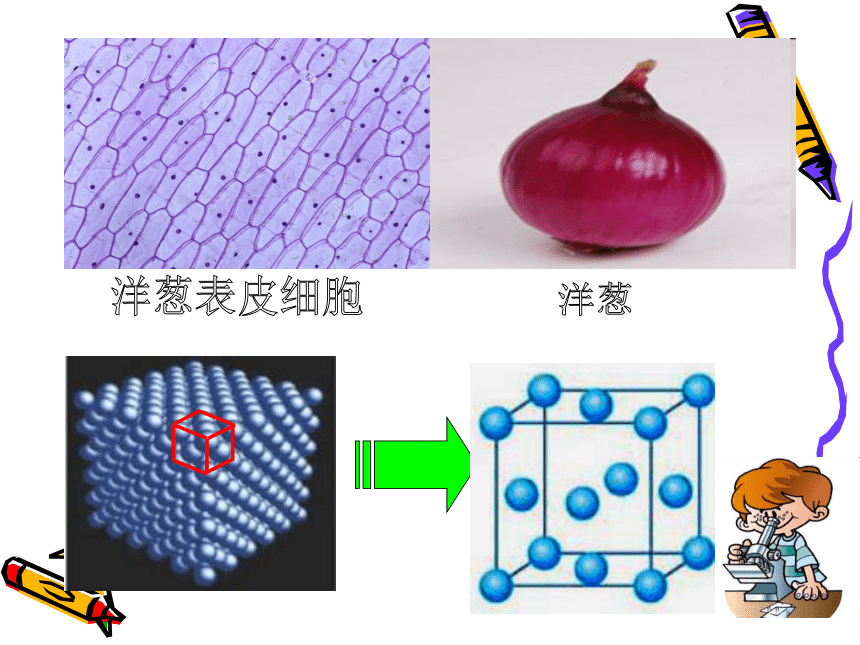
整块晶体可看作无数个晶胞“无隙并置”而成(晶胞间无间隙,平行排列)
请同学们利用手中现有的材料自制一个立方晶胞,并计算出晶胞中平均含有几个原子。
要求:
1、原子的位置可以在立方晶胞的顶点、棱、面、内
部的任意位置,且材料可以有剩余。
2、组内做好分工,把做好的模型画在白纸上,并计
算出晶胞中平均含有几个原子。(简要步骤)
3、由最快的四个小组上黑板展示,但不能雷同,并
由代表讲述计算过程。
限时5 min
2
1
体心:1
面上:1/2
顶点:1/8
棱上:1/4
由晶胞计算物质化学式的方法
三种典型立方晶胞结构
体心立方
5
1 、CO2的晶胞的示意图,数一数,它们分别平均含有几个分子?
4个分子12个原子
CO2
B
化学式:
A
2、根据离子晶体的晶胞结构,判断下列离子晶体的化学式:
C
ABC3
3. 下列是NaCl晶胞示意图,晶胞中Na+和Cl?的个数分别是多少?
Cl-
Na+
4
1/6
1/3
1/4
1/2
1
晶体结构 顶角 侧棱 水平棱 面上 体内
六棱柱
如图所示的是该化合物的晶体结构单元:镁原子在六棱柱的顶点和上下两个底面的面心,6个硼原子位于棱柱内。则该化合物的化学式可表示为( )
A、MgB B、 MgB2
C、Mg2B D、Mg3B2
B
课后作业:
利用你身边的相关材料,自制NaCl、CsCl、CaF2、金刚石晶胞,并比较他们有什么异同点?
高二化学(选修3)第三章
请各组同学们用涂有不同颜色的小立方体作为晶胞,将其构建成为晶体。
要求:将立方体摆在化学书上,便于向
同学展示。
限时3min
NaCl晶体结构和晶胞
整块晶体可看作无数个晶胞“无隙并置”而成(晶胞间无间隙,平行排列)
请同学们利用手中现有的材料自制一个立方晶胞,并计算出晶胞中平均含有几个原子。
要求:
1、原子的位置可以在立方晶胞的顶点、棱、面、内
部的任意位置,且材料可以有剩余。
2、组内做好分工,把做好的模型画在白纸上,并计
算出晶胞中平均含有几个原子。(简要步骤)
3、由最快的四个小组上黑板展示,但不能雷同,并
由代表讲述计算过程。
限时5 min
2
1
体心:1
面上:1/2
顶点:1/8
棱上:1/4
由晶胞计算物质化学式的方法
三种典型立方晶胞结构
体心立方
5
1 、CO2的晶胞的示意图,数一数,它们分别平均含有几个分子?
4个分子12个原子
CO2
B
化学式:
A
2、根据离子晶体的晶胞结构,判断下列离子晶体的化学式:
C
ABC3
3. 下列是NaCl晶胞示意图,晶胞中Na+和Cl?的个数分别是多少?
Cl-
Na+
4
1/6
1/3
1/4
1/2
1
晶体结构 顶角 侧棱 水平棱 面上 体内
六棱柱
如图所示的是该化合物的晶体结构单元:镁原子在六棱柱的顶点和上下两个底面的面心,6个硼原子位于棱柱内。则该化合物的化学式可表示为( )
A、MgB B、 MgB2
C、Mg2B D、Mg3B2
B
课后作业:
利用你身边的相关材料,自制NaCl、CsCl、CaF2、金刚石晶胞,并比较他们有什么异同点?
