人教版高一年级下册化学5.2氮及其化合物(4)人教版(65张ppt)
文档属性
| 名称 | 人教版高一年级下册化学5.2氮及其化合物(4)人教版(65张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 58.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-14 00:00:00 | ||
图片预览










文档简介
(共65张PPT)
第五章 第二节
氮及其化合物(4)
高一年级 化学
工业
硝酸被用来精炼金属以及合成硝化甘油、TNT炸药等
农业
医药
冠心病类治疗药物
皮肤病类治疗药物
请你思考
硝酸有哪些物理性质呢?
物理性质都包含哪些方面呢?
一、物理性质
无色的液体
一、物理性质
无色的液体
有刺激性气味,易挥发。
一、物理性质
无色的液体
有刺激性气味,易挥发。
可溶于水
变黄的浓硝酸
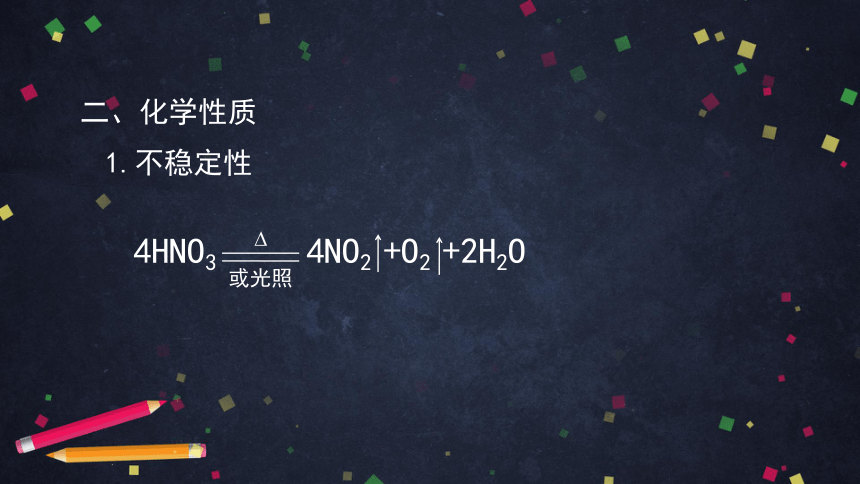
二、化学性质
1.不稳定性
二、化学性质
1.不稳定性
4HNO3 4NO2 +O2 +2H2O
?
或光照
既是氧化剂,
又是还原剂
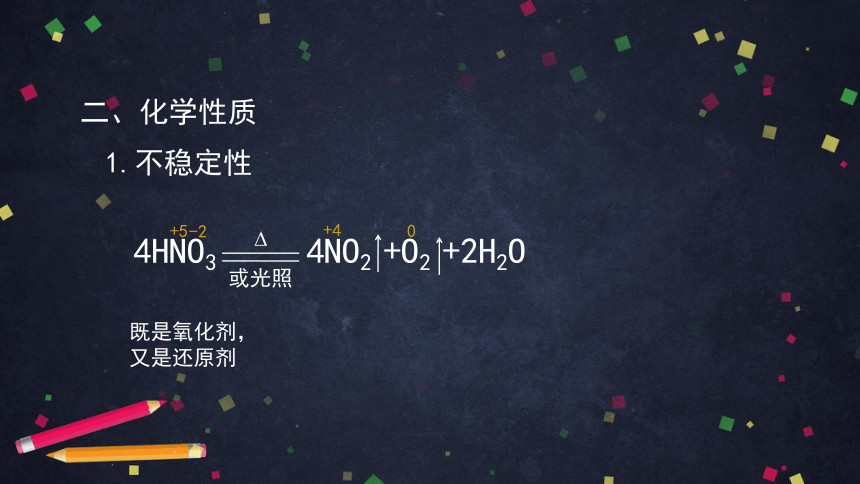
二、化学性质
1.不稳定性
4HNO3 4NO2 +O2 +2H2O
?
或光照
+5
-2
+4
0
化合价升高,失去4e-,被氧化
化合价降低,得到4e- ,被还原
二、化学性质
1.不稳定性
4HNO3 4NO2 +O2 +2H2O
?
或光照
保存在棕色试剂瓶中,并放置在阴冷处。
根据所学知识,请你推测硝酸还有哪些化学性质呢?
从氧化还原的角度
从物质类别的角度
根据所学知识,请你推测硝酸还有哪些化学性质呢?
从物质类别的角度判断,由于硝酸的电离,按酸的通性预测硝酸的性质
从物质类别的角度判断,由于硝酸的电离,按酸的通性预测硝酸的性质
能和指示剂反应
能和碱性氧化物反应
能和碱反应
能和盐反应
能和金属反应
与铁反应
与铁反应
与铜反应
铜与足量稀硝酸反应
一段时间
铜与浓硝酸反应
实验现象: 剧烈反应
产生红棕色气体
溶液变为绿色
铜片逐渐减少
还原剂
氧化剂
化学方程式
铜与浓硝酸反应
+2
+4
+5
0
Cu+4HNO3(浓) Cu(NO3)2+2NO2 +2H2O
铜与稀硝酸反应
实验现象: 缓慢反应
生成无色气体,接触空气后变红棕色
溶液变为蓝色
铜片逐渐减少
铜与稀硝酸反应
还原剂
氧化剂
化学方程式
3Cu+8HNO3(稀) 3Cu(NO3)2+2NO +4H2O
0
+5
+2
+2
铜和浓、稀硝酸反应的离子方程式
Cu + 4H++ 2NO3 Cu2+ + 2NO2 + 2H2O
-
3Cu + 8H+ + 2NO3 3Cu2++ 2NO + 4H2O
-
铜和浓、稀硝酸反应的离子方程式
化合价降低,得到2e-,被还原
化合价升高,失去2e-,被氧化
化合价降低,得到6e-,被还原
化合价升高,失去6e-,被氧化
Cu + 4H++ 2NO3 Cu2+ + 2NO2 + 2H2O
-
3Cu + 8H+ + 2NO3 3Cu2++ 2NO + 4H2O
-
铜和浓、稀硝酸反应的离子方程式
相同点:
表现氧化性的微粒
被还原的物质
硝酸根离子
铜
不同点:
所得产物中氮元素的价态不同
二、化学性质
2.强氧化性
硝酸根离子氧化性强弱与什么因素有关呢?
二、化学性质
2.强氧化性
从离子的浓度
硝酸根离子氧化性强弱与什么因素有关呢?
二、化学性质
2.强氧化性
从反应条件/反应环境
从离子的浓度
硝酸根离子氧化性强弱与什么因素有关呢?
二、化学性质
2.强氧化性
从反应条件/反应环境
资料一
Cu + H2SO4(稀) 不反应
Cu + NaNO3(aq) 不反应
资料一
Cu + NaNO3(aq)+ H2SO4(稀) 能反应生成一氧化氮
硝酸中起到氧化作用的微粒是什么?
该微粒的氧化性强弱和什么有关系?
离子的浓度越大,硝酸根离子氧化能力越强
硝酸根离子氧化性强弱与什么因素有关呢?
酸性环境中,硝酸根离子的氧化能力强
常温下,为什么铁和浓硝酸不继续反应?
钝化现象
铁、铝与浓硝酸、浓硫酸在常温下会发生钝化现象。
浓硝酸和浓硫酸分别与铜等物质反应的比较。
浓硝酸 浓硫酸
化学方程式 Cu+4HNO3(浓)
Cu(NO3)2+2NO2 +2H2O Cu+2H2SO4(浓)
CuSO4+SO2 +2H2O
相同点
?
浓硝酸和浓硫酸分别与铜等物质反应的比较。
浓硝酸 浓硫酸
化学方程式 Cu+4HNO3(浓)
Cu(NO3)2+2NO2 +2H2O Cu+2H2SO4(浓)
CuSO4+SO2 +2H2O
相同点 1.都是除氢、氧元素之外的元素化合价降低。
?
浓硝酸和浓硫酸分别与铜等物质反应的比较。
浓硝酸 浓硫酸
化学方程式 Cu+4HNO3(浓)
Cu(NO3)2+2NO2 +2H2O Cu+2H2SO4(浓)
CuSO4+SO2 +2H2O
相同点 1.都是除氢、氧元素之外的元素化合价降低。
2.都能与不活泼金属(如铜、汞)以及一些非金属单质等反应。
?
浓硝酸和浓硫酸分别与铜等物质反应的比较。
浓硝酸 浓硫酸
化学方程式 Cu+4HNO3(浓)
Cu(NO3)2+2NO2 +2H2O Cu+2H2SO4(浓)
CuSO4+SO2 +2H2O
相同点 1.都是除氢、氧元素之外的元素化合价降低。
2.都能与不活泼金属(如铜、汞)以及一些非金属单质等反应。
3.常温下与铁、铝都能发生钝化现象
?
从氧化还原的角度
从物质类别的角度
具有酸性
具有强氧化性
其他
具有不稳定性
二、化学性质
从氧化还原的角度
从物质类别的角度
具有酸性
具有强氧化性
其他
具有不稳定性
三、用途
硝酸盐类氮肥
从氧化还原的角度
从物质类别的角度
具有酸性
具有强氧化性
其他
具有不稳定性
精炼金属
清洗玻璃仪器上的银
三、用途
从氧化还原的角度
从物质类别的角度
具有酸性
具有强氧化性
其他
具有不稳定性
精炼金属
清洗玻璃仪器上的银
三、用途
有两位科学家,劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,玻尔在匈牙利化学家赫维西的帮助下:将奖牌放入“王水”中,纯金奖牌便溶解了。玻尔于是将试剂瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,试剂瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造。
四、硝酸的工业制法
1.硝酸制取的发展史
17世纪中叶 德国人格劳贝尔用硝石和浓硫酸混合
1905年 挪威 电弧法 最早的工业化
1913年 合成氨问世了,工业化阶段
2.硝酸工业制法原理
N2 NH3 NO NO2 HNO3
+O2
+H2O
+O2
+H2
第一步:工业合成氨
N2+3H2 2NH3
高温、高压
催化剂
2.硝酸工业制法原理
N2 NH3 NO NO2 HNO3
+O2
+H2O
+O2
+H2
第二步:氨气在催化剂的作用下与氧气发生反应生成一氧化氮
4NH3 + 5O2 4NO + 6H2O
催化剂
?
2.硝酸工业制法原理
N2 NH3 NO NO2 HNO3
+O2
+H2O
+O2
+H2
第三步:一氧化氮被氧气氧化成二氧化氮
2NO+O2 2NO2
2.硝酸工业制法原理
N2 NH3 NO NO2 HNO3
+O2
+H2O
+O2
+H2
第四步:用水吸收二氧化氮生成硝酸
3NO2+H2O 2HNO3+NO
2.硝酸工业制法原理
N2 NH3 NO NO2 HNO3
+O2
+H2O
+O2
+H2
3NO2+H2O 2HNO3+NO
2.硝酸工业制法原理
N2+3H2 2NH3
高温、高压
催化剂
4NH3 + 5O2 4NO + 6H2O
催化剂
?
2NO+O2 2NO2
-3
0
-3
+2
+2
+4
+4
+5
+2
【小结】
一、物理性质
二、化学性质
1.不稳定性
2.强氧化性
3.酸性
三、用途
四、工业制法
某路段铝罐车发生硝酸泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。抢险人员运来熟石灰进行处理,以便防止其扩散并污染附近的农田。
六、典型例题
例.
通过这段资料,你能找到涉及了硝酸的哪些性质吗?
某路段铝罐车发生硝酸泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。抢险人员运来熟石灰进行处理,以便防止其扩散并污染附近的农田。
例.如何鉴别浓硝酸、浓硫酸?
五、典型例题
①找不同现象
一般步骤
五、典型例题
例.如何鉴别浓硝酸、浓硫酸?
①找不同现象
②先简单后复杂、
一般步骤
先物理方法后化学方法
五、典型例题
例.如何鉴别浓硝酸、浓硫酸?
①找不同现象
②先简单后复杂、
③加试剂前要取样
一般步骤
先物理方法后化学方法
五、典型例题
例.如何鉴别浓硝酸、浓硫酸?
五、典型例题
例.如何鉴别浓硝酸、浓硫酸?
HNO3
H2SO4
无色,有刺激性气味
易挥发
化学性质
物理性质
无色,粘稠油状,
难挥发
强氧化性
不稳定性
酸性
强氧化性
脱水性
五、典型例题
物理性质的差异
化学性质的差异
例.如何鉴别浓硝酸、浓硫酸?
五、典型例题
打开盛有浓硝酸试剂瓶的瓶盖,瓶口处有白雾
物理性质的差异
例.如何鉴别浓硝酸、浓硫酸?
五、典型例题
与铜反应,常温硝酸更剧烈,生成红棕色气体
化学性质的差异
物理性质的差异
打开盛有浓硝酸试剂瓶的瓶盖,瓶口处有白雾
例.如何鉴别浓硝酸、浓硫酸?
第五章 第二节
氮及其化合物(4)
高一年级 化学
工业
硝酸被用来精炼金属以及合成硝化甘油、TNT炸药等
农业
医药
冠心病类治疗药物
皮肤病类治疗药物
请你思考
硝酸有哪些物理性质呢?
物理性质都包含哪些方面呢?
一、物理性质
无色的液体
一、物理性质
无色的液体
有刺激性气味,易挥发。
一、物理性质
无色的液体
有刺激性气味,易挥发。
可溶于水
变黄的浓硝酸
二、化学性质
1.不稳定性
二、化学性质
1.不稳定性
4HNO3 4NO2 +O2 +2H2O
?
或光照
既是氧化剂,
又是还原剂
二、化学性质
1.不稳定性
4HNO3 4NO2 +O2 +2H2O
?
或光照
+5
-2
+4
0
化合价升高,失去4e-,被氧化
化合价降低,得到4e- ,被还原
二、化学性质
1.不稳定性
4HNO3 4NO2 +O2 +2H2O
?
或光照
保存在棕色试剂瓶中,并放置在阴冷处。
根据所学知识,请你推测硝酸还有哪些化学性质呢?
从氧化还原的角度
从物质类别的角度
根据所学知识,请你推测硝酸还有哪些化学性质呢?
从物质类别的角度判断,由于硝酸的电离,按酸的通性预测硝酸的性质
从物质类别的角度判断,由于硝酸的电离,按酸的通性预测硝酸的性质
能和指示剂反应
能和碱性氧化物反应
能和碱反应
能和盐反应
能和金属反应
与铁反应
与铁反应
与铜反应
铜与足量稀硝酸反应
一段时间
铜与浓硝酸反应
实验现象: 剧烈反应
产生红棕色气体
溶液变为绿色
铜片逐渐减少
还原剂
氧化剂
化学方程式
铜与浓硝酸反应
+2
+4
+5
0
Cu+4HNO3(浓) Cu(NO3)2+2NO2 +2H2O
铜与稀硝酸反应
实验现象: 缓慢反应
生成无色气体,接触空气后变红棕色
溶液变为蓝色
铜片逐渐减少
铜与稀硝酸反应
还原剂
氧化剂
化学方程式
3Cu+8HNO3(稀) 3Cu(NO3)2+2NO +4H2O
0
+5
+2
+2
铜和浓、稀硝酸反应的离子方程式
Cu + 4H++ 2NO3 Cu2+ + 2NO2 + 2H2O
-
3Cu + 8H+ + 2NO3 3Cu2++ 2NO + 4H2O
-
铜和浓、稀硝酸反应的离子方程式
化合价降低,得到2e-,被还原
化合价升高,失去2e-,被氧化
化合价降低,得到6e-,被还原
化合价升高,失去6e-,被氧化
Cu + 4H++ 2NO3 Cu2+ + 2NO2 + 2H2O
-
3Cu + 8H+ + 2NO3 3Cu2++ 2NO + 4H2O
-
铜和浓、稀硝酸反应的离子方程式
相同点:
表现氧化性的微粒
被还原的物质
硝酸根离子
铜
不同点:
所得产物中氮元素的价态不同
二、化学性质
2.强氧化性
硝酸根离子氧化性强弱与什么因素有关呢?
二、化学性质
2.强氧化性
从离子的浓度
硝酸根离子氧化性强弱与什么因素有关呢?
二、化学性质
2.强氧化性
从反应条件/反应环境
从离子的浓度
硝酸根离子氧化性强弱与什么因素有关呢?
二、化学性质
2.强氧化性
从反应条件/反应环境
资料一
Cu + H2SO4(稀) 不反应
Cu + NaNO3(aq) 不反应
资料一
Cu + NaNO3(aq)+ H2SO4(稀) 能反应生成一氧化氮
硝酸中起到氧化作用的微粒是什么?
该微粒的氧化性强弱和什么有关系?
离子的浓度越大,硝酸根离子氧化能力越强
硝酸根离子氧化性强弱与什么因素有关呢?
酸性环境中,硝酸根离子的氧化能力强
常温下,为什么铁和浓硝酸不继续反应?
钝化现象
铁、铝与浓硝酸、浓硫酸在常温下会发生钝化现象。
浓硝酸和浓硫酸分别与铜等物质反应的比较。
浓硝酸 浓硫酸
化学方程式 Cu+4HNO3(浓)
Cu(NO3)2+2NO2 +2H2O Cu+2H2SO4(浓)
CuSO4+SO2 +2H2O
相同点
?
浓硝酸和浓硫酸分别与铜等物质反应的比较。
浓硝酸 浓硫酸
化学方程式 Cu+4HNO3(浓)
Cu(NO3)2+2NO2 +2H2O Cu+2H2SO4(浓)
CuSO4+SO2 +2H2O
相同点 1.都是除氢、氧元素之外的元素化合价降低。
?
浓硝酸和浓硫酸分别与铜等物质反应的比较。
浓硝酸 浓硫酸
化学方程式 Cu+4HNO3(浓)
Cu(NO3)2+2NO2 +2H2O Cu+2H2SO4(浓)
CuSO4+SO2 +2H2O
相同点 1.都是除氢、氧元素之外的元素化合价降低。
2.都能与不活泼金属(如铜、汞)以及一些非金属单质等反应。
?
浓硝酸和浓硫酸分别与铜等物质反应的比较。
浓硝酸 浓硫酸
化学方程式 Cu+4HNO3(浓)
Cu(NO3)2+2NO2 +2H2O Cu+2H2SO4(浓)
CuSO4+SO2 +2H2O
相同点 1.都是除氢、氧元素之外的元素化合价降低。
2.都能与不活泼金属(如铜、汞)以及一些非金属单质等反应。
3.常温下与铁、铝都能发生钝化现象
?
从氧化还原的角度
从物质类别的角度
具有酸性
具有强氧化性
其他
具有不稳定性
二、化学性质
从氧化还原的角度
从物质类别的角度
具有酸性
具有强氧化性
其他
具有不稳定性
三、用途
硝酸盐类氮肥
从氧化还原的角度
从物质类别的角度
具有酸性
具有强氧化性
其他
具有不稳定性
精炼金属
清洗玻璃仪器上的银
三、用途
从氧化还原的角度
从物质类别的角度
具有酸性
具有强氧化性
其他
具有不稳定性
精炼金属
清洗玻璃仪器上的银
三、用途
有两位科学家,劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,玻尔在匈牙利化学家赫维西的帮助下:将奖牌放入“王水”中,纯金奖牌便溶解了。玻尔于是将试剂瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,试剂瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造。
四、硝酸的工业制法
1.硝酸制取的发展史
17世纪中叶 德国人格劳贝尔用硝石和浓硫酸混合
1905年 挪威 电弧法 最早的工业化
1913年 合成氨问世了,工业化阶段
2.硝酸工业制法原理
N2 NH3 NO NO2 HNO3
+O2
+H2O
+O2
+H2
第一步:工业合成氨
N2+3H2 2NH3
高温、高压
催化剂
2.硝酸工业制法原理
N2 NH3 NO NO2 HNO3
+O2
+H2O
+O2
+H2
第二步:氨气在催化剂的作用下与氧气发生反应生成一氧化氮
4NH3 + 5O2 4NO + 6H2O
催化剂
?
2.硝酸工业制法原理
N2 NH3 NO NO2 HNO3
+O2
+H2O
+O2
+H2
第三步:一氧化氮被氧气氧化成二氧化氮
2NO+O2 2NO2
2.硝酸工业制法原理
N2 NH3 NO NO2 HNO3
+O2
+H2O
+O2
+H2
第四步:用水吸收二氧化氮生成硝酸
3NO2+H2O 2HNO3+NO
2.硝酸工业制法原理
N2 NH3 NO NO2 HNO3
+O2
+H2O
+O2
+H2
3NO2+H2O 2HNO3+NO
2.硝酸工业制法原理
N2+3H2 2NH3
高温、高压
催化剂
4NH3 + 5O2 4NO + 6H2O
催化剂
?
2NO+O2 2NO2
-3
0
-3
+2
+2
+4
+4
+5
+2
【小结】
一、物理性质
二、化学性质
1.不稳定性
2.强氧化性
3.酸性
三、用途
四、工业制法
某路段铝罐车发生硝酸泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。抢险人员运来熟石灰进行处理,以便防止其扩散并污染附近的农田。
六、典型例题
例.
通过这段资料,你能找到涉及了硝酸的哪些性质吗?
某路段铝罐车发生硝酸泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。抢险人员运来熟石灰进行处理,以便防止其扩散并污染附近的农田。
例.如何鉴别浓硝酸、浓硫酸?
五、典型例题
①找不同现象
一般步骤
五、典型例题
例.如何鉴别浓硝酸、浓硫酸?
①找不同现象
②先简单后复杂、
一般步骤
先物理方法后化学方法
五、典型例题
例.如何鉴别浓硝酸、浓硫酸?
①找不同现象
②先简单后复杂、
③加试剂前要取样
一般步骤
先物理方法后化学方法
五、典型例题
例.如何鉴别浓硝酸、浓硫酸?
五、典型例题
例.如何鉴别浓硝酸、浓硫酸?
HNO3
H2SO4
无色,有刺激性气味
易挥发
化学性质
物理性质
无色,粘稠油状,
难挥发
强氧化性
不稳定性
酸性
强氧化性
脱水性
五、典型例题
物理性质的差异
化学性质的差异
例.如何鉴别浓硝酸、浓硫酸?
五、典型例题
打开盛有浓硝酸试剂瓶的瓶盖,瓶口处有白雾
物理性质的差异
例.如何鉴别浓硝酸、浓硫酸?
五、典型例题
与铜反应,常温硝酸更剧烈,生成红棕色气体
化学性质的差异
物理性质的差异
打开盛有浓硝酸试剂瓶的瓶盖,瓶口处有白雾
例.如何鉴别浓硝酸、浓硫酸?
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
