人教版高二化学选修3第三章第3节 金属晶体(共22张PPT)
文档属性
| 名称 | 人教版高二化学选修3第三章第3节 金属晶体(共22张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-15 00:00:00 | ||
图片预览








文档简介
(共22张PPT)
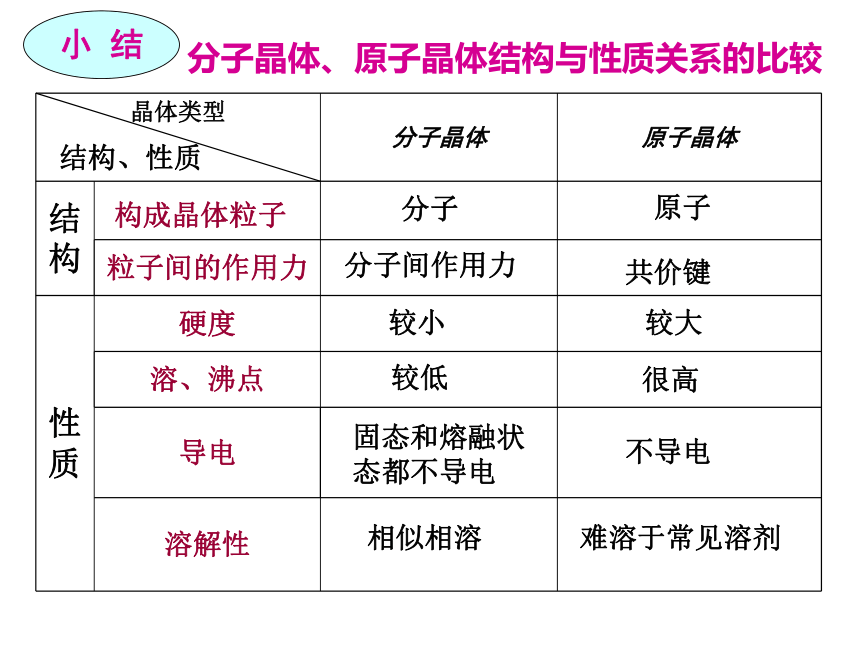
分子晶体、原子晶体结构与性质关系的比较
晶体类型 分子晶体 原子晶体
结
构
粒子间的作用力
性
质 硬度
溶、沸点
导电
溶解性
构成晶体粒子
分子
原子
分子间作用力
共价键
结构、性质
较小
较大
较低
很高
固态和熔融状态都不导电
不导电
相似相溶
难溶于常见溶剂
小 结
Ti
金属样品
金属概论
1、金属分类
贵金属、
稀土金属
2、金属物理通性:
(1)大多数金属呈银白色,有金属光泽; 金属中除汞常温为液态外,其余均为固态;
(2)密度、硬度、熔点差别大;
(3)导电性、导热性一般较强;
(4)延展性。
一、金属键
第三节 金属晶体
1、金属键
金属离子和自由电子之间的强烈的相互作用,叫金属键。
①成键微粒是金属阳离子和自由电子。
②金属键存在于金属单质和合金中。
(2)金属键特征:
①成键电子可以在整块金属中自由流动;
②金属键既没方向性,又没饱和性。
② 金属阳离子所带电荷(价电子数)越多,金属键越强。
(3)影响金属键强弱的因素:
① 金属阳离子半径越小,金属键越强;
(1)定义:
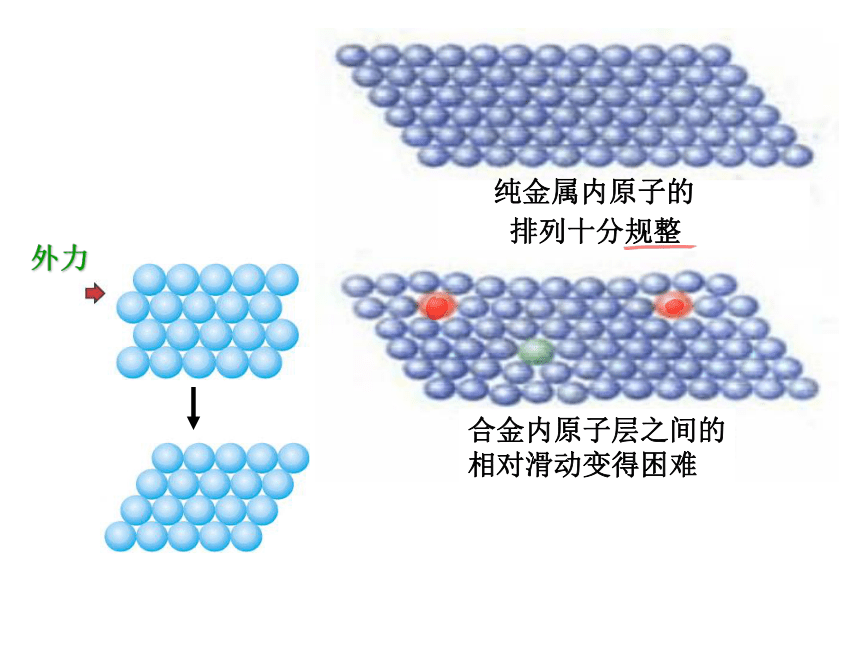
? 导电性 导热性 延展性
金属离子和自由电子 自由电子在外加电场的作用下发生定向移动 自由电子与金属离子碰撞传递热量 晶体中各原子层相对滑动仍保持相互作用
2、电子气理论及其对金属物理共性的解释
电子气理论的要点:
◆1、构成金属的粒子:金属离子和自由电子;
◆2、 自由电子:在整块金属中自由流动,形成整块金属
的“电子气”;
◆3、金属离子:在整块金属中分层堆积,浸泡于“电子气”
的汪洋之中。
外力
纯金属内原子的
排列十分规整
合金内原子层之间的
相对滑动变得困难
注意:在晶体中,
不存在单个分子。
3、金属晶体
(2)组成粒子:
金属阳离子和自由电子
(3)微粒间作用力:
金属键
(1)概念:通过金属键结合而成的单质晶体。
(4)金属晶体熔化时,破坏的作用力:
金属键
讨论1:判断碱金属元素的熔沸点随原子序数的增大的变化,
试用金属键理论加以解释。
讨论2:试判断钠、镁、铝三种金属熔沸点和硬度的大小。
同主族元素价电子数相同(阳离子所带电荷数相同),从上到下,原子(离子)半径依次增大,则单质中所形成金属键依次减弱,故碱金属元素的熔沸点随原子序数的增大而递减。
同周期元素,从左到右,价电子数依次增大,原子(离子)半径依次减弱,则单质中所形成金属键依次增强,故钠、镁、铝三种金属熔沸点和硬度的大小顺序是:钠<镁<铝。
?
资料
金属之最
熔点最低的金属是--------
汞 [-38.87℃]
熔点最高的金属是--------
钨 [3410℃]
密度最小的金属是--------
锂 [0.53g/cm3]
密度最大的金属是--------
锇 [22.57g/cm3]
硬度最小的金属是--------
铯 [0.2]
硬度最大的金属是--------
铬 [9.0]
最活泼的金属是----------
铯
最稳定的金属是----------
金
延性最好的金属是--------
铂[铂丝直径: mm]
展性最好的金属是--------
金[金箔厚: mm]
三种晶体类型与性质的比较
晶体类型 原子晶体 分子晶体 金属晶体
概念 相邻原子之间以共价键相结合而成具有空间网状结构的晶体 分子间以分子间作用力相结合而成的晶体 通过金属键形成的晶体
作用力
构成微粒
物
理
性
质 熔沸点
硬度
导电性
实例 金刚石、二氧化硅、晶体硅、碳化硅 Ar、S等 Au、Fe、Cu、钢铁等
共价键
分子间作用力
金属键
原子
分子
金属阳离子和自由电子
很高
很低
差别较大
很大
很小
差别较大
无(硅为半导体)
无
导体
【知识回顾】
非密置层????
配位数=4
配位数=6
二、金属晶体的原子堆积模型
1、金属晶体的原子排列方式(二维空间)
(1)紧密堆积:微粒之间的作用力使微粒间尽可能的相互
接近,使它们占有最小的空间。
密置层
(2)配位数:在晶体中与每个微粒紧密相邻(一般指相切)
的微粒个数。
2. 金属晶体的原子堆积方式(三维空间)
(1)非密置层的堆积方式:
①简单立方堆积(Po型)
讨论1:该堆积方式中金属原子的配位数是多少?
空间利用率:晶体的空间被微粒占据的体积百分数,
用它来表示紧密堆积的程度。
讨论2:该堆积方式中金属原子占有晶胞体积的百分数是多少?
(1)非密置层的堆积方式:
②体心立方堆积(K型)
配位数
空间利用率
8
68%
a
b
a
(2)密置层的堆积方式:
配位数均为12
1
2
3
4
5
6
对第一层来讲最紧密的堆积方式是将球对准 1,3,5 位
( 或对准 2,4,6 位,其情形是一样的 )
1
2
3
4
5
6
A
B
,
关键是第三层,对第一、二层来说,第三层可以有两种最紧密的堆积方式。
密置层的两种堆积方式:
①六方最密堆积(Mg型)
A
B
A
B
A
1
2
3
4
5
6
每两层形成一个周期,即ABAB堆积方式,形成六方紧密堆积,即镁型堆积。
配位数 。 ( 同层 ,上下层各 。 )
12
6
3
①六方最密堆积(Mg型)
配位数 12
空间利用率
74%
②面心立方最密堆积(Cu型)
1
2
3
4
5
6
A
B
C
A
A
B
C
每三层形成一个周期,即ABCABC堆积方式,形成面心立方紧密堆积,即铜型堆积。
配位数 。
( 同层 , 上下层各 )
12
6
3
②面心立方最密堆积(Cu型)
配位数 12
空间利用率
74%
铜型 [面心立方]
B
C
A
(ⅠB Pb Pd Pt )
性质:熔点高(高于金刚石),硬度小,可导电 。
石墨晶体
石墨晶体是层状结构:
层内C原子以共价键结合成平面网状结构,
层间以范德华力结合。
----混合型晶体(过渡型晶体)
每个C与3个C形成C—C键,构成正六边形,
键长相等,键角相等(均为120°);
C原子个数与C—C键数之比为:
每个正六边形平均只占有6×(1/3)=2个C
1﹕3×(1/2)=2﹕3
金属钠晶体为体心立方堆积(如图),实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),则钠原子的半径r(cm)为?( )
??????????????
?A . ?????????????? ???????? ? B.? ??????????
?
C.??? ???????????????? ??? ? D . ???????????
分子晶体、原子晶体结构与性质关系的比较
晶体类型 分子晶体 原子晶体
结
构
粒子间的作用力
性
质 硬度
溶、沸点
导电
溶解性
构成晶体粒子
分子
原子
分子间作用力
共价键
结构、性质
较小
较大
较低
很高
固态和熔融状态都不导电
不导电
相似相溶
难溶于常见溶剂
小 结
Ti
金属样品
金属概论
1、金属分类
贵金属、
稀土金属
2、金属物理通性:
(1)大多数金属呈银白色,有金属光泽; 金属中除汞常温为液态外,其余均为固态;
(2)密度、硬度、熔点差别大;
(3)导电性、导热性一般较强;
(4)延展性。
一、金属键
第三节 金属晶体
1、金属键
金属离子和自由电子之间的强烈的相互作用,叫金属键。
①成键微粒是金属阳离子和自由电子。
②金属键存在于金属单质和合金中。
(2)金属键特征:
①成键电子可以在整块金属中自由流动;
②金属键既没方向性,又没饱和性。
② 金属阳离子所带电荷(价电子数)越多,金属键越强。
(3)影响金属键强弱的因素:
① 金属阳离子半径越小,金属键越强;
(1)定义:
? 导电性 导热性 延展性
金属离子和自由电子 自由电子在外加电场的作用下发生定向移动 自由电子与金属离子碰撞传递热量 晶体中各原子层相对滑动仍保持相互作用
2、电子气理论及其对金属物理共性的解释
电子气理论的要点:
◆1、构成金属的粒子:金属离子和自由电子;
◆2、 自由电子:在整块金属中自由流动,形成整块金属
的“电子气”;
◆3、金属离子:在整块金属中分层堆积,浸泡于“电子气”
的汪洋之中。
外力
纯金属内原子的
排列十分规整
合金内原子层之间的
相对滑动变得困难
注意:在晶体中,
不存在单个分子。
3、金属晶体
(2)组成粒子:
金属阳离子和自由电子
(3)微粒间作用力:
金属键
(1)概念:通过金属键结合而成的单质晶体。
(4)金属晶体熔化时,破坏的作用力:
金属键
讨论1:判断碱金属元素的熔沸点随原子序数的增大的变化,
试用金属键理论加以解释。
讨论2:试判断钠、镁、铝三种金属熔沸点和硬度的大小。
同主族元素价电子数相同(阳离子所带电荷数相同),从上到下,原子(离子)半径依次增大,则单质中所形成金属键依次减弱,故碱金属元素的熔沸点随原子序数的增大而递减。
同周期元素,从左到右,价电子数依次增大,原子(离子)半径依次减弱,则单质中所形成金属键依次增强,故钠、镁、铝三种金属熔沸点和硬度的大小顺序是:钠<镁<铝。
?
资料
金属之最
熔点最低的金属是--------
汞 [-38.87℃]
熔点最高的金属是--------
钨 [3410℃]
密度最小的金属是--------
锂 [0.53g/cm3]
密度最大的金属是--------
锇 [22.57g/cm3]
硬度最小的金属是--------
铯 [0.2]
硬度最大的金属是--------
铬 [9.0]
最活泼的金属是----------
铯
最稳定的金属是----------
金
延性最好的金属是--------
铂[铂丝直径: mm]
展性最好的金属是--------
金[金箔厚: mm]
三种晶体类型与性质的比较
晶体类型 原子晶体 分子晶体 金属晶体
概念 相邻原子之间以共价键相结合而成具有空间网状结构的晶体 分子间以分子间作用力相结合而成的晶体 通过金属键形成的晶体
作用力
构成微粒
物
理
性
质 熔沸点
硬度
导电性
实例 金刚石、二氧化硅、晶体硅、碳化硅 Ar、S等 Au、Fe、Cu、钢铁等
共价键
分子间作用力
金属键
原子
分子
金属阳离子和自由电子
很高
很低
差别较大
很大
很小
差别较大
无(硅为半导体)
无
导体
【知识回顾】
非密置层????
配位数=4
配位数=6
二、金属晶体的原子堆积模型
1、金属晶体的原子排列方式(二维空间)
(1)紧密堆积:微粒之间的作用力使微粒间尽可能的相互
接近,使它们占有最小的空间。
密置层
(2)配位数:在晶体中与每个微粒紧密相邻(一般指相切)
的微粒个数。
2. 金属晶体的原子堆积方式(三维空间)
(1)非密置层的堆积方式:
①简单立方堆积(Po型)
讨论1:该堆积方式中金属原子的配位数是多少?
空间利用率:晶体的空间被微粒占据的体积百分数,
用它来表示紧密堆积的程度。
讨论2:该堆积方式中金属原子占有晶胞体积的百分数是多少?
(1)非密置层的堆积方式:
②体心立方堆积(K型)
配位数
空间利用率
8
68%
a
b
a
(2)密置层的堆积方式:
配位数均为12
1
2
3
4
5
6
对第一层来讲最紧密的堆积方式是将球对准 1,3,5 位
( 或对准 2,4,6 位,其情形是一样的 )
1
2
3
4
5
6
A
B
,
关键是第三层,对第一、二层来说,第三层可以有两种最紧密的堆积方式。
密置层的两种堆积方式:
①六方最密堆积(Mg型)
A
B
A
B
A
1
2
3
4
5
6
每两层形成一个周期,即ABAB堆积方式,形成六方紧密堆积,即镁型堆积。
配位数 。 ( 同层 ,上下层各 。 )
12
6
3
①六方最密堆积(Mg型)
配位数 12
空间利用率
74%
②面心立方最密堆积(Cu型)
1
2
3
4
5
6
A
B
C
A
A
B
C
每三层形成一个周期,即ABCABC堆积方式,形成面心立方紧密堆积,即铜型堆积。
配位数 。
( 同层 , 上下层各 )
12
6
3
②面心立方最密堆积(Cu型)
配位数 12
空间利用率
74%
铜型 [面心立方]
B
C
A
(ⅠB Pb Pd Pt )
性质:熔点高(高于金刚石),硬度小,可导电 。
石墨晶体
石墨晶体是层状结构:
层内C原子以共价键结合成平面网状结构,
层间以范德华力结合。
----混合型晶体(过渡型晶体)
每个C与3个C形成C—C键,构成正六边形,
键长相等,键角相等(均为120°);
C原子个数与C—C键数之比为:
每个正六边形平均只占有6×(1/3)=2个C
1﹕3×(1/2)=2﹕3
金属钠晶体为体心立方堆积(如图),实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),则钠原子的半径r(cm)为?( )
??????????????
?A . ?????????????? ???????? ? B.? ??????????
?
C.??? ???????????????? ??? ? D . ???????????
