高考化学分类复习:物质结构元素周期律课件-30张
文档属性
| 名称 | 高考化学分类复习:物质结构元素周期律课件-30张 |

|
|
| 格式 | zip | ||
| 文件大小 | 771.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-15 00:00:00 | ||
图片预览










文档简介
(共30张PPT)
物质结构 元素周期律
-null-
-null-
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
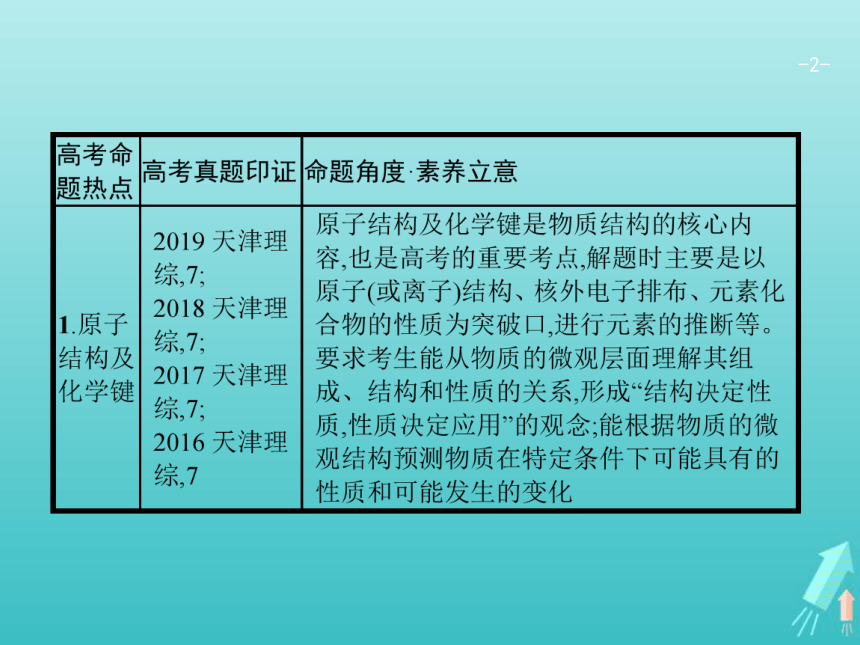
原子结构及化学键
1.构成原子或离子的粒子间的数量关系
(1)如在 中:质量数(A)=质子数(Z)+中子数(N)
(2)核电荷数=质子数=原子的核外电子数
(3)阳离子(Mn+):核电荷数=质子数=离子核外电子数+电荷数(n)
(4)阴离子(Rn-):核电荷数=质子数=离子核外电子数-电荷数(n)
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
2.化学键与物质类别的关系
(1)只含非极性共价键的物质:某些非金属元素组成的单质(稀有气体除外)。如I2、N2、P4、金刚石、晶体硅等。
(2)只含有极性共价键的物质:一般是不同非金属元素组成的共价化合物。如HCl、NH3、SiO2、CS2等。
(3)既有极性键又有非极性键的物质。如H2O2、C2H4、CH3CH3、C6H6等。
(4)只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物。如Na2S、CsCl、K2O、NaH等。
(5)既有离子键又有非极性共价键的物质。如Na2O2、CaC2等。
(6)由极性共价键构成但又不是强电解质的物质。如HF等。
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
例1下列说法正确的是( )
①离子化合物中一定含离子键,也可能含共价键
②共价化合物中可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤构成单质分子的粒子不一定存在共价键
⑥不同元素组成的多原子分子里的化学键一定是极性键
⑦有化学键断裂的变化属于化学变化
A.①③⑤ B.②④⑥ C.①③④ D.③⑤⑦
A
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
解析:①离子化合物中一定含离子键,也可能含极性键或非极性键,如NaOH中含离子键和O—H极性键,过氧化钠中含离子键和O—O非极性键,①正确;②共价化合物中一定含共价键,一定不含离子键,含离子键的化合物一定为离子化合物,②错误;③含金属元素的化合物不一定是离子化合物,如氯化铝为共价化合物,③正确;④由非金属元素组成的化合物不一定是共价化合物,如NH4Cl、(NH4)2SO4为离子化合物,④错误;⑤由分子构成的物质中不一定存在共价键,如稀有气体分子中不含化学键,⑤正确;⑥不同元素组成的多原子分子里的化学键,若为同种元素之间形成的是非极性共价键,不同元素之间形成的是极性共价键,⑥错误;⑦有旧化学键断裂和新化学键的生成的变化属于化学变化,有化学键断裂的变化不一定属于化学变化,如NaCl溶于水,离子键断裂,但属于物理变化,⑦错误;综上符合题意的有①③⑤,A项正确。
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
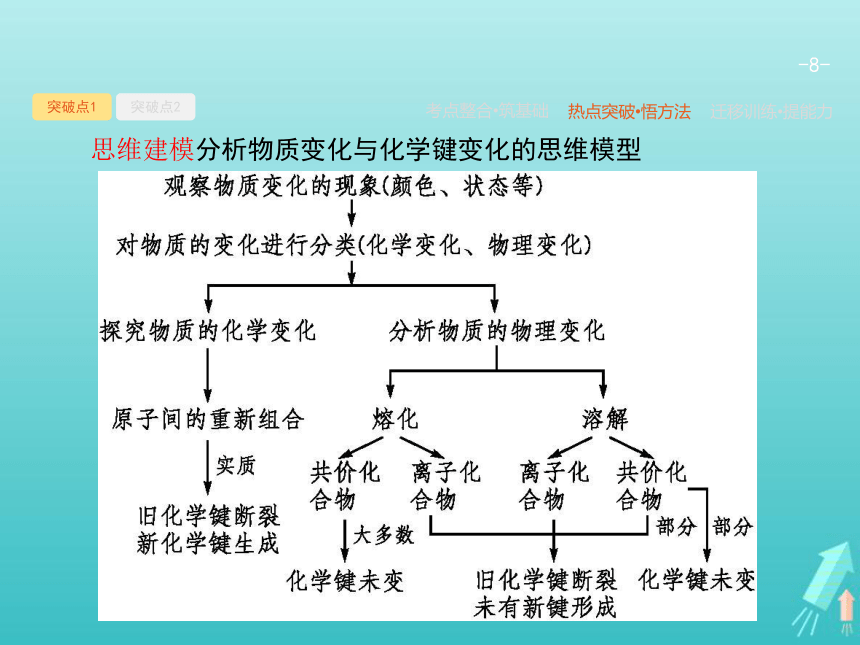
思维建模分析物质变化与化学键变化的思维模型
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
1.(2018全国Ⅲ)下列叙述正确的是( )
A.24 g镁与27 g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1 mol重水与1 mol水中,中子数之比为2∶1
D.1 mol乙烷和1 mol乙烯中,化学键数相同
B
D
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
D
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
4.短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,元素X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是( )
A.元素X与氢形成的原子个数比为1∶1的化合物有很多种
B.元素W、X的氯化物中,各原子均满足8电子的稳定结构
C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素Z可与元素X形成共价化合物XZ2
B
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
5.(2019天津实验中学高三月考)X、Y、Z、W为前20号原子序数依次递增的四种元素,X与Y能形成X2Y和X2Y2两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物X2Y电子数的两倍,则以下说法错误的是( )
A.氢化物的热稳定性为Y>Z
B.X2Y2的电子式为
C.WY2中既含有共价键又含有离子键
D.WX2能与X2Y反应生成X2
B
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
元素周期律 元素周期表
1.有关“位”“构”“性”题目解题思维路径
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
2.粒子半径大小比较的三种方法
(1)运用元素周期表进行比较。
①同周期元素从左到右(稀有气体元素除外),原子半径逐渐减小,如第三周期r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl);
②同主族元素从上到下,原子半径、离子半径逐渐增大,如第ⅦA族原子r(F)(2)运用“同层比核,同核比层”进行比较。
“同层比核”如:Na+与F-、Cl-与S2-的电子层数相同,核电荷数越大,原子核对电子的引力越大,半径越小;同理,“同核比层”如:Na与Na+的核电荷数相同,核外电子层越多,原子(或离子)半径越大。
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
(3)综合比较。
上述两种方法的综合,如电子层和核电荷数都不相同的,一般可通过寻找参照物进行比较。如比较r(Al3+)与r(S2-)的大小,可找出与S同主族的O,然后进行比较。r(Al3+)-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
3.元素金属性、非金属性强弱的比较
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
例2五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物的水溶液呈碱性,C和E形成的化合物的水溶液呈中性。
回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 。(填元素符号)?
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的 是 ?(用化学式表示)。?
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 。
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
(4)D最高价氧化物的水化物的化学式为 。?
(5)单质D在充足的单质E中燃烧,反应的化学方程式为 ; D在不充足的E中燃烧,生成的主要产物的化学式为 。
(6)单质E与水反应的离子方程式为 。?
答案:(1)Na Cl
(2)PH3
(3)NH4Cl 离子键和共价键
(4)H3PO4
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
解析:由A与B、D、E三种元素均能形成共价化合物可知,该四种元素为非金属元素,结合A和B形成的化合物的水溶液呈碱性可知,A为H,B为N,则C为Na,D为P;又因为C和E形成的化合物的水溶液呈中性,可知E为Cl。(1)依据原子半径变化规律,先看电子层数,再看核电荷数,可确定原子半径最大的为Na,依据元素周期律可确定非金属性最强的为Cl。(2)H和N、P、Cl形成的共价化合物中热稳定性最差的为PH3。(3)NH3与HCl反应生成离子化合物NH4Cl,其中含离子键和共价键。(4)P的最高价氧化物对应水化物为磷酸。(5)P与Cl2反应,Cl2足量时生成PCl5;Cl2不足时,生成PCl3。(6)氯气溶于水后有一部分生成盐酸和次氯酸,但次氯酸是弱酸,离子方程式中保留化学式。
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
思维建模解答元素推断题的思维路径
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
(3)已知元素在周期表中的位置:
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
1.(2018天津理综)下列有关物质性质的比较,结论正确的是( )
A.溶解度:Na2CO3B.热稳定性:HClC.沸点:C2H5SHD.碱性:LiOHC
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
2.(2017天津理综)根据元素周期表和元素周期律,判断下列叙述不正确的是( )
?
?
?
?
A.气态氢化物的热稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“ ”(ào)命名的第118号元素在周期表中位于第七周期0族
C
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
3.(2019全国Ⅰ)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
C
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
4.(2016天津理综改编)下表为元素周期表的一部分。
回答下列问题:
(1)Z元素在周期表中的位置为 。?
(2)表中元素原子半径最大的是 (写元素符号)。?
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是 。?
A.Y单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
C.Y和S两元素的简单氢化物受热分解,前者的分解温度高
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ。已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式: 。?
(5)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为 。Q与水反应的化学方程式为 。?
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol·L-1 NaOH溶液和1 mol O2,则两种气体的化学式及物质的量分别为 ,生成硫酸铜物质的量为 。?
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
物质结构 元素周期律
-null-
-null-
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
原子结构及化学键
1.构成原子或离子的粒子间的数量关系
(1)如在 中:质量数(A)=质子数(Z)+中子数(N)
(2)核电荷数=质子数=原子的核外电子数
(3)阳离子(Mn+):核电荷数=质子数=离子核外电子数+电荷数(n)
(4)阴离子(Rn-):核电荷数=质子数=离子核外电子数-电荷数(n)
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
2.化学键与物质类别的关系
(1)只含非极性共价键的物质:某些非金属元素组成的单质(稀有气体除外)。如I2、N2、P4、金刚石、晶体硅等。
(2)只含有极性共价键的物质:一般是不同非金属元素组成的共价化合物。如HCl、NH3、SiO2、CS2等。
(3)既有极性键又有非极性键的物质。如H2O2、C2H4、CH3CH3、C6H6等。
(4)只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物。如Na2S、CsCl、K2O、NaH等。
(5)既有离子键又有非极性共价键的物质。如Na2O2、CaC2等。
(6)由极性共价键构成但又不是强电解质的物质。如HF等。
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
例1下列说法正确的是( )
①离子化合物中一定含离子键,也可能含共价键
②共价化合物中可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤构成单质分子的粒子不一定存在共价键
⑥不同元素组成的多原子分子里的化学键一定是极性键
⑦有化学键断裂的变化属于化学变化
A.①③⑤ B.②④⑥ C.①③④ D.③⑤⑦
A
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
解析:①离子化合物中一定含离子键,也可能含极性键或非极性键,如NaOH中含离子键和O—H极性键,过氧化钠中含离子键和O—O非极性键,①正确;②共价化合物中一定含共价键,一定不含离子键,含离子键的化合物一定为离子化合物,②错误;③含金属元素的化合物不一定是离子化合物,如氯化铝为共价化合物,③正确;④由非金属元素组成的化合物不一定是共价化合物,如NH4Cl、(NH4)2SO4为离子化合物,④错误;⑤由分子构成的物质中不一定存在共价键,如稀有气体分子中不含化学键,⑤正确;⑥不同元素组成的多原子分子里的化学键,若为同种元素之间形成的是非极性共价键,不同元素之间形成的是极性共价键,⑥错误;⑦有旧化学键断裂和新化学键的生成的变化属于化学变化,有化学键断裂的变化不一定属于化学变化,如NaCl溶于水,离子键断裂,但属于物理变化,⑦错误;综上符合题意的有①③⑤,A项正确。
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
思维建模分析物质变化与化学键变化的思维模型
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
1.(2018全国Ⅲ)下列叙述正确的是( )
A.24 g镁与27 g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1 mol重水与1 mol水中,中子数之比为2∶1
D.1 mol乙烷和1 mol乙烯中,化学键数相同
B
D
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
D
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
4.短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,元素X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是( )
A.元素X与氢形成的原子个数比为1∶1的化合物有很多种
B.元素W、X的氯化物中,各原子均满足8电子的稳定结构
C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素Z可与元素X形成共价化合物XZ2
B
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
5.(2019天津实验中学高三月考)X、Y、Z、W为前20号原子序数依次递增的四种元素,X与Y能形成X2Y和X2Y2两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物X2Y电子数的两倍,则以下说法错误的是( )
A.氢化物的热稳定性为Y>Z
B.X2Y2的电子式为
C.WY2中既含有共价键又含有离子键
D.WX2能与X2Y反应生成X2
B
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
元素周期律 元素周期表
1.有关“位”“构”“性”题目解题思维路径
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
2.粒子半径大小比较的三种方法
(1)运用元素周期表进行比较。
①同周期元素从左到右(稀有气体元素除外),原子半径逐渐减小,如第三周期r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl);
②同主族元素从上到下,原子半径、离子半径逐渐增大,如第ⅦA族原子r(F)
“同层比核”如:Na+与F-、Cl-与S2-的电子层数相同,核电荷数越大,原子核对电子的引力越大,半径越小;同理,“同核比层”如:Na与Na+的核电荷数相同,核外电子层越多,原子(或离子)半径越大。
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
(3)综合比较。
上述两种方法的综合,如电子层和核电荷数都不相同的,一般可通过寻找参照物进行比较。如比较r(Al3+)与r(S2-)的大小,可找出与S同主族的O,然后进行比较。r(Al3+)
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
3.元素金属性、非金属性强弱的比较
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
例2五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物的水溶液呈碱性,C和E形成的化合物的水溶液呈中性。
回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 。(填元素符号)?
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的 是 ?(用化学式表示)。?
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 。
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
(4)D最高价氧化物的水化物的化学式为 。?
(5)单质D在充足的单质E中燃烧,反应的化学方程式为 ; D在不充足的E中燃烧,生成的主要产物的化学式为 。
(6)单质E与水反应的离子方程式为 。?
答案:(1)Na Cl
(2)PH3
(3)NH4Cl 离子键和共价键
(4)H3PO4
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
解析:由A与B、D、E三种元素均能形成共价化合物可知,该四种元素为非金属元素,结合A和B形成的化合物的水溶液呈碱性可知,A为H,B为N,则C为Na,D为P;又因为C和E形成的化合物的水溶液呈中性,可知E为Cl。(1)依据原子半径变化规律,先看电子层数,再看核电荷数,可确定原子半径最大的为Na,依据元素周期律可确定非金属性最强的为Cl。(2)H和N、P、Cl形成的共价化合物中热稳定性最差的为PH3。(3)NH3与HCl反应生成离子化合物NH4Cl,其中含离子键和共价键。(4)P的最高价氧化物对应水化物为磷酸。(5)P与Cl2反应,Cl2足量时生成PCl5;Cl2不足时,生成PCl3。(6)氯气溶于水后有一部分生成盐酸和次氯酸,但次氯酸是弱酸,离子方程式中保留化学式。
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
思维建模解答元素推断题的思维路径
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
(3)已知元素在周期表中的位置:
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
1.(2018天津理综)下列有关物质性质的比较,结论正确的是( )
A.溶解度:Na2CO3
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
2.(2017天津理综)根据元素周期表和元素周期律,判断下列叙述不正确的是( )
?
?
?
?
A.气态氢化物的热稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“ ”(ào)命名的第118号元素在周期表中位于第七周期0族
C
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
3.(2019全国Ⅰ)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
C
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
4.(2016天津理综改编)下表为元素周期表的一部分。
回答下列问题:
(1)Z元素在周期表中的位置为 。?
(2)表中元素原子半径最大的是 (写元素符号)。?
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是 。?
A.Y单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
C.Y和S两元素的简单氢化物受热分解,前者的分解温度高
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ。已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式: 。?
(5)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为 。Q与水反应的化学方程式为 。?
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol·L-1 NaOH溶液和1 mol O2,则两种气体的化学式及物质的量分别为 ,生成硫酸铜物质的量为 。?
-null-
突破点1
突破点2
考点整合?筑基础
热点突破?悟方法
迁移训练?提能力
同课章节目录
