人教版高一化学必修一4.3硫和氮的氧化物-第二课时 课件 (共29张PPT)
文档属性
| 名称 | 人教版高一化学必修一4.3硫和氮的氧化物-第二课时 课件 (共29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-17 00:00:00 | ||
图片预览








文档简介
(共29张PPT)
原理:
SO2的实验室制法
H2SO4 (浓) +Na2SO3 = SO2↑ +H2O+Na2SO4
利用了什么原理?
———强酸制弱酸
浓硫酸
NaOH溶液
湿润的品红试纸
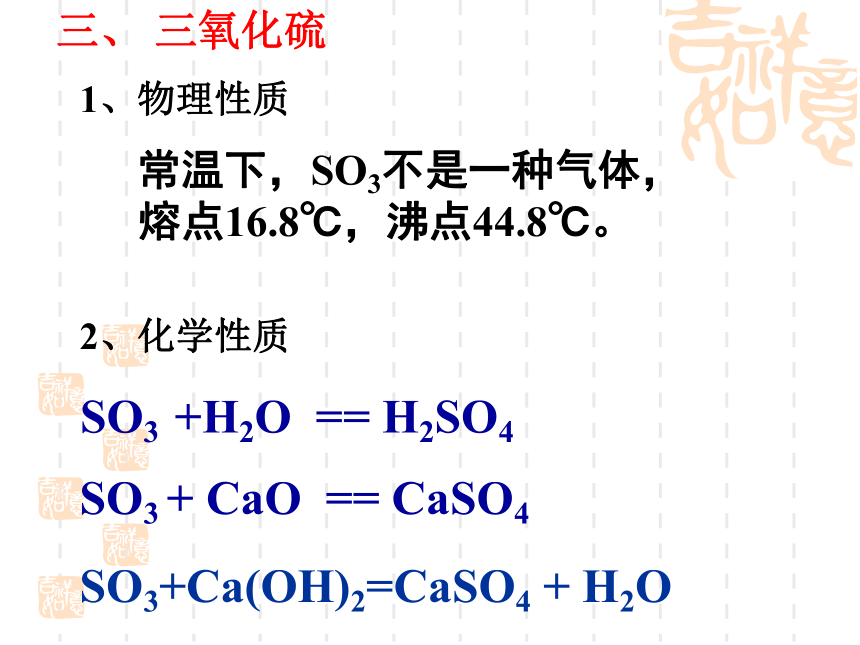
1、物理性质
三、 三氧化硫
常温下,SO3不是一种气体,
熔点16.8℃,沸点44.8℃。
SO3 +H2O == H2SO4
SO3 + CaO == CaSO4
SO3+Ca(OH)2=CaSO4 + H2O
2、化学性质
工业 上如何制备硫酸?
SO2的用途
杀菌、消毒
漂白纸浆、
毛、丝、
草帽
俗语:雷雨发庄稼,这是为什么?
第二课时 二氧化氮和一氧化氮
N2 + O2 ===== 2NO
放电或高温
氮气化学性质很稳定,通常不与氧气反应;
在放电(或高温)条件下,氮气才可以和氧气化合生成一氧化氮:
无色气体、不溶于水、有毒、不稳定
2 NO + O2 = 2 NO2
加氧气
一、一氧化氮
二、 二氧化氮
红棕色、有刺激性气味有毒气体,密度比空气大,易液化,易溶于水
与水反应: 3 NO2 + H2O =2HNO3 + NO
+4
+2
+5
NO2中有2/3的氮元素化合价升高,被氧化;
有1/3的氮元素化合价降低,被还原。
NO2既是氧化剂又是还原剂。
—— 工业上制硝酸
俗语:雷雨发庄稼?大家知道什么意思吗?写出有关反应的方程式。
在打雷放电的情况下,将空气中游离态的氮变成易被庄稼吸收的物质,促进庄稼生长。
最后, HNO3在土壤中变成易被农作物吸收的硝酸盐,即氮肥。
科学探究
现给你一试管二氧化氮,其他药品和仪器自选。
1、请你设计实验,要求尽可能多地NO2被水吸收。
将充满NO2的试管倒立在水槽
红棕色逐渐消失,试管水位上升到2/3处
往试管
通入O2
无色气体变成红棕色;水位继续上升,红棕色又消失
继续通入氧气
水逐渐充满试管
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
使生成的NO充分与O2反应,转化成NO2,最后完全转化为HNO3
实验步骤 现 象 解释(反应式)
(1)
(2)
(3)
2、你的设计对工业上生产硝酸有什么启示?
------工业生产硝酸,将尾气(NO)吸收通入适量的氧气后再溶解于水,经过多次循环氧化、溶解,可充分利用原料,并减少NO的排放,保护环境。
*
*
明星分子NO
1998年诺贝尔奖获得者伊格纳罗发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆等功能,成为当前生命科学的研究热点,NO亦称为“明星分子”。
*
*
【科学视野】:火箭为什么能飞上天?
(1)煤、石油和金属矿物中含有硫或硫的化合物,燃烧后往往会生成SO2 。
1、SO2和NO2的主要来源:
三、二氧化硫和二氧化氮对大气的污染
(2)在工厂的烟塔燃烧煤放出的气体中含有NO2、SO2等,污染空气。
(3)汽车发动机在工作(放电)时,汽缸中的空气中氮气和氧气就会反应生成氮的氧化物,因此汽车尾气中含有大量氮氧化物。
2、危害
(1)直接危害人体健康,引起呼吸道疾病,严重时会使人死亡。
(2)溶于水形成酸雨。
3、防治措施
(1)工业废气必须经过处理,才能排放。
(2)控制汽车尾气的排放标准。
酸雨——指pH小于5.6的降水,主要是SO2和NO2溶于水造成的。
(1)什么是酸雨?
(2)酸雨的类型:
4、 酸雨的形成
硝酸酸雨
硫酸酸雨
NO2 → HNO3
SO2 →H2SO4
NO2、SO2
来自工厂、汽车、发电厂等等放出
(3)酸雨的形成
硝酸酸雨:
3NO2 + H2O = 2HNO3 + NO
硫酸酸雨:
SO3 + H2O=H2SO4
2H2SO3 + O2 = 2H2SO4
(4)酸雨的危害
(5)防治酸雨的措施:
1、调整能源结构,发展清洁能源,提高能源利用率
2、研究脱硫、固硫技术,减少SO2的排放
目前世界上减少二氧化硫排放量的主要措施:
脱硫塔
燃煤烟气中含有SO2为了减少它的污染排放我们通常在燃煤中添加一定量的生石灰
SO2 +CaO==CaSO3 (亚硫酸钙)
+
原理:
SO2的实验室制法
H2SO4 (浓) +Na2SO3 = SO2↑ +H2O+Na2SO4
利用了什么原理?
———强酸制弱酸
浓硫酸
NaOH溶液
湿润的品红试纸
1、物理性质
三、 三氧化硫
常温下,SO3不是一种气体,
熔点16.8℃,沸点44.8℃。
SO3 +H2O == H2SO4
SO3 + CaO == CaSO4
SO3+Ca(OH)2=CaSO4 + H2O
2、化学性质
工业 上如何制备硫酸?
SO2的用途
杀菌、消毒
漂白纸浆、
毛、丝、
草帽
俗语:雷雨发庄稼,这是为什么?
第二课时 二氧化氮和一氧化氮
N2 + O2 ===== 2NO
放电或高温
氮气化学性质很稳定,通常不与氧气反应;
在放电(或高温)条件下,氮气才可以和氧气化合生成一氧化氮:
无色气体、不溶于水、有毒、不稳定
2 NO + O2 = 2 NO2
加氧气
一、一氧化氮
二、 二氧化氮
红棕色、有刺激性气味有毒气体,密度比空气大,易液化,易溶于水
与水反应: 3 NO2 + H2O =2HNO3 + NO
+4
+2
+5
NO2中有2/3的氮元素化合价升高,被氧化;
有1/3的氮元素化合价降低,被还原。
NO2既是氧化剂又是还原剂。
—— 工业上制硝酸
俗语:雷雨发庄稼?大家知道什么意思吗?写出有关反应的方程式。
在打雷放电的情况下,将空气中游离态的氮变成易被庄稼吸收的物质,促进庄稼生长。
最后, HNO3在土壤中变成易被农作物吸收的硝酸盐,即氮肥。
科学探究
现给你一试管二氧化氮,其他药品和仪器自选。
1、请你设计实验,要求尽可能多地NO2被水吸收。
将充满NO2的试管倒立在水槽
红棕色逐渐消失,试管水位上升到2/3处
往试管
通入O2
无色气体变成红棕色;水位继续上升,红棕色又消失
继续通入氧气
水逐渐充满试管
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
使生成的NO充分与O2反应,转化成NO2,最后完全转化为HNO3
实验步骤 现 象 解释(反应式)
(1)
(2)
(3)
2、你的设计对工业上生产硝酸有什么启示?
------工业生产硝酸,将尾气(NO)吸收通入适量的氧气后再溶解于水,经过多次循环氧化、溶解,可充分利用原料,并减少NO的排放,保护环境。
*
*
明星分子NO
1998年诺贝尔奖获得者伊格纳罗发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆等功能,成为当前生命科学的研究热点,NO亦称为“明星分子”。
*
*
【科学视野】:火箭为什么能飞上天?
(1)煤、石油和金属矿物中含有硫或硫的化合物,燃烧后往往会生成SO2 。
1、SO2和NO2的主要来源:
三、二氧化硫和二氧化氮对大气的污染
(2)在工厂的烟塔燃烧煤放出的气体中含有NO2、SO2等,污染空气。
(3)汽车发动机在工作(放电)时,汽缸中的空气中氮气和氧气就会反应生成氮的氧化物,因此汽车尾气中含有大量氮氧化物。
2、危害
(1)直接危害人体健康,引起呼吸道疾病,严重时会使人死亡。
(2)溶于水形成酸雨。
3、防治措施
(1)工业废气必须经过处理,才能排放。
(2)控制汽车尾气的排放标准。
酸雨——指pH小于5.6的降水,主要是SO2和NO2溶于水造成的。
(1)什么是酸雨?
(2)酸雨的类型:
4、 酸雨的形成
硝酸酸雨
硫酸酸雨
NO2 → HNO3
SO2 →H2SO4
NO2、SO2
来自工厂、汽车、发电厂等等放出
(3)酸雨的形成
硝酸酸雨:
3NO2 + H2O = 2HNO3 + NO
硫酸酸雨:
SO3 + H2O=H2SO4
2H2SO3 + O2 = 2H2SO4
(4)酸雨的危害
(5)防治酸雨的措施:
1、调整能源结构,发展清洁能源,提高能源利用率
2、研究脱硫、固硫技术,减少SO2的排放
目前世界上减少二氧化硫排放量的主要措施:
脱硫塔
燃煤烟气中含有SO2为了减少它的污染排放我们通常在燃煤中添加一定量的生石灰
SO2 +CaO==CaSO3 (亚硫酸钙)
+
