2020学年选修4第二章2.1化学反应速率(16页)
文档属性
| 名称 | 2020学年选修4第二章2.1化学反应速率(16页) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-18 09:22:01 | ||
图片预览





文档简介
(共16张PPT)
人教版 化学选修4
速度与激情
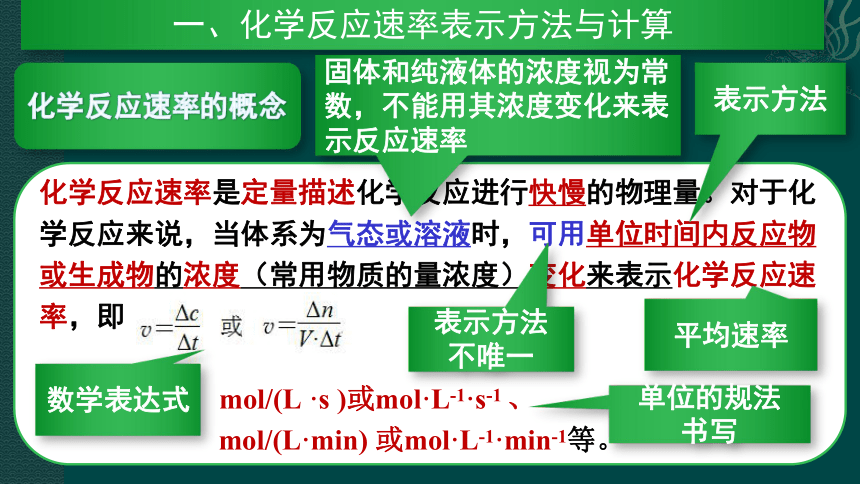
一、化学反应速率表示方法与计算
固体和纯液体的浓度视为常数,不能用其浓度变化来表示反应速率
表示方法
数学表达式
平均速率
表示方法
不唯一
单位的规法
书写
化学反应速率表示方法
这里的A、B、Y、Z不能是固体或纯液体
同一个化学反应的速率,可以用不同物质的浓度变化来表示
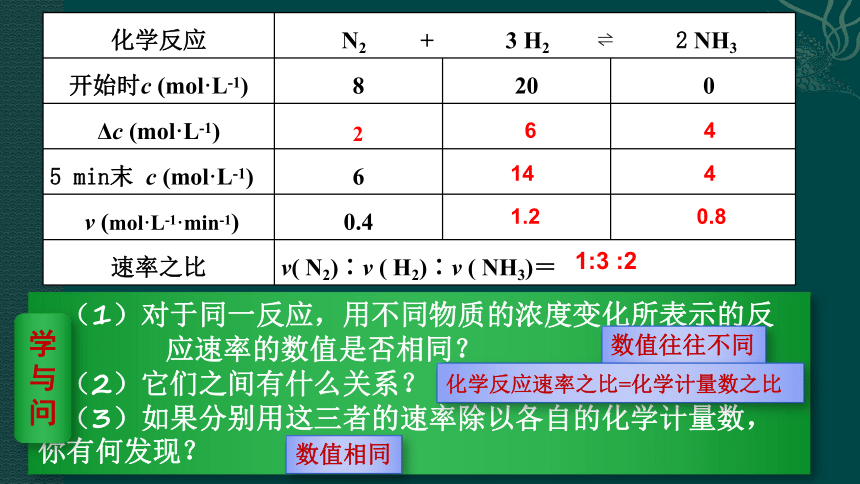
例如,在密闭容器中,合成氨的反应:N2 + 3H2? 2NH3 ,开始时N2的浓度为8 mol/L,H2的浓度为20 mol/L,5 min 后N2的浓度为6 mol/L,在这个反应中N2浓度的变化Δc(N2)=2 mol/L,时间变化Δt =5 min。
(1)用N2的浓度变化表示的反应速率为:
化学反应速率的计算
如果用H2、NH3的浓度变化表示该反应的化学反应速率,又是多少呢?
=
(1)对于同一反应,用不同物质的浓度变化所表示的反
应速率的数值是否相同?
(2)它们之间有什么关系?
(3)如果分别用这三者的速率除以各自的化学计量数,你有何发现?
6
4
14
4
1.2
0.8
1:3 :2
学
与
问
2
数值往往不同
化学反应速率之比=化学计量数之比
数值相同
化学反应 N2 + 3 H2 ? 2 NH3
开始时c (mol·L-1) 8 20 0
Δc (mol·L-1)
5 min末 c (mol·L-1) 6
v (mol·L-1·min-1) 0.4
速率之比 v( N2)∶v ( H2)∶v ( NH3)=
“三段式”计算
三段式法:利用起始量、变化量、一段时间后的量的关系计算
例如:反应 mA+ nB = pY + qZ
起始量(mol 或mol/L) a b 0 0
转化量(mol 或mol/L) mx nx px qx
某时刻量(mol 或mol/L) a-mx b-nx px qx
温馨小贴士
转化量的设法技巧:化学计量数是几,转化量就设几x
列出三组数据
依据题目已知求算x
归纳总结
二 化学反应速率的测定
化学反应速率测量基本原理和思路
化学反应速率是通过实验测定的。因为化学反应中发生变化的是体系中的化学物质(包括反应物和生成物),所以与其中任何一种化学物质的浓度(或质量、体积等)相关的性质在测量反应速率时都可加以利用。如
按图2-1所示安装两套装置,在锥形瓶内各盛有2 g锌粒
(颗粒大小基本相同),通过分液漏斗分别加入40 mL 1 mol·L-1的硫酸和40 mL 4 mol·L-1的硫酸,比较二者收集20 mL H2所用的时间。把实验结果填入下表:
实验2-1 测量锌与硫酸反应速率
101
19
硫酸的浓度越大,反应速率越快
加入试剂
1 mol·L-1的硫酸
4 mol·L-1的硫酸
实验结论
想一想
1、该实验中用到了哪些重要仪器?
锥形瓶、分液漏斗、50mL注射器、
秒表、┅┅
装置组装好后,关闭分液漏斗的玻璃活塞,将注射器活塞向外拉,放开,一段时间后,若注射器活塞恢复到原来位置,则该装置气密性良好。
3、已知反应Zn+H2SO4=ZnSO4+H2↑,除了上述方法,还可根据哪些相关量的变化来测定该反应的反应速率?
方案1:测量一段时间内溶液中H+浓度的变化。
方案2:测量一段时间内锌粒质量的变化。
……
化
学
反
应
速
率
回顾总结
1.化学反应A(g)+3B(g) ? 2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是( )
A.v(A)=0.23 mol/(L·min) B.v(B)=0.01 mol/(L·s)
C.v(C)=0.40 mol/(L·min) D.v(D)=0.50 mol/(L·min)
D
2.某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由此分析:
(1) 从反应开始至2 min时,Z的反应速率为 。
(2) 该反应的化学方程式为 。
(3) 对于上述反应,在不同时间段内所测反应速率如下,则表示该化学反应进行最快的是 。
A. v (X)=1.2 mol·L-1·min-1
B. v (Y)=1.5 mol·L-1·min-1
C. v (Z)=0.6 mol·L-1·min-1
D. v (Z)=0.015 mol·L-1·s-1
0.025 mol·L-1·min-1
D
人教版 化学选修4
速度与激情
一、化学反应速率表示方法与计算
固体和纯液体的浓度视为常数,不能用其浓度变化来表示反应速率
表示方法
数学表达式
平均速率
表示方法
不唯一
单位的规法
书写
化学反应速率表示方法
这里的A、B、Y、Z不能是固体或纯液体
同一个化学反应的速率,可以用不同物质的浓度变化来表示
例如,在密闭容器中,合成氨的反应:N2 + 3H2? 2NH3 ,开始时N2的浓度为8 mol/L,H2的浓度为20 mol/L,5 min 后N2的浓度为6 mol/L,在这个反应中N2浓度的变化Δc(N2)=2 mol/L,时间变化Δt =5 min。
(1)用N2的浓度变化表示的反应速率为:
化学反应速率的计算
如果用H2、NH3的浓度变化表示该反应的化学反应速率,又是多少呢?
=
(1)对于同一反应,用不同物质的浓度变化所表示的反
应速率的数值是否相同?
(2)它们之间有什么关系?
(3)如果分别用这三者的速率除以各自的化学计量数,你有何发现?
6
4
14
4
1.2
0.8
1:3 :2
学
与
问
2
数值往往不同
化学反应速率之比=化学计量数之比
数值相同
化学反应 N2 + 3 H2 ? 2 NH3
开始时c (mol·L-1) 8 20 0
Δc (mol·L-1)
5 min末 c (mol·L-1) 6
v (mol·L-1·min-1) 0.4
速率之比 v( N2)∶v ( H2)∶v ( NH3)=
“三段式”计算
三段式法:利用起始量、变化量、一段时间后的量的关系计算
例如:反应 mA+ nB = pY + qZ
起始量(mol 或mol/L) a b 0 0
转化量(mol 或mol/L) mx nx px qx
某时刻量(mol 或mol/L) a-mx b-nx px qx
温馨小贴士
转化量的设法技巧:化学计量数是几,转化量就设几x
列出三组数据
依据题目已知求算x
归纳总结
二 化学反应速率的测定
化学反应速率测量基本原理和思路
化学反应速率是通过实验测定的。因为化学反应中发生变化的是体系中的化学物质(包括反应物和生成物),所以与其中任何一种化学物质的浓度(或质量、体积等)相关的性质在测量反应速率时都可加以利用。如
按图2-1所示安装两套装置,在锥形瓶内各盛有2 g锌粒
(颗粒大小基本相同),通过分液漏斗分别加入40 mL 1 mol·L-1的硫酸和40 mL 4 mol·L-1的硫酸,比较二者收集20 mL H2所用的时间。把实验结果填入下表:
实验2-1 测量锌与硫酸反应速率
101
19
硫酸的浓度越大,反应速率越快
加入试剂
1 mol·L-1的硫酸
4 mol·L-1的硫酸
实验结论
想一想
1、该实验中用到了哪些重要仪器?
锥形瓶、分液漏斗、50mL注射器、
秒表、┅┅
装置组装好后,关闭分液漏斗的玻璃活塞,将注射器活塞向外拉,放开,一段时间后,若注射器活塞恢复到原来位置,则该装置气密性良好。
3、已知反应Zn+H2SO4=ZnSO4+H2↑,除了上述方法,还可根据哪些相关量的变化来测定该反应的反应速率?
方案1:测量一段时间内溶液中H+浓度的变化。
方案2:测量一段时间内锌粒质量的变化。
……
化
学
反
应
速
率
回顾总结
1.化学反应A(g)+3B(g) ? 2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是( )
A.v(A)=0.23 mol/(L·min) B.v(B)=0.01 mol/(L·s)
C.v(C)=0.40 mol/(L·min) D.v(D)=0.50 mol/(L·min)
D
2.某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由此分析:
(1) 从反应开始至2 min时,Z的反应速率为 。
(2) 该反应的化学方程式为 。
(3) 对于上述反应,在不同时间段内所测反应速率如下,则表示该化学反应进行最快的是 。
A. v (X)=1.2 mol·L-1·min-1
B. v (Y)=1.5 mol·L-1·min-1
C. v (Z)=0.6 mol·L-1·min-1
D. v (Z)=0.015 mol·L-1·s-1
0.025 mol·L-1·min-1
D
