鲁教版初中化学九年级下册第七单元《常见的酸和碱》检测题(含答案)
文档属性
| 名称 | 鲁教版初中化学九年级下册第七单元《常见的酸和碱》检测题(含答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 286.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-17 00:00:00 | ||
图片预览



文档简介
《常见的酸和碱》检测题
一、单选题
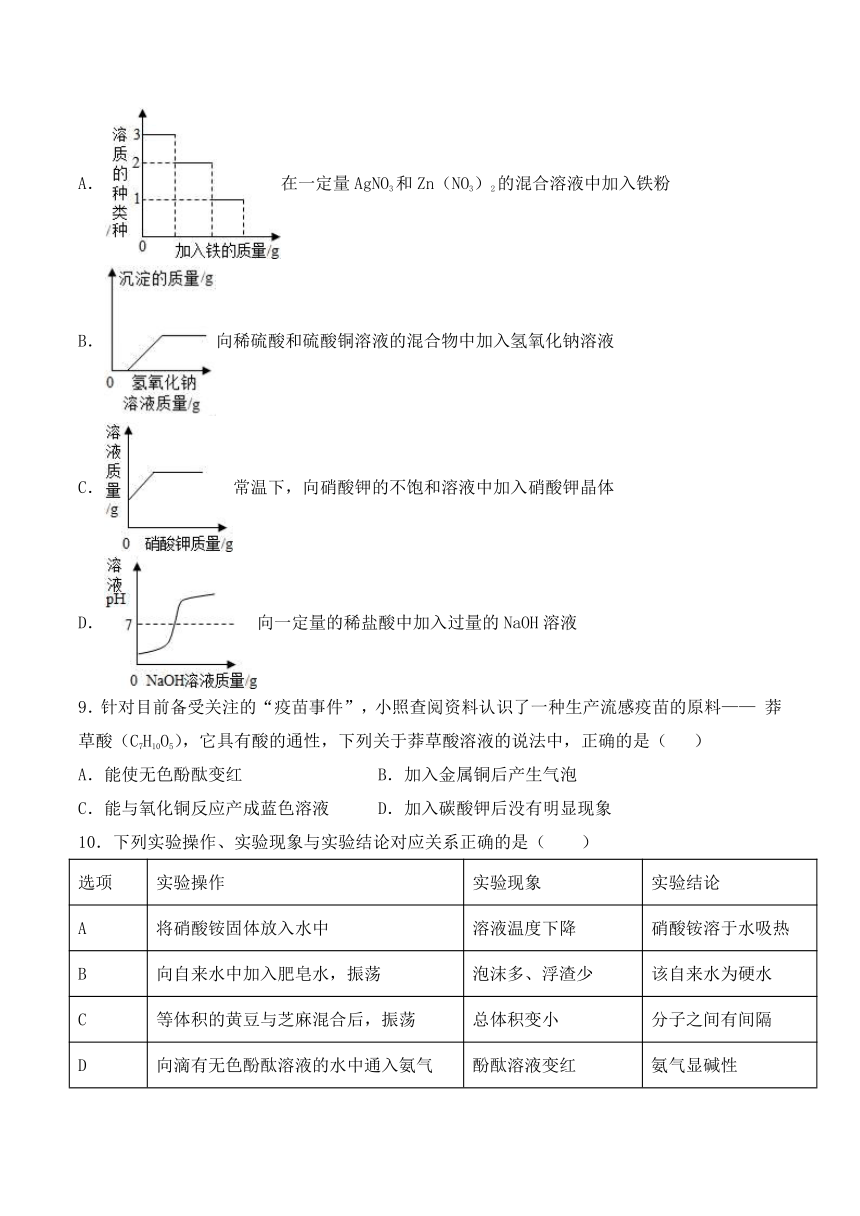
1.如表除杂的方法和试剂都正确的是( )
选项 物质 所含的杂质 所选试剂和方法
A HCl H2SO4 加入适量Ba(OH)2溶解、过滤
B KCl KClO3 加入二氧化锰、加热
C Cu CuO 加入过量的稀盐酸、过滤、洗涤、干燥
D CaCl2溶液 Ca(OH)2 加入适量的稀硫酸
A.A B.B C.C D.D
2.小明同学分别取20gNaOH固体A、B、C,采用不同方法保存。几天后,A未变质、B部分变质、C全部变质,他将三份固体分别配成溶液并滴入20%的稀硫酸直到正好反应。下列说法正确的是:
A.几天后,三份固体的质量为:A=B=C;
B.为控制正好反应,A不能用酚酞试液指示,B、C可滴加稀硫酸直到正好不冒气泡;
C.正好反应时,消耗稀硫酸的质量由大到小的顺序为:A>B>C;
D.正好反应时,生成硫酸钠的质量都相等,均为35.5g;
3.正确规范的操作是实验成功和人身安全的重要保证。下列实验操作正确的是( )
A.测定溶液pH B.配制溶液
C.称量固体 D.稀释浓硫酸
4.除去铜粉中混有的少量氧化铜,其主要操作过程是( )
A.加入适量的稀硫酸,微热,蒸发,洗涤 B.加强热或在空气中灼热
C.加入适量水,加热,过滤,洗涤 D.加入适量的稀硫酸,微热,过滤、洗涤
5.如图中“”表示人体内的一些液体和排泄物的正常pH范围,据此判断其中酸性最强的是( )
A.血浆 B.唾液 C.胃液 D.尿液
6.我国化工专家侯德榜发明了“联合制碱法”,其生产过程中发生的反应主要有:①NH3+CO2+H2O=NH4HCO3;
②NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
③2NaHCO3 Na2CO3+H2O+CO2↑。
上述反应中没有涉及到的基本反应类型是
A.复分解反应 B.分解反应 C.化合反应 D.置换反应
7.下列应用和相应的原理(用化学方程式表示)及基本反应类型均正确的是( )
A.拉瓦锡测定空气中氧气的含量 4P+5O2P2O5化合反应
B.比较铜和银的金属活动性 Cu+2AgClCuCl2+2Ag置换反应
C.用硫酸除铁锈Fe2O3+2H2SO42FeSO4+3H2O复分解反应
D.用小苏打制糕点2NaHCO3Na2CO3+H2O+CO2↑ 分解反应
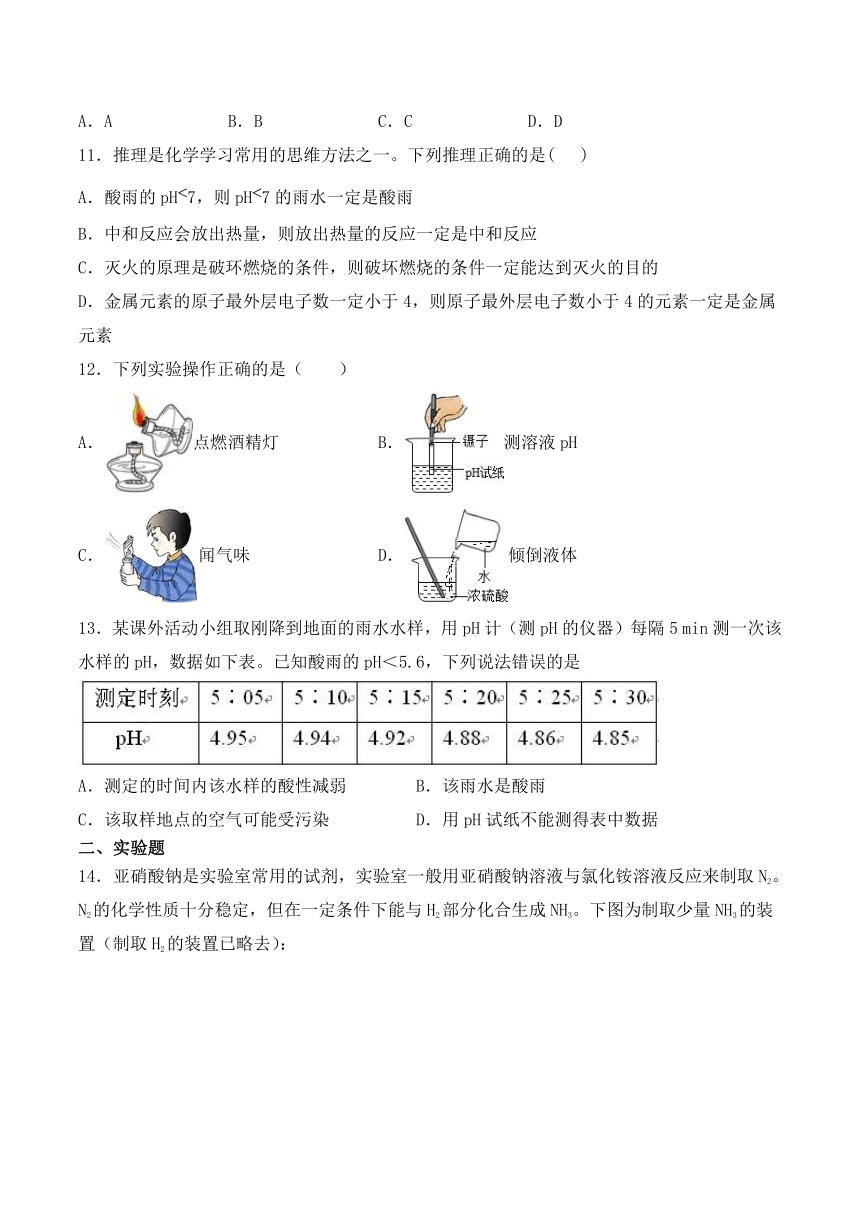
8.下列图象不能正确反映对应变化关系的是( )
A.在一定量AgNO3和Zn(NO3)2的混合溶液中加入铁粉
B.向稀硫酸和硫酸铜溶液的混合物中加入氢氧化钠溶液
C.常温下,向硝酸钾的不饱和溶液中加入硝酸钾晶体
D.向一定量的稀盐酸中加入过量的NaOH溶液
9.针对目前备受关注的“疫苗事件”,小照查阅资料认识了一种生产流感疫苗的原料—— 莽草酸(C7H10O5),它具有酸的通性,下列关于莽草酸溶液的说法中,正确的是( )
A.能使无色酚酞变红 B.加入金属铜后产生气泡
C.能与氧化铜反应产成蓝色溶液 D.加入碳酸钾后没有明显现象
10.下列实验操作、实验现象与实验结论对应关系正确的是( )
选项 实验操作 实验现象 实验结论
A 将硝酸铵固体放入水中 溶液温度下降 硝酸铵溶于水吸热
B 向自来水中加入肥皂水,振荡 泡沫多、浮渣少 该自来水为硬水
C 等体积的黄豆与芝麻混合后,振荡 总体积变小 分子之间有间隔
D 向滴有无色酚酞溶液的水中通入氨气 酚酞溶液变红 氨气显碱性
A.A B.B C.C D.D
11.推理是化学学习常用的思维方法之一。下列推理正确的是( )
A.酸雨的pH7,则pH7的雨水一定是酸雨
B.中和反应会放出热量,则放出热量的反应一定是中和反应
C.灭火的原理是破环燃烧的条件,则破坏燃烧的条件一定能达到灭火的目的
D.金属元素的原子最外层电子数一定小于4,则原子最外层电子数小于4的元素一定是金属元素
12.下列实验操作正确的是( )
A.点燃酒精灯 B.测溶液pH
C.闻气味 D.倾倒液体
13.某课外活动小组取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5 min测一次该水样的pH,数据如下表。已知酸雨的pH<5.6,下列说法错误的是
A.测定的时间内该水样的酸性减弱 B.该雨水是酸雨
C.该取样地点的空气可能受污染 D.用pH试纸不能测得表中数据
二、实验题
14.亚硝酸钠是实验室常用的试剂,实验室一般用亚硝酸钠溶液与氯化铵溶液反应来制取N2。N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3。下图为制取少量NH3的装置(制取H2的装置已略去):
(1)写出上图中你最熟悉的两种仪器名称:
①_________________,
②__________________。
(2)写出C装置的硬质试管中发生反应的化学方程式____________________。
(3)反应时N2和H2的最佳质量比是________。如果按此比例进行反应,反应时,D中导管口是否会逸出气泡?(已知NH3极易溶于水),说明逸出气泡的原因:______________________
(4)B中浓硫酸的作用是___________________。
(5)用实验方法证明确实有NH3生成:_____________________________。
(6)归纳与演绎是重要的科学方法,也是常用的学习方法。我们已经学过实验室制取气体的反应原理、制取与收集方法。请你归纳出实验室制取气体反应的共同点:
________________(填序号)。
①需要加热
②使用催化剂
③没有气体参加反应
④原料为纯净物
⑤只生成一种气体
15.根据下列装置图,回答问题
(1)用高锰酸钾制取氧气,选用的发生装置是_____(填序号),为防止高锰酸钾粉末进入导管,该装置需做的改进是_____:若用D装置收集氧气,当观察到_____时,便可开始收集。
(2)实验室制取并收集二氧化碳应选用的一组装置是_____(填序号),反应的化学方程式是_____。图F是某同学利用报废试管设计的制二氧化碳的发生装置,该设计除了废物利用的优点外,还有另一个优点,该优点是:_____。
(3)如图E向装满CO2的软塑料瓶注入约体积的水,立即旋紧瓶盖,振荡,观察到的现象是_____。
(4)若用G装置收集一瓶干燥的某气体,则该气体可能是_____。
A NH3 B H2 C O2 D CH4
三、推断题
16.A-G是纯净物且A、B、C、D、E是初中化学中常见的不同类别的物质。它们之间的关系如图所示(“→”表示物质间的转化关系,“一” 表示两端的物质能发生化学反应)。A是草木灰的主要成分,B是光合作用不可缺少的物质,D是由两种元素组成的化合物,E是黑色粉末, F是未来最理想的清洁能源,请回答下列问题:
(1)写出化学式: D________,E___________。
(2)物质G所属的物质类别是________;C与D反应的基本类型是__________。
17.在学习盐酸与氢氧化钙溶液的化学性质时构建了如下知识网络图,A、B、C、D、E是不同类别的化合物,“—”表示相连的物质在一定条件下可以发生化学反应。请回答下列问题:
(1)为验证二者与酸碱指示剂的作用,小亮将紫色石蕊试液滴入HCl溶液中,溶液变成_________色,滴入Ca(OH)2溶液中,溶液变成_________色;
(2)反应①的化学方程式为:______________________,实验现象为__________________;
(3)实现②反应,写出一种B物质的化学式________________________;
(4)写出图中一个中和反应的化学方程式:________________________,该反应的实质是_____________________;
(5)依据反应⑥说明Ca(OH)2溶液长期放置空气会变浑浊,其反应的化学方程式为:________________________;
(6)物质C应具备的条件是___________________________。
四、计算题
18.酸奶作为世界公认的长寿食品之一正愈来愈受到人们的重视和喜爱。酸奶中的酸味来自乳酸(化学式为C3H6O3)。
(1)酸奶主要提供人类营养物质中的哪一类?_____。乳酸在人体内可被完全氧化为CO2和H2O,1.8g乳酸完全氧化消耗O2的质量为_____g。
(2)为了测定某品牌酸奶中乳酸的含量,振华同学取100mL酸奶和100mL蒸馏水于烧杯中,慢慢滴入0.4%的NaOH溶液并不断搅拌,用传感器测得溶液pH随加入NaOH溶液体积V的变化关系如图所示。计算该酸奶中乳酸的含量为_____克每升。
(已知:乳酸的钠盐可表示为CH3CH(OH)COONa,测定所用NaOH溶液的密度为1.0g/mL,计算结果精确到0.01,无计算过程不给分)。
19.某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。请计算:
(1)若要清洗1000kg的这种石油产品,需要______kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理1000kg这种产品,可以节约多少经费?已知工业级的NaOH和Ca(OH)2的最新市场批发价如下表:
试剂 Ca(OH)2 NaOH
价格(元/kg) 1.00 6.00
(3)请画出用氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。______
(4)将反应后生成的硫酸钙回收,在一定条件下加入高温硫酸盐还原菌,可以将SO42-离子转化生成H2S气体,然后用以硫酸的生产工业。不考虑整个过程中硫元素的损失,若将(2)中产生的硫酸钙全部转化,可生产H2S的质量为______kg。
20.酸、碱、盐是初中化学学习的重要内容。
(1)盐酸、硫酸等常见的酸都具有相似的化学性质,是因为它们在水溶液中都解离出____________填离子符号。
(2)“84消毒液”可有效杀死新冠病毒,某“84消毒液”瓶体部分标签如图所示:
①该瓶“84消毒液”中NaClO的质量为_________g。
②工业可用氯气和氢氧化钠溶液反应来制取NaClO,同时生成食盐的主要成分和水,写出该反应的化学方程式_____________。
(3)实验室有一瓶长期露置于空气中的氢氧化钠溶液,为确定其成分,小组同学进行了如下探究。
①根据实验方案二确定该瓶溶液的溶质成分是什么_____________;
②实验方案一不能准确确定溶质成分,请说明理由_______________;
③实验室为防止NaOH溶液变质,可采取什么措施_______________。
(4)某固体物质中可能含有NaCl、、NaOH中的一种或几种。某校课外小组同学为了探究其成分,取该固体物质30g完全溶于水中,测得溶液的pH为7,然后将70g某稀硫酸加入该溶液中,充分反应,所加硫酸的量与产生沉淀的关系如图所示。请根据图示及相关知识回答问题。
①该固体物质中一定不含有的物质是__________化学式。
②这种稀硫酸中溶质的质量分数是_________?
参考答案
1.C 2.D 3.A 4.D 5.C 6.D 7.D 8.A 9.C 10.A 11.C 12.C 13.A
14.(1) ①或② 试管 酒精灯 集气瓶 烧瓶 分液漏斗 铁架台等
(2)3 H2+ N2催化剂、加热2 NH3。
(3)14 : 3 因为是“部分化合”,仍会有未反应的H2和N2逸出。
(4)干燥 (5)向D中滴入无色酚酞溶液,酚酞变红(2分) (6)③⑤
15.A 在试管口塞一团棉花 气泡连续均匀冒出 B和C CaCO3+2HCl=CaCl2+H2O+CO2↑ 可随时控制反应发生或停止 软塑料瓶变瘪 C
16.HCl Fe 氧化物 复分解反应
17.(1)红;蓝
(2)Fe2O3+6HCl=2FeCl3+3H2O;红色(或红棕色)固体不断溶解,溶液由无色变成黄色
(3)Fe或Zn或Mg等
(4)Ca(OH)2+H2SO4=CaSO4+2H2O或Ca(OH)2+2HCl=CaCl2+2H2O;H+和OH-结合生成水
(5)Ca(OH)2+CO2=CaCO3↓+H2O
(6)可溶性盐,且能与Ca(OH)2、HCl发生反应
18.蛋白质 1.92 0.45?g/L
19.40 17
20.H+ 447 Cl2+2NaOH=NaClO+NaCl+H2O 碳酸钠和氢氧化钠 氢氧化钠喝碳酸钠溶液都显碱性,都能使无色酚酞变红 密封保存 NaOH 19.6%
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
