鲁教版九年级化学9.2金属的化学性质第二课时( 共38张PPT)
文档属性
| 名称 | 鲁教版九年级化学9.2金属的化学性质第二课时( 共38张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-17 00:00:00 | ||
图片预览










文档简介
(共38张PPT)
9-2 金属的化学性质
第二课时
三.金属与盐溶液的反应
金属能与酸发生置换反应,其实质是什么?
那么金属能否与盐溶液也发生置换反应呢? 如何证明呢?
想一想
小资料:
早在2000多年前西汉时期就有“曾青得铁则化为铜”的记载。我国劳动人民早就认识了硫酸铜溶液里的铜能被铁置换出来,从而发明了湿法炼铜,揭开了湿法冶金术的序幕,成为人类冶炼史上的一个重要里程碑。
你能否得出金属和化合物溶液反应的一般规律呢?
现象:_________________________________________________
________________________________________________________
回忆:将铁钉投入到硫酸铜溶液中有何现象?
铁钉表面会有红色物质析出,若时间足够长,则溶液会从蓝色变为浅绿色。
Fe + CuSO4 = Cu + FeSO4
该反应的化学方程式:
三.金属与化合物溶液的反应
金属和盐反应
CuSO4+Fe=
FeSO4+Cu
(湿法炼铜!)
现象:铁表面覆盖一层亮红色的金属,溶液由蓝色变为浅绿色。
(置换反应)
硫酸铜溶液 硝酸银溶液 氯化钠溶液
锌
铁
铜
金属与某些盐溶液反应
学习任务一
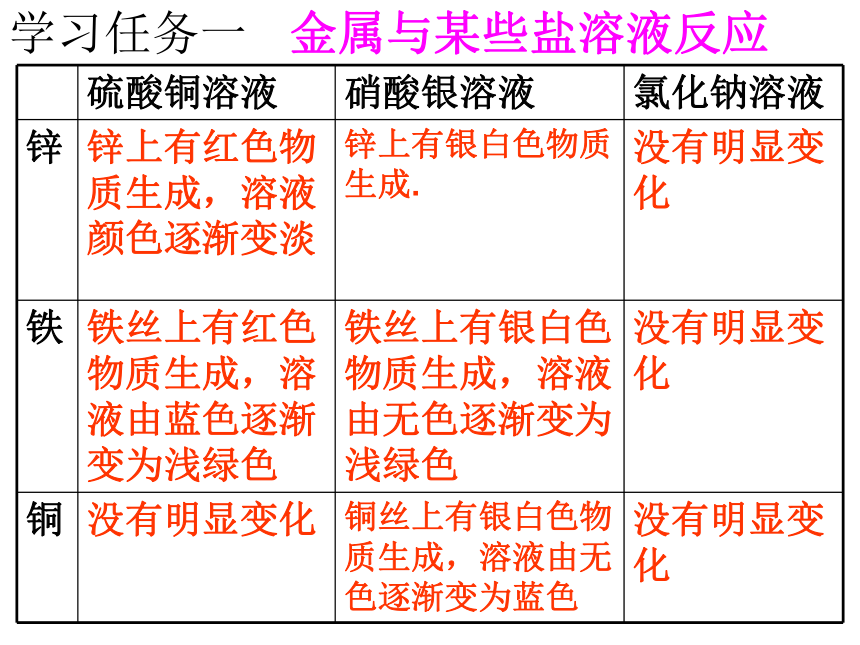
硫酸铜溶液 硝酸银溶液 氯化钠溶液
锌 锌上有红色物质生成,溶液颜色逐渐变淡 锌上有银白色物质生成. 没有明显变化
铁 铁丝上有红色物质生成,溶液由蓝色逐渐变为浅绿色 铁丝上有银白色物质生成,溶液由无色逐渐变为浅绿色 没有明显变化
铜
没有明显变化 铜丝上有银白色物质生成,溶液由无色逐渐变为蓝色 没有明显变化
金属与某些盐溶液反应
学习任务一
Cu + 2AgNO3 == Cu(NO3)2 + 2Ag
Fe + CuSO4 == Fe SO4+ Cu
Zn+ CuSO4 == ZnSO4+ Cu
Zn + 2AgNO3 == Zn(NO3)2 + 2Ag
Fe + 2AgNO3 == Fe (NO3)2 + 2Ag
1、以上反应类型都属于 反应。
2、锌、铁、铜、银三种金属的活动性顺序是
讨论
置换
Zn > Fe > Cu >Ag
金属活动性由强到弱
交流共享
通过刚才的探究实验,你得到什么结论?
哪些金属能和盐溶液发生置换反应?
合作探究一
3、金属+盐溶液→新金属+新盐
规律:
1.前面的金属置换后面的金属。
2.盐是可溶盐
3.金属不能太活泼:K、Ca、Na不行
知识归纳
与盐溶液反应条件(口诀):
溶液中金属遇到盐,
前面能将后面换,
铁要生成亚铁盐,
钾、钙、钠靠边站。
2.有X Y Z三种金属,如果把X和Y分别放入
稀硫酸中, X 溶解并产生氢气,Y不反应;如果
把Y和Z分别放入硝酸银溶液中,过一会儿,在Y
的表面有银析出,而Z无变化.根据以上事实,判
断X Y Z的金属活动顺序.
解答: 金属活动性顺序 X>Y>Z
金属活动性顺序
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
由强逐渐减弱
常见金属的活动性顺序:
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
勤记忆
学习任务二
探究金属活动性强弱的方法
1、利用金属与酸反应
若能与酸反应,则说明该金属的活动性比 强,
若不能与酸反应,则说明该金属的活动性比 弱
如:将锌、铜投入到稀硫酸中,能反应的是 ,不能反应的是 ,说明活动性锌 铜
比较金属活动性的方法
2、利用金属与酸反应的速率,
反应的速率越快,金属的活动性越强
如:将同样大小锌、镁投入稀盐酸中,镁反应更剧烈,说明 的活动性比 强
比较金属活动性的方法
3、利用金属与盐溶液反应
若A能与B的盐溶液反应说明 A活动性 B;若不能反应,说明 A活动性 B
如:将铜投入到硝酸银溶液中,可看到 ,说明铜的活动性 ,将铜投入到硫酸锌溶液中,不能反应,说明铜的活动性 .
比较金属活动性的方法
验证三种金属活动性顺序取试剂的方法
1、前后金属中间盐
2、中间金属两头盐
4、前两种金属单质,后两种金属的可溶性盐
3、前两种金属单质,一种酸,后金属的可溶性盐
如:证明 Zn>Fe>Cu
Zn、Cu、FeSO4溶液
Fe、ZnSO4溶液、 Cu SO4溶液
Zn 、 Fe 、Cu SO4、 FeSO4溶液
Fe 、 Zn、 盐酸 、 Cu SO4溶液
小 结:
1、金属的化学性质:
(1)大多数金属能与O2反应
(2)大多数金属能与稀HCl或稀H2SO4反应
(3)部分金属能与金属化合物的溶液反应
2、判断常见金属活泼性的方法
(1)金属与酸反应的剧烈程度
(2)金属与能否与金属化合物的溶液反应
(3)金属与氧气反应的难易程度
3、置换反应
单质+化合物——新单质+新化合物
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag PtAu
1.判断下列物质能否发生反应?若能,
写出相关化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液 (4)铝与硝酸银溶液
(5)银与氯化铜溶液 (6)镁与硫酸亚铁溶液
解答:可发生反应的:(2)(4)(6)
化学方程式:
(2)Zn + CuSO4 = Cu + ZnSO4
(4)Al +3AgNO3 = Al(NO3)3 + 3Ag
(6)Mg + FeSO4 = MgSO4 +Fe
了解金属与酸反应的图像的意义
1、右图为把等质量的均为+2价的三种金属A、B、C分别投入足量的酸中,横坐标代表______,纵坐标代表______ _。
在坐标系中,①水平线表示金属与酸反应已完成,水平线越高,说明_________ ,该二价金属的相对原子质量越____,(填“大”或“小”)。 ②倾斜线表示金属与酸反应正在进行,倾斜线与横坐标的夹角越大,表示反应的速率越___,(填“快”或“慢”),表示金属的活动性越 ____, (填“强”或“弱”)
时间
的质量
H2
/g
C
A
B
时间
氢气的质量
快
强
小
氢气的质量越多
典例探究
现有铁片、铜片、硝酸汞溶液和盐酸四种物质,为了确定Fe、Cu、Hg、H活动顺序,同学们设计了很多实验方案,其中用2个实验步骤便能确定它们的活动顺序的最佳方案。按实验步骤的顺序,写出有关化学反应方程式:
(1)________________________
(2)________________________
Fe+2HCl = FeCl2+H2↑
Cu+Hg(NO3)2 = Cu(NO3)2+Hg
1、小兰家中收藏一件清末的铝制佛像,该佛像至今保存十分完好。其主要原因是( )
A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应
C.铝不易被氧化
D.铝易氧化,但氧化铝具有保护内部铝的作用
D
2、下列物质不能由金属和酸反应直接生成的是 ( )
A、 ZnCl2 B、 CuSO4
C、 FeCl2 D 、Al2(SO4)3
B
4、X、Y、Z三种金属中,X、Y都能与盐酸反应,但Y与盐酸反应比X与盐酸反应剧烈,Z不与盐酸反应,试判断X、Y、Z三种金属的活动行顺序由强弱是( )
A、Y>X>Z B、Y>Z>X
C、Z>Y>X D、X>Y>Z
A
黄铜(铜锌合金)与黄金的外观很相似,一些不法商贩就会利用这一点,以次充好,贩卖假黄金(实际就是黄铜)。我们有什么方法来识别真金和假金呢?
1、能与盐酸,稀硫酸反应的金属是
它们反应的剧烈程度依次是 > > .
2、不能与盐酸,稀硫酸反应的金属是
3、镁、锌、铁、铜四种金属的活动性顺序是
是 > > > .
4、将镁、锌、铁、铜四种金属分为两类:
活泼金属 : .活泼金属: .
分类的依据是: .
5、以上反应都是由一种 和一种 反应生成新
的 和新的 ,叫做 反应。
谁答的快?
Mg Zn Fe
Mg Zn Fe
Cu
Mg Zn Fe Cu
Mg Zn Fe
Cu
它们是否与盐酸、硫酸反应
单质
化合物
单质
化合物
置换
氢气的制备和性质
一、氢气的物理性质
1.密度比空气小(比空气轻)是所 有气体中最小的 。
2.难溶于水,因此不和水反应。
3.无色无味,气体 。
二、氢气的化学性质
可燃性 氢气点燃后生成水。
2. 还原性 可使黑色氧化铜变红,同时生成水。
可燃性(纯净的)
化学方程式: 2 H2 + O2 = 2 H2O
(注意:点燃前必须验纯)
现象:燃烧时,发出淡蓝色的火焰,
并放出热量 有无色液滴生成。
点燃
还原性
化学方程式: H2+CuO = Cu+H2O
现象:(1)黑色粉末变成红色粉末;
(2)试管内壁有无色液滴产生。
加热
如何选择制取氢气的药品?
实验方案 实验现象 反应速率
①铁(Fe)与稀硫酸 (H2SO4)
②锌粒(Zn)与稀硫酸(H2SO4)
③镁(Mg)与稀硫酸 (H2SO4)
从以上实验的对比分析可以看出,第___组药品最适合用于实验室制取H2;为何不用浓盐酸和浓硫酸?
2
有气泡产生
有大量气泡产生
有大量气泡产生
较慢
适中
很快
1 .药品:
锌粒(Zn)和稀硫酸(H2SO4)
2 . 反应原理:
Zn+ H2SO4 = H 2 + ZnSO4
3.实验装置
制取装置:考虑反应物的状态、反应条件
收集装置:考虑气体的溶解性、密度
制取装置
收集装置
排水法
向下排空气法
向上排空气法
塑料隔板
选哪种?
向下排空气法收集氢气
集气瓶底部?
4.实验步骤:
(1).连接仪器,检查装置的气密性
(2).在试管中加入锌粒.
(3).在试管中倒入稀H2SO4
(4).用排水法收集一试管氢气
(5).验纯后再收集
氢气验纯的操作:
操作要领
用排水法或向下排空气法收集一试管氢气,用拇指堵住试管口,移近火焰,松开拇指点火
现象
结论
听到尖锐的“爆鸣”声
听到轻微的“噗”声
不纯
纯净
装置的气密性是保证实验成功的重要因素之一。
检查气密性的方法是:首先关闭排气导管,从顶部漏斗口注水,当漏斗下端被水封闭后再注水,水面不下降,表明装置气密性好;如果水面下降,表明装置气密性差。
缺点:①装置内部被水浸湿;
②如果已装入了固体试剂则不能再行检查。
9-2 金属的化学性质
第二课时
三.金属与盐溶液的反应
金属能与酸发生置换反应,其实质是什么?
那么金属能否与盐溶液也发生置换反应呢? 如何证明呢?
想一想
小资料:
早在2000多年前西汉时期就有“曾青得铁则化为铜”的记载。我国劳动人民早就认识了硫酸铜溶液里的铜能被铁置换出来,从而发明了湿法炼铜,揭开了湿法冶金术的序幕,成为人类冶炼史上的一个重要里程碑。
你能否得出金属和化合物溶液反应的一般规律呢?
现象:_________________________________________________
________________________________________________________
回忆:将铁钉投入到硫酸铜溶液中有何现象?
铁钉表面会有红色物质析出,若时间足够长,则溶液会从蓝色变为浅绿色。
Fe + CuSO4 = Cu + FeSO4
该反应的化学方程式:
三.金属与化合物溶液的反应
金属和盐反应
CuSO4+Fe=
FeSO4+Cu
(湿法炼铜!)
现象:铁表面覆盖一层亮红色的金属,溶液由蓝色变为浅绿色。
(置换反应)
硫酸铜溶液 硝酸银溶液 氯化钠溶液
锌
铁
铜
金属与某些盐溶液反应
学习任务一
硫酸铜溶液 硝酸银溶液 氯化钠溶液
锌 锌上有红色物质生成,溶液颜色逐渐变淡 锌上有银白色物质生成. 没有明显变化
铁 铁丝上有红色物质生成,溶液由蓝色逐渐变为浅绿色 铁丝上有银白色物质生成,溶液由无色逐渐变为浅绿色 没有明显变化
铜
没有明显变化 铜丝上有银白色物质生成,溶液由无色逐渐变为蓝色 没有明显变化
金属与某些盐溶液反应
学习任务一
Cu + 2AgNO3 == Cu(NO3)2 + 2Ag
Fe + CuSO4 == Fe SO4+ Cu
Zn+ CuSO4 == ZnSO4+ Cu
Zn + 2AgNO3 == Zn(NO3)2 + 2Ag
Fe + 2AgNO3 == Fe (NO3)2 + 2Ag
1、以上反应类型都属于 反应。
2、锌、铁、铜、银三种金属的活动性顺序是
讨论
置换
Zn > Fe > Cu >Ag
金属活动性由强到弱
交流共享
通过刚才的探究实验,你得到什么结论?
哪些金属能和盐溶液发生置换反应?
合作探究一
3、金属+盐溶液→新金属+新盐
规律:
1.前面的金属置换后面的金属。
2.盐是可溶盐
3.金属不能太活泼:K、Ca、Na不行
知识归纳
与盐溶液反应条件(口诀):
溶液中金属遇到盐,
前面能将后面换,
铁要生成亚铁盐,
钾、钙、钠靠边站。
2.有X Y Z三种金属,如果把X和Y分别放入
稀硫酸中, X 溶解并产生氢气,Y不反应;如果
把Y和Z分别放入硝酸银溶液中,过一会儿,在Y
的表面有银析出,而Z无变化.根据以上事实,判
断X Y Z的金属活动顺序.
解答: 金属活动性顺序 X>Y>Z
金属活动性顺序
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
由强逐渐减弱
常见金属的活动性顺序:
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
勤记忆
学习任务二
探究金属活动性强弱的方法
1、利用金属与酸反应
若能与酸反应,则说明该金属的活动性比 强,
若不能与酸反应,则说明该金属的活动性比 弱
如:将锌、铜投入到稀硫酸中,能反应的是 ,不能反应的是 ,说明活动性锌 铜
比较金属活动性的方法
2、利用金属与酸反应的速率,
反应的速率越快,金属的活动性越强
如:将同样大小锌、镁投入稀盐酸中,镁反应更剧烈,说明 的活动性比 强
比较金属活动性的方法
3、利用金属与盐溶液反应
若A能与B的盐溶液反应说明 A活动性 B;若不能反应,说明 A活动性 B
如:将铜投入到硝酸银溶液中,可看到 ,说明铜的活动性 ,将铜投入到硫酸锌溶液中,不能反应,说明铜的活动性 .
比较金属活动性的方法
验证三种金属活动性顺序取试剂的方法
1、前后金属中间盐
2、中间金属两头盐
4、前两种金属单质,后两种金属的可溶性盐
3、前两种金属单质,一种酸,后金属的可溶性盐
如:证明 Zn>Fe>Cu
Zn、Cu、FeSO4溶液
Fe、ZnSO4溶液、 Cu SO4溶液
Zn 、 Fe 、Cu SO4、 FeSO4溶液
Fe 、 Zn、 盐酸 、 Cu SO4溶液
小 结:
1、金属的化学性质:
(1)大多数金属能与O2反应
(2)大多数金属能与稀HCl或稀H2SO4反应
(3)部分金属能与金属化合物的溶液反应
2、判断常见金属活泼性的方法
(1)金属与酸反应的剧烈程度
(2)金属与能否与金属化合物的溶液反应
(3)金属与氧气反应的难易程度
3、置换反应
单质+化合物——新单质+新化合物
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag PtAu
1.判断下列物质能否发生反应?若能,
写出相关化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液 (4)铝与硝酸银溶液
(5)银与氯化铜溶液 (6)镁与硫酸亚铁溶液
解答:可发生反应的:(2)(4)(6)
化学方程式:
(2)Zn + CuSO4 = Cu + ZnSO4
(4)Al +3AgNO3 = Al(NO3)3 + 3Ag
(6)Mg + FeSO4 = MgSO4 +Fe
了解金属与酸反应的图像的意义
1、右图为把等质量的均为+2价的三种金属A、B、C分别投入足量的酸中,横坐标代表______,纵坐标代表______ _。
在坐标系中,①水平线表示金属与酸反应已完成,水平线越高,说明_________ ,该二价金属的相对原子质量越____,(填“大”或“小”)。 ②倾斜线表示金属与酸反应正在进行,倾斜线与横坐标的夹角越大,表示反应的速率越___,(填“快”或“慢”),表示金属的活动性越 ____, (填“强”或“弱”)
时间
的质量
H2
/g
C
A
B
时间
氢气的质量
快
强
小
氢气的质量越多
典例探究
现有铁片、铜片、硝酸汞溶液和盐酸四种物质,为了确定Fe、Cu、Hg、H活动顺序,同学们设计了很多实验方案,其中用2个实验步骤便能确定它们的活动顺序的最佳方案。按实验步骤的顺序,写出有关化学反应方程式:
(1)________________________
(2)________________________
Fe+2HCl = FeCl2+H2↑
Cu+Hg(NO3)2 = Cu(NO3)2+Hg
1、小兰家中收藏一件清末的铝制佛像,该佛像至今保存十分完好。其主要原因是( )
A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应
C.铝不易被氧化
D.铝易氧化,但氧化铝具有保护内部铝的作用
D
2、下列物质不能由金属和酸反应直接生成的是 ( )
A、 ZnCl2 B、 CuSO4
C、 FeCl2 D 、Al2(SO4)3
B
4、X、Y、Z三种金属中,X、Y都能与盐酸反应,但Y与盐酸反应比X与盐酸反应剧烈,Z不与盐酸反应,试判断X、Y、Z三种金属的活动行顺序由强弱是( )
A、Y>X>Z B、Y>Z>X
C、Z>Y>X D、X>Y>Z
A
黄铜(铜锌合金)与黄金的外观很相似,一些不法商贩就会利用这一点,以次充好,贩卖假黄金(实际就是黄铜)。我们有什么方法来识别真金和假金呢?
1、能与盐酸,稀硫酸反应的金属是
它们反应的剧烈程度依次是 > > .
2、不能与盐酸,稀硫酸反应的金属是
3、镁、锌、铁、铜四种金属的活动性顺序是
是 > > > .
4、将镁、锌、铁、铜四种金属分为两类:
活泼金属 : .活泼金属: .
分类的依据是: .
5、以上反应都是由一种 和一种 反应生成新
的 和新的 ,叫做 反应。
谁答的快?
Mg Zn Fe
Mg Zn Fe
Cu
Mg Zn Fe Cu
Mg Zn Fe
Cu
它们是否与盐酸、硫酸反应
单质
化合物
单质
化合物
置换
氢气的制备和性质
一、氢气的物理性质
1.密度比空气小(比空气轻)是所 有气体中最小的 。
2.难溶于水,因此不和水反应。
3.无色无味,气体 。
二、氢气的化学性质
可燃性 氢气点燃后生成水。
2. 还原性 可使黑色氧化铜变红,同时生成水。
可燃性(纯净的)
化学方程式: 2 H2 + O2 = 2 H2O
(注意:点燃前必须验纯)
现象:燃烧时,发出淡蓝色的火焰,
并放出热量 有无色液滴生成。
点燃
还原性
化学方程式: H2+CuO = Cu+H2O
现象:(1)黑色粉末变成红色粉末;
(2)试管内壁有无色液滴产生。
加热
如何选择制取氢气的药品?
实验方案 实验现象 反应速率
①铁(Fe)与稀硫酸 (H2SO4)
②锌粒(Zn)与稀硫酸(H2SO4)
③镁(Mg)与稀硫酸 (H2SO4)
从以上实验的对比分析可以看出,第___组药品最适合用于实验室制取H2;为何不用浓盐酸和浓硫酸?
2
有气泡产生
有大量气泡产生
有大量气泡产生
较慢
适中
很快
1 .药品:
锌粒(Zn)和稀硫酸(H2SO4)
2 . 反应原理:
Zn+ H2SO4 = H 2 + ZnSO4
3.实验装置
制取装置:考虑反应物的状态、反应条件
收集装置:考虑气体的溶解性、密度
制取装置
收集装置
排水法
向下排空气法
向上排空气法
塑料隔板
选哪种?
向下排空气法收集氢气
集气瓶底部?
4.实验步骤:
(1).连接仪器,检查装置的气密性
(2).在试管中加入锌粒.
(3).在试管中倒入稀H2SO4
(4).用排水法收集一试管氢气
(5).验纯后再收集
氢气验纯的操作:
操作要领
用排水法或向下排空气法收集一试管氢气,用拇指堵住试管口,移近火焰,松开拇指点火
现象
结论
听到尖锐的“爆鸣”声
听到轻微的“噗”声
不纯
纯净
装置的气密性是保证实验成功的重要因素之一。
检查气密性的方法是:首先关闭排气导管,从顶部漏斗口注水,当漏斗下端被水封闭后再注水,水面不下降,表明装置气密性好;如果水面下降,表明装置气密性差。
缺点:①装置内部被水浸湿;
②如果已装入了固体试剂则不能再行检查。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
